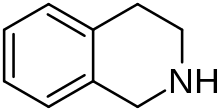
Тетрагидроизохинолин - Tetrahydroisoquinoline
 | |
| Имена | |
|---|---|
| Другие имена 1,2,3,4-тетрагидроизохинолин | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ЧЭМБЛ | |
| ChemSpider | |
| ECHA InfoCard | 100.001.864 |
PubChem CID | |
| Номер RTECS |
|
| UNII | |
| |
| |
| Характеристики | |
| C9ЧАС11N | |
| Молярная масса | 133,19 г / моль |
| Внешность | Темно-желтая жидкость |
| Плотность | 1,05 г / мл |
| Температура плавления | -30 ° С (-22 ° F, 243 К) |
| Точка кипения | От 235 до 239 ° C (от 455 до 462 ° F, от 508 до 512 K) |
| Опасности | |
Классификация ЕС (DSD) (устарело) | Раздражающий (Си) |
| R-фразы (устарело) | R36 / 37/38 |
| S-фразы (устарело) | S26 S36 |
| точка возгорания | 99 ° C (210 ° F, 372 K) (закрытая чашка) |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Тетрагидроизохинолин (TIQ или же THIQ) является органическое соединение с химической формулой C9ЧАС11N. Классифицируется как вторичный амин, это происходит от изохинолин путем гидрирования. Это бесцветная вязкая жидкость, которая смешивается с большинством органических растворителей. Тетрагидроизохинолиновый скелет встречается в ряде биологически активных соединений и лекарств.[1][2]
Реакции
Как вторичный амин тетрагидроизохинолин имеет слабоосновные свойства и образует соли с сильными кислотами. Его можно дегидрогенизировать до изохинолина и гидрогенизировать до декагидроизохинолина. Как и другие вторичные амины, тетрагидроизохинолин может окисляться до соответствующих нитрон с помощью пероксид водорода, катализируемый диоксид селена.[3]
Токсикология
Производные тетрагидроизохинолина могут образовываться в организме в виде метаболитов некоторых лекарств, и когда-то считалось, что они участвуют в развитии алкоголизм.[4] Эта теория теперь дискредитирована и больше не принимается научным сообществом.[5] но эндогенное производство нейротоксичных производных тетрагидроизохинолина, таких как норсалсолинол продолжают изучаться как возможные причины некоторых состояний, таких как болезнь Паркинсона.[6][7][8][9][10][11]
Тетрагидроизохинолины
Тетрагидроизохинолиновый скелет присутствует в ряде препаратов,[2] Такие как тубокурарин, один из миорелаксанты четвертичного аммония. Лекарства на основе 4-замещенных тетрагидроизохинолинов включают: номифензин[12] и диклофенсин. Их можно приготовить N-алкилирование бензиламинов галогеномацетофеноны.[13] Встречающиеся в природе тетрагидроизохинолины включают: Cherylline[14] и латифин.
Эспроквин,[15] который проявляет гипотензивную активность благодаря своим α-адреноблокирующим свойствам, произведен из THIQ.
Рекомендации
- ^ Митченсон, Эндрю (2000). «Насыщенные азотные гетероциклы». Журнал химического общества, Perkin Transactions 1 (17): 2862–2892. Дои:10.1039 / A908537H.
- ^ а б Скотт, Джек Д .; Уильямс, Роберт М. (2002). «Химия и биология противоопухолевых антибиотиков тетрагидроизохинолина». Химические обзоры. 102 (5): 1669–1730. Дои:10.1021 / cr010212u. PMID 11996547.
- ^ Мурахаши, С. (1987). «Катализируемое диоксидом селена окисление вторичных аминов пероксидом водорода. Простой синтез нитронов из вторичных аминов». Буквы Тетраэдра. 28 (21): 2383–2386. Дои:10.1016 / S0040-4039 (00) 96130-6.
- ^ Блюм, К .; Гамильтон, М. Г .; Hirst, M .; Уоллес, Дж. Э. (1978). «Предполагаемая роль алкалоидов изохинолина в алкоголизме: ссылка на опиаты». Алкоголизм: клинические и экспериментальные исследования. 2 (2): 113–120. Дои:10.1111 / j.1530-0277.1978.tb04710.x. PMID 350073.,Альтшулер, Х.Л .; Шиппенберг (1982). «Тетрагидроизохинолин и опиоидные субстраты алкогольного действия». Прогресс в клинических и биологических исследованиях. 90: 329–344. PMID 7202207., Майерс, Р. Д. (1989). «Изохинолины, бета-карболины и употребление алкоголя: участие опиоидных и дофаминергических механизмов». Experientia. 45 (5): 436–443. Дои:10.1007 / BF01952025. PMID 2656285. S2CID 1513683.
- ^ Майерс, Р. Д. (1996). «Тетрагидроизохинолины и алкоголизм: где мы сегодня?». Алкоголизм: клинические и экспериментальные исследования. 20 (3): 498–500. Дои:10.1111 / j.1530-0277.1996.tb01081.x. PMID 8727243., Musshoff, F .; Daldrup, T .; Bonte, W .; Leitner, A .; Леш, О. М. (1996). «Тетрагидроизохинолины и тетрагидро-бета-карболины на основе формальдегида в моче человека». Журнал хроматографии B. 683 (2): 163–176. Дои:10.1016/0378-4347(96)00106-5. PMID 8891913., Sällström Baum, S .; Hill, R .; Kiianmaa, K .; Роммельспахер, Х. (1999). «Влияние этанола на (R) - и (S) -салсолинол, салсолин и THP в прилежащем ядре крыс AA и ANA». Алкоголь (Фейетвилл, Нью-Йорк). 18 (2–3): 165–169. Дои:10.1016 / S0741-8329 (98) 00080-9. PMID 10456568., Musshoff, F .; Lachenmeier, D.W .; Schmidt, P .; Dettmeyer, R .; Мадея, Б. (2005). «Систематическое региональное исследование уровней дофамина, норсалолинола и (R / S) -салсолинола в областях человеческого мозга у алкоголиков». Алкоголизм: клинические и экспериментальные исследования. 29 (1): 46–52. Дои:10.1097 / 01.ALC.0000150011.81102.C2. PMID 15654290.
- ^ Kotake Y, Tasaki Y, Makino Y, Ohta S, Hirobe M (декабрь 1995 г.). «1-Бензил-1,2,3,4-тетрагидроизохинолин как агент, вызывающий паркинсонизм: новый эндогенный амин в мозге мышей и паркинсонической спинномозговой жидкости». Журнал нейрохимии. 65 (6): 2633–8. Дои:10.1046 / j.1471-4159.1995.65062633.x. PMID 7595560.
- ^ McNaught KS, Carrupt PA, Altomare C, Cellamare S, Carotti A, Testa B, Jenner P, Marsden CD (октябрь 1998 г.). «Производные изохинолина как эндогенные нейротоксины в этиологии болезни Паркинсона». Биохимическая фармакология. 56 (8): 921–33. Дои:10.1016 / S0006-2952 (98) 00142-7. PMID 9776302.
- ^ Lorenc-Koci E, Smiałowska M, Antkiewicz-Michaluk L, Gołembiowska K, Bajkowska M, Wolfarth S (2000). «Влияние острого и хронического введения 1,2,3,4-тетрагидроизохинолина на мышечный тонус, метаболизм дофамина в полосатом теле и иммуноцитохимию тирозингидроксилазы в черной субстанции у крыс». Неврология. 95 (4): 1049–59. Дои:10.1016 / S0306-4522 (99) 00511-4. PMID 10682712. S2CID 13549697.
- ^ Storch A, Ott S, Hwang YI, Ortmann R, Hein A, Frenzel S, Matsubara K, Ohta S, Wolf HU, Schwarz J (март 2002 г.). «Избирательная дофаминергическая нейротоксичность производных изохинолина, связанная с болезнью Паркинсона: исследования с использованием гетерологичных систем экспрессии переносчика дофамина». Биохимическая фармакология. 63 (5): 909–20. Дои:10.1016 / S0006-2952 (01) 00922-4. PMID 11911843.
- ^ Lorenc-Koci E, Antkiewicz-Michaluk L, Kamińska A, Lenda T, Zieba B, Wierońska J, Smiałowska M, Schulze G, Rommelspacher H (октябрь 2008 г.). «Влияние острого и хронического введения 1,2-диметил-6,7-дигидрокси-1,2,3,4-тетрагидроизохинолина на функцию нигростриатальной дофаминергической системы у крыс». Неврология. 156 (4): 973–86. Дои:10.1016 / j.neuroscience.2008.08.050. PMID 18809471. S2CID 44658852.
- ^ Кобаяси Х., Фукухара К., Тада-Оикава С., Яда Ю., Хираку Ю., Мурата М., Оикава С. (январь 2009 г.). «Механизмы окислительного повреждения ДНК и апоптоза, вызванные норсалолинолом, эндогенным производным тетрагидроизохинолина, связанным с болезнью Паркинсона». Журнал нейрохимии. 108 (2): 397–407. Дои:10.1111 / j.1471-4159.2008.05774.x. PMID 19012744.
- ^ Schneider, C. S .; Weber, K. H .; Daniel, H .; Bechtel, W. D .; Бёке-Кун, К. (1984). «Синтез и антидепрессивная активность производных 4-арилтетрагидротиено [2,3-c] пиридина». Журнал медицинской химии. 27 (9): 1150–1155. Дои:10.1021 / jm00375a011. PMID 6471069.
- ^ BG 49761
- ^ Cherylline
- ^ Gray, Allan P .; Шайли, Ричард Х. (1973). «Препарат и сердечно-сосудистое действие группы производных тетрагидроизохинолина». Журнал медицинской химии. 16 (7): 859–861. Дои:10.1021 / jm00265a028. ISSN 0022-2623. PMID 4146907.
