Тканевая инженерия сердечных клапанов - Tissue engineering of heart valves
Тканевые клапаны сердца (TEHV) предложить новое и прогрессивное предлагаемое лечение по созданию живого сердечного клапана для людей, которые нуждаются в полном или частичном сердце замена клапана. В настоящее время ежегодно имплантируется более четверти миллиона протезов клапанов сердца.[1] Предполагается, что количество пациентов, которым требуется хирургическая замена, только возрастет и даже утроится в течение следующих пятидесяти лет.[2] Хотя современные методы лечения, такие как механические клапаны или биологические клапаны не вредны для здоровья, у них обоих есть свои ограничения, так как механические клапаны требуют пожизненного использования антикоагулянтов, в то время как биологические клапаны подвержены структурной деградации и повторному функционированию.[2][3] Таким образом, на месте Тканевая инженерия сердечных клапанов (в исходном положении или месте) служит новым подходом, который исследует использование создания живого сердечного клапана, состоящего из собственных клеток хозяина, который способен расти, адаптироваться и взаимодействовать в биологической системе человеческого тела.[4]
Исследования еще не дошли до стадии клинических испытаний.
Процедура
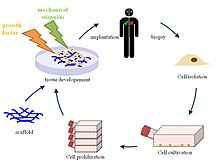
Строительные леса
Различный биоматериалы, независимо от того, являются ли они биологическими, синтетическими или их комбинацией, могут использоваться для создания каркасов, которые при имплантации в организм человека могут способствовать развитию хозяина регенерация тканей.[5] Сначала собирают клетки пациента, которым будет имплантирован каркас. Эти клетки расширяются и засеваются в созданный каркас, который затем вставляется внутрь человеческого тела.[6] Человеческое тело служит биореактором, который позволяет формировать внеклеточный матрикс (ECM) вместе с волокнистыми белками вокруг каркаса, чтобы обеспечить необходимую среду для сердца и сердечно-сосудистая система.[7] Первоначальная имплантация чужеродного каркаса запускает различные сигнальные пути, управляемые реакция на инородное тело для набора клеток из соседних тканей.[2] Новая сеть из нановолокон, окружающая каркас, имитирует собственный ECM тела хозяина.[8] Как только клетки начинают заселять клетку, каркас постепенно разрушается, оставляя после себя сконструированный сердечный клапан, сделанный из собственных клеток организма-хозяина, который полностью способен к репопуляции клеток и противостоять изменениям окружающей среды в организме.[9] Каркас, разработанный для тканевой инженерии, является одним из наиболее важных компонентов, поскольку он определяет структуру, жизнеспособность и функциональность ткани еще долгое время после имплантации и разрушения.
Биологические

Биологические каркасы могут быть созданы из донорской ткани человека или животных; однако ткани животных часто более популярны, поскольку они более доступны и более многочисленны.[10] Ксенотрансплантат сердечные клапаны от донора другого вида от реципиента могут быть от свиней, коров или овец.[8] Если используются ткани человека или животных, первым шагом в создании полезных каркасов является децеллюляризация, что означает удаление клеточного содержимого при сохранении матрицы ECM,[11] что выгодно по сравнению с производством синтетических каркасов с нуля. Были использованы многие методы децеллюляризации, такие как использование неионных и ионных детергентов, которые нарушают взаимодействия клеточного материала, или использование ферментов для расщепления пептидных связей, РНК и ДНК.[8]
Изготовлено
Существуют также современные подходы к производству каркасов и их привязке к биологическим сигналам.[2] Изготовленные каркасы также могут быть изготовлены с использованием биологических, синтетических или комбинации обоих материалов с нуля, чтобы имитировать естественный сердечный клапан, наблюдаемый с помощью методов визуализации. Поскольку строительные леса создаются из сырья, существует гораздо большая гибкость в управлении свойствами строительных лесов и их можно более точно адаптировать. Некоторые типы изготовленных каркасов включают твердые трехмерные пористые каркасы, которые имеют большую сеть пор, которая позволяет проходить клеточному мусору, обеспечивая дальнейший рост тканей и сосудов.[12] Трехмерные пористые каркасы могут быть изготовлены с помощью трехмерной печати или использования различных полимеров, от полигликолевой кислоты (PGA) и полимолочной кислоты (PLA) до более естественных полимеров, таких как коллаген.[8]
Волокнистые каркасы потенциально могут точно соответствовать структуре ECM за счет использования волокон, которые имеют высокий фактор роста. Методы производства волокнистых каркасов включают: электроспиннинг,[13][11] в котором жидкий раствор полимеров растягивается под действием высокого электрического напряжения для получения тонких волокон. В отличие от трехмерных пористых каркасов, волокнистые каркасы имеют очень маленький размер пор, что предотвращает проникновение клеток в каркас.[14]
Каркасы из гидрогеля создаются путем сшивания гидрофильных полимеров посредством различных реакций, таких как свободнорадикальная полимеризация или реакция сопряженного присоединения.[8] Гидрогели полезны, потому что они имеют высокое содержание воды, что позволяет легко проходить питательным веществам и мелким материалам.[15]
Биосовместимость
В биосовместимость Хирургически имплантированный чужеродный биоматериал относится к взаимодействиям между биоматериалом и тканью тела хозяина. Клеточная линия, а также тип клеток, например фибробласты может в значительной степени влиять на реакцию тканей на имплантированные чужеродные устройства, изменяя морфологию клеток.[16] Таким образом, источник клеток, а также адсорбция белка, которые зависят от свойств поверхности биоматериала, играют решающую роль в тканевом ответе и клеточной инфильтрации на участке каркаса.
Методология
Воспалительная реакция
Острое воспаление
Имплантация любого инородного устройства или материала хирургическим путем приводит по крайней мере к некоторой степени травмы ткани. Следовательно, особенно при частичном или полном удалении нативного сердечного клапана, травма ткани вызовет каскад воспалительных реакций и вызовет острое воспаление. В начальной фазе острого воспаления расширение сосудов происходит, чтобы увеличить приток крови к месту раны вместе с высвобождением факторов роста, цитокинов и других иммунных клеток. Кроме того, клетки выделяют активные формы кислорода и цитокины, которые вызывают вторичное повреждение окружающей ткани.[17] Затем эти химические факторы способствуют привлечению других иммунных клеток, таких как моноциты или белые кровяные тельца, которые способствуют образованию тромба и богатой белком матрицы.
Хроническое воспаление
Если острая воспалительная реакция сохраняется, организм подвергается хроническое воспаление. Во время этой фазы постоянного и системного воспаления одной из основных движущих сил является проникновение макрофаги. Макрофаги и лимфоциты вызывают образование новых тканей и кровеносных сосудов, чтобы помочь доставить питательные вещества к участку биоматериала. Затем новая фиброзная ткань инкапсулирует чужеродный биоматериал, чтобы минимизировать взаимодействие между биоматериалом и окружающей тканью. Хотя пролонгирование хронического воспаления может быть вероятным признаком инфекции, воспаление может иногда присутствовать в течение пяти лет после операции. Хроническое воспаление, отмеченное наличием фиброза и воспалительных клеток, наблюдалось в клетках крыс через 30 дней после имплантации устройства.[18]
После хронического воспаления примерно через 60 дней после имплантации происходит минерализация из-за накопления клеточного мусора и кальцификация, что может поставить под угрозу функциональность биосовместимых имплантированных устройств in vivo.

Реакция на инородное тело
В нормальных физиологических условиях воспалительные клетки защищают организм от посторонних предметов, и организм подвергается воздействию реакция на инородное тело основан на адсорбции крови и белков на поверхности биоматериала. В первые две-четыре недели после имплантации существует связь между прикрепленными к биоматериалу макрофагами и экспрессией цитокинов около места инородного имплантата, которую можно исследовать с помощью полуколичественная ОТ-ПЦР.[19] Макрофаги сливаются вместе, образуя гигантские клетки инородного тела (FBGC), которые аналогичным образом экспрессируют рецепторы цитокинов на своих клеточных мембранах и активно участвуют в воспалительной реакции. Отказ устройства в кардиостимуляторах из органического полиэфирполиуретана (PEU) по сравнению с силиконовым каучуком демонстрирует, что реакция на инородное тело действительно может привести к разрушению биоматериалов, вызывая последующие отказы устройства. Использование для предотвращения нарушения функциональности и долговечности предлагается для минимизации и замедления скорости разложения биоматериала.[19]
Льготы
Сердечные клапаны, изготовленные из тканевой инженерии, имеют определенные преимущества перед традиционными биологическими и механическими клапанами:
- Живой клапан - вариант замены живого сердечного клапана очень оптимален для детей, поскольку живой клапан имеет способность расти и реагировать на свою биологическую среду, что особенно полезно для детей, чьи тела постоянно меняются.[11] Этот вариант поможет уменьшить количество повторных операций, необходимых в жизни ребенка.
- Индивидуальный процесс - поскольку каркасы, используемые в тканевой инженерии, могут быть изготовлены с нуля, обеспечивается более высокая степень гибкости и контроля. Это позволяет адаптировать тканевые клапаны сердца и его свойства, такие как форма каркаса и состав биоматериала, специально для пациента.
Риски и проблемы

Многие риски и проблемы еще предстоит изучить и изучить, прежде чем тканевые сердечные клапаны можно будет полностью реализовать в клинической практике:
- Загрязнение - определенные исходные материалы могут способствовать созданию микробиологической среды, способствующей восприимчивости к вирусам и инфекционным заболеваниям.[20] Каждый раз, когда внешний каркас имплантируется в человеческое тело, заражение, хотя и неизбежно, может быть уменьшено за счет применения стерильной техники.
- Взаимодействие с каркасом - существует множество рисков, связанных с взаимодействием между клетками и имплантированным каркасом, поскольку конкретные требования к биосовместимости все еще в значительной степени неизвестны в текущих исследованиях.[20] Реакция на эти взаимодействия также очень индивидуальна и зависит от биологической среды конкретного пациента; следовательно, ранее исследованные модели на животных могут не точно отображать результаты в организме человека.[21] Из-за высокой степени взаимодействия между каркасом и окружающей тканью необходимо тщательно учитывать такие свойства, как биоразлагаемость, биосовместимость и иммуногенность, поскольку они являются ключевыми факторами в характеристиках конечного продукта.[20][11]
- Структурная сложность - сердечные клапаны с их неоднородной структурой очень сложны и динамичны,[21] таким образом, создавая проблему для имитации тканевых клапанов. Новые клапаны должны обладать высокой прочностью, а также соответствовать анатомической форме и механическим функциям исходного клапана.[11]
История
Синтетические подмости
Проведены исследования засеянных каркасов из полимеров с различными клеточными линиями. in vitro, в котором каркасы со временем деградировали, оставляя после себя клеточный матрикс и белки. Первое исследование тканевой инженерии сердечных клапанов было опубликовано в 1995 году.[11] В течение 1995 и 1996 годов Шинока использовал каркас из полигликолевой кислоты (PGA), одобренный FDA для имплантации человеку, и засеял его эндотелиальными клетками и фибробластами барана с целью замены створки клапана легочной артерии овцы.[22] В результате исследования Шинока был сконструирован сердечный клапан, который был намного толще и жестче, что побудило Hoerstrup провести исследование по замене всех трех створок легочного клапана у овцы с использованием каркаса из поли-4-гидроксибутирата (P4HB), покрытого поли-4-гидроксибутиратом, и овец. эндотелиальные клетки и миофибробласты.[23]
Биологические каркасы
Другой изучаемый вариант заключался в использовании децеллюляризованных биологических каркасов и засева их соответствующими клетками. in vitro.[21] В 2000 году Steinhoff имплантировал децеллюляризованный каркас клапана легочной артерии барана, засеянный эндотелиальными клетками барана и миофибробластами.[24] Затем Домен создал децеллюляризованный криоконсервированный каркас легочного аллотрансплантата и засеял его эндотелиальными клетками сосудов человека, чтобы реконструировать тракт оттока правого желудочка (RVOT) у пациента в 2002 году.[25] Перри в 2003 году засеял каркас PGA, покрытый P4HB, мезенхимальными стволовыми клетками барана. in vitro; однако in vivo исследование не проводилось.[26] В 2004 году Иваи провел исследование с использованием поли (молочно-гликолевой кислоты) PLGA, смешанного с коллагеновым шарообразным каркасом из микрогубок, который был засеян эндотелиальными и гладкомышечными клетками в месте легочной артерии собаки.[27] В 2005 году Сазерленд использовал засеянные мезенхимальными стволовыми клетками овцы каркас PGA и поли-L-молочной кислоты (PLLA) для замены всех трех створок легочного клапана у овцы.[28]
В естественных условиях исследования имплантатов
В нескольких исследованиях использовалась тканевая инженерия сердечных клапанов. in vivo у животных и людей. В 2000 году Матени провел исследование, в котором использовал подслизистую основу тонкой кишки свиньи для замены одной створки клапана легочной артерии.[29] Ограниченные исследования также проводились в клинических условиях. Например, в 2001 году Элкинс имплантировал пациентам децеллюляризованные человеческие легочные клапаны SynerGraft.[30] Саймон аналогичным образом использовал децеллюляризованные свиньи клапаны SynerGraft для имплантации детям;[31] однако эти клапаны повсеместно вышли из строя, так как вместо них на участке каркаса обнаружено довольно большое количество воспалительных клеток.[32][33][8] Исследования, проведенные Dohmen, Konertz и его коллегами из Берлина, Германия, включали имплантацию биологического клапана свиньи 50 пациентам, перенесшим Росс операция с 2002 по 2004 гг.[33] С использованием децеллюляризованного свиного ксенотрансплантата клапана, также называемого Matrix P, у взрослых со средним возрастом 46 лет целью исследования было предложить предложение по замене легочного клапана. Хотя некоторые пациенты умерли в послеоперационном периоде и были подвергнуты повторной операции, краткосрочные результаты, похоже, идут хорошо, так как клапан ведет себя так же, как родной, здоровый клапан.[34] Одно испытание на животных объединило транскатетерная замена аортального клапана (TAVR) процедура с тканевыми сердечными клапанами (TEHV). Стент TAVR, интегрированный с внеклеточным матриксом, полученным из человеческих клеток, был имплантирован и исследован на овце, у которых клапан поддерживал структурную целостность и инфильтрацию клеток, что позволило потенциальному клиническому применению расширить TAVR для более молодых пациентов.[35]
Исследование
Хотя многие in vitro и in vivo исследования были протестированы на животных моделях, перевод с животных моделей на людей еще не начался. Необходимо учитывать такие факторы, как размер хирургических разрезов, продолжительность процедуры, а также доступные ресурсы и стоимость.[36] Синтетические наноматериалы могут улучшить каркасы, используемые в тканевой инженерии сердечных клапанов. Использование нанотехнологии может помочь расширить полезные свойства изготовленных каркасов, такие как более высокая прочность на разрыв.[37]
Смотрите также
использованная литература
- ^ Джегатисваран А, Бутани Дж. (2006). «Патология инфекционно-воспалительных заболеваний клапанов сердца». Сердечно-сосудистая патология. 15 (5): 252–255. Дои:10.1016 / j.carpath.2006.05.002. PMID 16979031.
- ^ а б c d Мол А., Смитс А.И., Бутен CV, Баайдженс Ф.П. (май 2009 г.). «Тканевая инженерия сердечных клапанов: достижения и текущие проблемы». Экспертиза медицинских изделий. 6 (3): 259–75. Дои:10.1586 / erd.09.12. PMID 19419284.
- ^ Goldsmith I, Turpie AG, Lip GY (ноябрь 2002 г.). «Вальварский порок сердца и протезы сердечных клапанов». BMJ. 325 (7374): 1228–31. Дои:10.1136 / bmj.325.7374.1228. ЧВК 1124694. PMID 12446543.
- ^ Резюме Бутена, Смитс А.И., Баайдженс Ф.П. (29.05.2018). «Можно ли выращивать клапаны внутри сердца? Перспективы инженерии тканей сердечного клапана на основе материалов». Границы сердечно-сосудистой медицины. 5: 54. Дои:10.3389 / fcvm.2018.00054. ЧВК 5987128. PMID 29896481.
- ^ «Биоматериалы и каркасы для тканевой инженерии». Материалы сегодня. 14 (3): 88–95. 2011-03-01. Дои:10.1016 / S1369-7021 (11) 70058-X. ISSN 1369-7021.
- ^ Шмидт Д., Stock UA, Hoerstrup SP (август 2007 г.). «Тканевая инженерия сердечных клапанов с использованием децеллюляризованных ксеногенных или полимерных стартовых матриц». Философские труды Лондонского королевского общества. Серия B, Биологические науки. 362 (1484): 1505–12. Дои:10.1098 / rstb.2007.2131. ЧВК 2440411. PMID 17588875.
- ^ Gandaglia A, Bagno A, Naso F, Spina M, Gerosa G (апрель 2011 г.). «Клетки, каркасы и биореакторы для тканевых сердечных клапанов: путь от базовых концепций к современным инновациям в области развития». Европейский журнал кардио-торакальной хирургии. 39 (4): 523–31. Дои:10.1016 / j.ejcts.2010.07.030. PMID 21163670.
- ^ а б c d е ж Яна С., Теффт Б.Дж., Spoon DB, Simari RD (июль 2014 г.). «Каркасы для тканевой инженерии сердечных клапанов». Acta Biomaterialia. 10 (7): 2877–93. Дои:10.1016 / j.actbio.2014.03.014. PMID 24675108.
- ^ Сюэ Ю., Сант В., Филиппи Дж., Сант С. (январь 2017 г.). «Биоразлагаемые и биомиметические эластомерные каркасы для тканевых клапанов сердца». Acta Biomaterialia. 48: 2–19. Дои:10.1016 / j.actbio.2016.10.032. PMID 27780764.
- ^ Алрефай М.Т., Мурали Д., Пол А., Ридван К.М., Коннелл Дж. М., Шум-Тим Д. (2015-05-14). «Инженерия и регенерация сердечной ткани с использованием клеточной терапии». Стволовые клетки и клонирование: достижения и приложения. 8: 81–101. Дои:10.2147 / SCCAA.S54204. ЧВК 4437607. PMID 25999743.
- ^ а б c d е ж Чунг Д.Й., Дуан Б., Мясник Д.Т. (2015). «Текущий прогресс в тканевой инженерии сердечных клапанов: многомасштабные проблемы, многомасштабные решения». Мнение эксперта по биологической терапии. 15 (8): 1155–72. Дои:10.1517/14712598.2015.1051527. ЧВК 4883659. PMID 26027436.
- ^ Loh QL, Choong C (декабрь 2013 г.). «Трехмерные каркасы для тканевой инженерии: роль пористости и размера пор». Тканевая инженерия, часть B: обзоры. 19 (6): 485–502. Дои:10.1089 / ten.teb.2012.0437. ЧВК 3826579. PMID 23672709.
- ^ Брахим Д.М., Какароугкас А., Аллам Н.К. (2017). «Последние достижения в области электропряденых каркасов в качестве матриц для тканевых сердечных клапанов». Материалы сегодня Химия. 5: 11–23. Дои:10.1016 / j.mtchem.2017.05.001. ISSN 2468-5194.
- ^ Bružauskaitė I, Bironaitė D, Bagdonas E, Bernotienė E (май 2016 г.). «Каркасы и клетки для регенерации тканей: разные размеры пор каркаса - разные клеточные эффекты». Цитотехнология. 68 (3): 355–69. Дои:10.1007 / s10616-015-9895-4. ЧВК 4846637. PMID 26091616.
- ^ Чжу Дж., Марчант Р. Э. (сентябрь 2011 г.). «Конструктивные свойства гидрогелевых тканеинженерных каркасов». Экспертиза медицинских изделий. 8 (5): 607–26. Дои:10.1586 / erd.11.27. ЧВК 3206299. PMID 22026626.
- ^ Мораис Дж. М., Пападимитракопулос Ф., Берджесс Д. Д. (июнь 2010 г.). «Взаимодействие биоматериалов / тканей: возможные решения для преодоления реакции на инородное тело». Журнал AAPS. 12 (2): 188–96. Дои:10.1208 / с12248-010-9175-3. ЧВК 2844517. PMID 20143194.
- ^ Миттал, Маниш; Сиддики, Мохаммад Ризван; Тран, Хием; Reddy, Sekhar P .; Малик, Асрар Б. (01.03.2014). "Реактивные формы кислорода при воспалении и повреждении тканей". Антиоксиданты и редокс-сигналы. 20 (7): 1126–1167. Дои:10.1089 / ars.2012.5149. ISSN 1523-0864. ЧВК 3929010. PMID 23991888.
- ^ Onuki Y, Bhardwaj U, Papadimitrakopoulos F, Burgess DJ (ноябрь 2008 г.). «Обзор биосовместимости имплантируемых устройств: современные проблемы преодоления реакции на инородное тело». Журнал диабетической науки и технологий. 2 (6): 1003–15. Дои:10.1177/193229680800200610. ЧВК 2769826. PMID 19885290.
- ^ а б Андерсон Дж. М., Родригес А., Чанг Д. Т. (апрель 2008 г.). «Реакция инородного тела на биоматериалы». Семинары по иммунологии. 20 (2): 86–100. Дои:10.1016 / j.smim.2007.11.004. ЧВК 2327202. PMID 18162407.
- ^ а б c Уильямс Д. (май 2004 г.). «Польза и риск в тканевой инженерии». Материалы сегодня. 7 (5): 24–29. Дои:10.1016 / с 1369-7021 (04) 00232-9.
- ^ а б c Mendelson K, Schoen FJ (декабрь 2006 г.). «Тканевая инженерия сердечного клапана: концепции, подходы, прогресс и проблемы». Анналы биомедицинской инженерии. 34 (12): 1799–819. Дои:10.1007 / s10439-006-9163-z. ЧВК 1705506. PMID 17053986.
- ^ Шинока Т., Брейер К.К., Танель Р.Э., Зунд Дж., Миура Т., Ма П.Х., Лангер Р., Ваканти Дж. П., Майер Дж. Э. (декабрь 1995 г.). «Тканевая инженерия клапанов сердца: исследование замены створки клапана на модели ягненка». Летопись торакальной хирургии. 60 (6 Прил.): S513-6. Дои:10.1016/0003-4975(95)00733-4. PMID 8604922.
- ^ Hoerstrup SP, Sodian R, Daebritz S, Wang J, Bacha EA, Martin DP, Moran AM, Guleserian KJ, Sperling JS, Kaushal S, Vacanti JP, Schoen FJ, Mayer JE (ноябрь 2000 г.). «Функциональные живые трехстворчатые сердечные клапаны, выращенные in vitro». Тираж. 102 (19 Дополнение 3): III44-9. Дои:10.1161 / 01.cir.102.suppl_3.iii-44. PMID 11082361.
- ^ Штайнхофф Г., Сток Ю., Карим Н., Мертшинг Х, Тимке А., Мелисс Р. Р., Петиг К., Хаверих А., Бадер А. (ноябрь 2000 г.). «Тканевая инженерия клапанов легочного сердца на каналах аллогенного бесклеточного матрикса: восстановление клапанной ткани in vivo». Тираж. 102 (19 Дополнение 3): III50-5. Дои:10.1161 / 01.cir.102.suppl_3.iii-50. PMID 11082362.
- ^ Домен П.М., Коста Ф., Лопес С.В., Йоши С., Соуза Ф.П., Вилани Р., Коста М.Б., Конерц В. (2005-03-09). «Результаты имплантации децеллюляризованного сердечного клапана свиньи в модель молодых овец». Форум кардиохирургии. 8 (2): E100–4, обсуждение E104. Дои:10.1532 / hsf98.20041140. PMID 15769723.
- ^ Perry TE, Kaushal S, Sutherland FW, Guleserian KJ, Bischoff J, Sacks M, Mayer JE (март 2003 г.). «Премия ассоциации директоров торакальной хирургии. Костный мозг как источник клеток для тканевой инженерии сердечных клапанов». Летопись торакальной хирургии. 75 (3): 761–7, обсуждение 767. Дои:10.1016 / S0003-4975 (02) 03776-1. PMID 12645690.
- ^ Иваи С., Сава И, Итикава Х, Такетани С., Учимура Э, Чен Дж, Хара М., Мияке Дж, Мацуда Х (сентябрь 2004 г.). «Биоразлагаемый полимер с микрогубкой коллагена служит новым биоинженерным сердечно-сосудистым протезом». Журнал торакальной и сердечно-сосудистой хирургии. 128 (3): 472–9. Дои:10.1016 / j.jtcvs.2004.04.013. PMID 15354111.
- ^ Сазерленд Ф.В., Перри Т.Е., Ю-Й, Шервуд М.К., Рабкин Э., Масуда Й., Гарсия Г.А., Маклеллан Д.Л., Энгельмайр Г.С., Сакс М.С., Шон Ф.Дж., Майер Дж.Э. (май 2005 г.). «От стволовых клеток до жизнеспособного аутологичного полулунного сердечного клапана». Тираж. 111 (21): 2783–91. Дои:10.1161 / CIRCULATIONAHA.104.498378. PMID 15927990.
- ^ Матени Р.Г., Хатчисон М.Л., Драйден П.Е., Хайлз М.Д., Шаар С.Дж. (ноябрь 2000 г.). «Подслизистая оболочка тонкой кишки свиньи как заменитель створки клапана легочной артерии». Журнал болезней сердечного клапана. 9 (6): 769–74, обсуждение 774–5. PMID 11128782.
- ^ Элкинс Р.К., Доусон П.Е., Голдштейн С., Уолш С.П., Блэк К.С. (май 2001 г.). «Децеллюляризированные аллотрансплантаты клапана человека». Летопись торакальной хирургии. 71 (5 Прил.): С428-32. Дои:10.1016 / S0003-4975 (01) 02503-6. PMID 11388241.
- ^ Саймон П., Казимир М.Т., Сибахер Г., Вайгель Г., Ульрих Р., Зальцер-Мухар Ю., Ридер Е., Вольнер Е. (июнь 2003 г.). «Раннее нарушение тканевой инженерии клапана сердца свиньи SYNERGRAFT у педиатрических пациентов». Европейский журнал кардио-торакальной хирургии. 23 (6): 1002–6, обсуждение 1006. Дои:10.1016 / S1010-7940 (03) 00094-0. PMID 12829079.
- ^ Sayk F, Bos I., Schubert U, Wedel T., Sievers HH (май 2005 г.). «Гистопатологические находки в новом децеллюляризованном легочном гомотрансплантате: исследование аутопсии». Летопись торакальной хирургии. 79 (5): 1755–8. Дои:10.1016 / j.athoracsur.2003.11.049. PMID 15854972.
- ^ а б Веселый I (октябрь 2005 г.). «Тканевая инженерия клапана сердца». Циркуляционные исследования. 97 (8): 743–55. Дои:10.1161 / 01.RES.0000185326.04010.9f. PMID 16224074.
- ^ Конерц В., Домен П.М., Лю Дж., Бехольц С., Душе С., Познер С., Лембке А., Эрдбрюггер В. (январь 2005 г.). «Гемодинамические характеристики децеллюляризованного ксенотрансплантата Matrix P для замены клапана легочной артерии во время операции Росса». Журнал болезней сердечного клапана. 14 (1): 78–81. PMID 15700440.
- ^ Линтас В., Фиоретта Е.С., Мотта С.Е., Дейкман П.Е., Пенсалфини М., Мацца Е., Калискан Е., Родригес Х., Липиски М., Зауэр М., Цезарович Н., Хёрструп С.П., Эммерт М.Я. (декабрь 2018 г.). «Разработка нового сердечного клапана, полученного из клеток человека, для замены транскатетерного клапана аорты: технико-экономическое обоснование in vitro и in vivo». Журнал кардиоваскулярных трансляционных исследований. 11 (6): 470–482. Дои:10.1007 / s12265-018-9821-1. PMID 30105605.
- ^ Шинока Т., Миячи Х (ноябрь 2016 г.). «Текущее состояние тканевой инженерии клапана сердца». Всемирный журнал детской хирургии и хирургии врожденных пороков сердца. 7 (6): 677–684. Дои:10.1177/2150135116664873. PMID 27834758.
- ^ Риппель Р.А., Ганбари Х., Сейфалян А.М. (июль 2012 г.). «Сердечный клапан с тканевой инженерией: будущее кардиохирургии». Всемирный журнал хирургии. 36 (7): 1581–91. Дои:10.1007 / s00268-012-1535-у. PMID 22395345.
