Тропинон - Tropinone - Wikipedia
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК 8-Метил-8-азабицикло [3.2.1] октан-3-он | |
| Другие имена 3-тропинон | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ЧЭБИ | |
| ChemSpider | |
| DrugBank | |
| ECHA InfoCard | 100.007.756 |
PubChem CID | |
| |
| |
| Характеристики | |
| C8ЧАС13НЕТ | |
| Молярная масса | 139,195 г / моль |
| Внешность | Коричневое твердое вещество |
| Температура плавления | 42,5 ° С (108,5 ° F, 315,6 К) |
| Точка кипения | (разлагается) |
| Опасности | |
| NFPA 704 (огненный алмаз) | |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Тропинон является алкалоид, синтезированный в 1917 г. Роберт Робинсон как синтетический предшественник атропин, дефицитный товар во время Первая Мировая Война.[1][2] Тропинон и алкалоиды кокаин и атропин имеют одно и то же тропан основная структура. Соответствующий ему конъюгат кислоты при pH 7,3 основных разновидностей известен как тропиниумон.[3]
Синтез
Первый синтез тропинона был осуществлен Ричард Вильштеттер в 1901 году. Это началось с, казалось бы, родственной циклогептанон, но потребовалось много шагов для введения азотного мостика; Общая урожай для пути синтеза составляет всего 0,75%.[4] Вильштеттер ранее синтезировал кокаин из тропинона, что было первым синтезом и выяснением структуры кокаина.[5]

«Двойная реакция Манниха» Робинсона
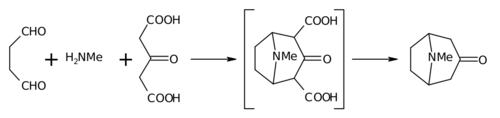
Синтез 1917 года Робинсона считается классическим в полный синтез[7] благодаря своей простоте и биомиметическому подходу. Тропинон - это бициклическая молекула, но реагенты используемые при его приготовлении довольно просты: янтарный альдегид, метиламин и ацетонедикарбоновая кислота (или даже ацетон ). Синтез - хороший пример биомиметик реакция или синтез биогенетического типа потому что биосинтез использует те же строительные блоки. Он также демонстрирует тандемная реакция в однокамерный синтез. Кроме того, выход синтеза составил 17%, а с последующими улучшениями превысил 90%.[4]
Эта реакция описывается как внутримолекулярный «двойной» Реакция Манниха "по очевидным причинам. Он не уникален в этом отношении, поскольку другие также пытались использовать его в синтезе пиперидина.[8][9]
Вместо ацетона ацетонедикарбоновая кислота известна как "синтетический эквивалент «группы 1,3-дикарбоновой кислоты являются так называемыми»активация групп «для облегчения реакций образования кольца. Соль кальция присутствует в виде»буфер «поскольку утверждается, что более высокие выходы возможны, если реакция проводится при»физиологический pH ".
Механизм реакции
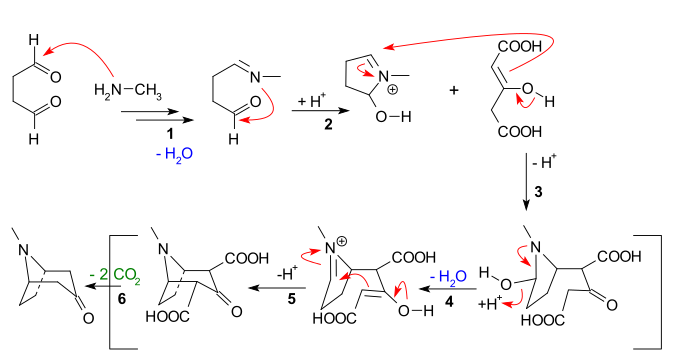
Основные особенности, очевидные из приведенной ниже последовательности реакций:
- Нуклеофильное добавление из метиламин к янтарный альдегид с последующей потерей воды для создания я добываю
- Внутримолекулярный добавление имина ко второму альдегидному звену и замыкание первого кольца
- Межмолекулярный Реакция Манниха из энолировать дикарбоксилата ацетона
- Образование нового енолята и образование нового имина с потерей воды на
- Вторая внутримолекулярная реакция Манниха и замыкание второго кольца
- Потеря 2 карбоксильных групп до тропинона
Некоторые авторы действительно пытались сохранить одну из СО.2H группы.[10]
CO2R-тропинон имеет 4 стереоизомера, хотя соответствующие экгонидин сложный алкиловый эфир имеет только пару энантиомеров.
Снижение тропинона
Снижение уровня тропинона опосредуется НАДФН -зависимые ферменты редуктазы, которые были охарактеризованы у многих видов растений.[11] Все эти виды растений содержат два типа ферментов редуктазы, тропинонредуктазу I и тропинонредуктазу II. TRI производит тропин, а TRII производит псевдотропин. Из-за различных кинетических характеристик и характеристик pH / активности ферментов, а также из-за того, что активность TRI в 25 раз выше, чем у TRII, большая часть восстановления тропинона происходит за счет TRI с образованием тропина.[12]

Смотрите также
- 2-Carbomethoxytropinone (2-CMT) промежуточное звено в создании экгонин аналоги кокаина
Рекомендации
- ^ Робинсон, Р. (1917). "LXIII. Синтез тропинона". Журнал химического общества, Сделки. 111: 762–768. Дои:10.1039 / CT9171100762.
- ^ Николау, К.С.; Vourloumis, D .; Winssinger, N .; Баран, П.С. (2000). «Искусство и наука полного синтеза на заре двадцать первого века». Angewandte Chemie International Edition. 39 (1): 44–122. Дои:10.1002 / (SICI) 1521-3773 (20000103) 39: 1 <44 :: AID-ANIE44> 3.0.CO; 2-L. PMID 10649349.
- ^ Химические объекты, представляющие биологический интерес Идентификационный код: ЧЭБИ: 57851 «тропиниумон».
- ^ а б Смит, Вим А .; Смит, Уильям А .; Бочков Алексей Феодосевич; Кэпл, Рон (1998). Органический синтез. Дои:10.1039/9781847551573. ISBN 978-0-85404-544-0.
- ^ Хамфри, А. Дж .; О'Хаган, Д. (2001). «Биосинтез тропановых алкалоидов. Нерешенная вековая проблема». Отчеты о натуральных продуктах. Королевское химическое общество. 18 (5): 494–502. Дои:10.1039 / b001713м. PMID 11699882.
- ^ Добл, Мукеш; Крутивенти, Анил Кумар (2007). Зеленая химия и инженерия. Оксфорд: Эльзевир. п. 34. ISBN 978-0-12-372532-5.
- ^ Берч, А. Дж. (1993). «Изучение научной легенды: синтез тропинона сэра Роберта Робинсона, F.R.S». Примечания и отчеты Лондонского королевского общества. 47 (2): 277–296. Дои:10.1098 / рснр.1993.0034. JSTOR 531792.
- ^ Wang, S .; Sakamuri, S .; Enyedy, I.J .; Козиковский, А. П .; Deschaux, O .; Bandyopadhyay, B.C .; Tella, S. R .; Zaman, W. A .; Джонсон, К. М. (2000). «Открытие нового ингибитора переносчика дофамина, 4-гидрокси-1-метил-4- (4-метилфенил) -3-пиперидил-4-метилфенилкетона, в качестве потенциального антагониста кокаина посредством поиска фармакофоров в базе данных 3D. Молекулярное моделирование, структура- отношения активности и поведенческие фармакологические исследования ". Журнал медицинской химии. 43 (3): 351–360. Дои:10.1021 / jm990516x. PMID 10669562.
- ^ Wang, S .; Сакамури; Ениеды; Козиковский; Заман; Джонсон (2001). «Молекулярное моделирование, взаимосвязь между структурой и активностью и изучение функционального антагонизма 4-гидрокси-1-метил-4- (4-метилфенил) -3-пиперидил-4-метилфенилкетонов как нового класса ингибиторов переносчиков дофамина». Биоорганическая и медицинская химия. 9 (7): 1753–1764. Дои:10.1016 / S0968-0896 (01) 00090-6. PMID 11425577.
- ^ Финдли, С. П. (1957). «Относительно 2-карбометокситропинона». Журнал органической химии. 22 (11): 1385–1394. Дои:10.1021 / jo01362a022.
- ^ А. Портстефен; Б. Дрегер и А. Нарстедт (1992). «Два фермента, восстанавливающих тропинон, из корневых культур, трансформированных Datura stramonium». Фитохимия. 31 (4): 1135. Дои:10.1016 / 0031-9422 (92) 80247-С.
- ^ Boswell HD, Dräger B, McLauchlan WR и др. (Ноябрь 1999 г.). «Особенности ферментов NБиосинтез -алкилтропана у Brugmansia и Datura ». Фитохимия. 52 (5): 871–8. Дои:10.1016 / S0031-9422 (99) 00293-9. PMID 10626376.