Реакция Манниха - Mannich reaction - Wikipedia
| Реакция Манниха | |
|---|---|
| Названный в честь | Карл Манних |
| Тип реакции | Реакция сцепления |
| Идентификаторы | |
| Портал органической химии | реакция Манниха |
| RSC ID онтологии | RXNO: 0000032 |
В Реакция Манниха является органическая реакция который состоит из аминоалкилирование кислотного протона, помещенного рядом с карбонил функциональная группа к формальдегид и первичный или вторичный амин или же аммиак. Конечный продукт представляет собой β-амино-карбонильное соединение, также известное как База Манниха.[1] Реакции между альдимины и α-метиленкарбонилы также считаются реакциями Манниха, поскольку эти имины образуются между аминами и альдегидами. Реакция названа в честь химик Карл Манних.[2][3]

Реакция Манниха является примером нуклеофильное присоединение амина до карбонильной группы с последующей дегидратацией до База Шиффа. База Шиффа - это электрофил который реагирует на втором шаге в электрофильная добавка с соединением, содержащим кислотный протон (который является или стал енолом). Реакция Манниха также считается реакция конденсации.
В реакции Манниха первичная или вторичная амины или аммиак, используются для активации формальдегида. У третичных аминов отсутствует протон N – H для образования промежуточного енамин. α-CH-кислотные соединения (нуклеофилы ) включают карбонильные соединения, нитрилы, ацетилены, алифатический нитросоединения, α-алкил-пиридины или же имины. Также можно использовать активированный фенил группы и богатые электронами гетероциклы, такие как фуран, пиррол, и тиофен. Индол является особенно активным субстратом; реакция обеспечивает злак производные.
Обосновывая реакцию Манниха, можно ясно понять, что она является смешанной.Альдольная реакция, дегидратация спирта и сопряженное добавление амина (Реакция Майкла ) все происходит в "один горшок Двойные реакции Манниха также очень распространены для постановки.
Механизм реакции
Механизм реакции Манниха начинается с образования иминий ион из амина и формальдегида. Обратите внимание: показанный ниже механизм НЕ является правильным. PKa протонированного кислорода составляет примерно -2. Аминное основание просто депротонирует карбонил и останавливает реакцию. Следовательно, обязательно, чтобы эта реакция проводилась при pH примерно 4-5. Правильный механизм должен начинаться с нуклеофильной атаки атома азота на карбонильный углерод.

Соединение с карбонильной функциональной группой (в данном случае кетон ) может таутомеризовать в енольную форму, после чего он может атаковать ион иминиума.


На метилкетонах енолизация и добавление Манниха могут происходить дважды, после чего следует β-элиминирование с образованием производных β-аминоенона.[4][5]
Асимметричные реакции Манниха
Был достигнут прогресс в направлении асимметричный Реакции Манниха. При правильной функционализации вновь образованный этиленовый мостик в аддукте Манниха имеет два прохиральный центры, дающие начало двум диастереомерным парам энантиомеров. Первая асимметричная реакция Манниха с немодифицированным альдегидом была проведена с помощью (S) -пролин как естественный хиральный катализатор.[6]
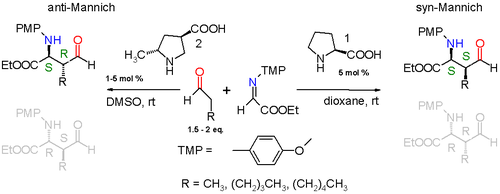
Реакция происходит между простым альдегидом, таким как пропионовый альдегид, и я добываю происходит от этилглиоксилат и п-метоксианилин (PMP = параметоксифенил), катализируемый (S) -пролин в диоксан в комнатная температура. Продукт реакции диастереоселективный с предпочтением реакции син-Манниха 3: 1, когда алкильный заместитель в альдегиде представляет собой метил группа или 19: 1, когда алкильная группа намного больше пентил группа. Из двух возможных син аддукты (S,S) или же (р,р) реакция также энантиоселективный с предпочтением (S,S) аддукт с энантиомерный избыток более 99%. Эта стереоселективность поясняется на схеме ниже.

Пролин входит в каталитический цикл путем реакции с альдегидом с образованием енамин. Два реагента (имин и енамин) выстраиваются в линию для реакции Манниха с Si лица атака имина Si-гранью енамин-альдегида. Облегчение стерическое напряжение означает, что алкильный остаток R енамина и иминной группы являются антиперипланарный при подходе, который блокирует синхронный режим добавления. Энантиоселективность дополнительно контролируется водородная связь между пролином карбоксил группа и имин. В переходное состояние для присоединения - девятичленное кольцо с конформация стула с частичными одинарными связями и двойными связями. Группа пролина превращается обратно в альдегид и одиночный (S,S) изомер образуется.
Путем модификации пролинового катализатора можно также получить аддукты антиманниха.[7]

Дополнительная метильная группа, присоединенная к пролину, вынуждает специфический енаминный подход, и переходное состояние теперь представляет собой 10-членное кольцо с добавлением в анти-моде. Диастереоселективность составляет по крайней мере anti: syn 95: 5 независимо от размера алкильной группы и (S,р) энантиомер предпочтительно с не менее 97% энантиомерный избыток.
Приложения
Реакция Манниха используется во многих областях органической химии. Примеры включают:
- алкил амины
- пептиды, нуклеотиды, антибиотики, и алкалоиды (например. тропинон )
- агрохимикаты, например, регуляторы роста растений[8]
- полимеры
- катализаторы
- Формальдегид сшивание тканей
- Фармацевтические препараты (например. ролитетрациклин (произведение Манниха тетрациклин и пирролидин ), флуоксетин (антидепрессант), трамадол и толметин (противовоспалительный препарат).
- мыло и моющие средства. Эти составы используются в различных областях очистки, обработки автомобильного топлива и эпоксидная смола покрытия
- полиэфирамины из замещенного алкила с разветвленной цепью эфиры[9]
- α, β -ненасыщенный кетоны за счет термического разложения продуктов реакции Манниха (например, метилвинилкетон из 1-диэтиламино-бутан-3-она)[10][11]
Смотрите также
Рекомендации
- ^ Оригинал переведен с немецкой Wiki
- ^ Карл Манних; Krösche, W. (1912). "Ueber ein Kondensationsprodukt aus Formaldehyd, Ammoniak und Antipyrin". Archiv der Pharmazie (на немецком). 250 (1): 647–667. Дои:10.1002 / ardp.19122500151. S2CID 94217627.
- ^ Блике, Ф. Ф. (2011). «Реакция Манниха». Органические реакции. 1 (10): 303–341. Дои:10.1002 / 0471264180.or001.10. ISBN 978-0471264187.
- ^ Cromwell, Norman H .; Сориано, Дэвид С .; Думс, Эрл (ноябрь 1980 г.). «Мобильные кетоаллильные системы. 18. Синтез и химия N-замещенных и N, N-дизамещенных 2-бензоил-1-амино-3-пропенов». Журнал органической химии. 45 (24): 4983–4985. Дои:10.1021 / jo01312a034.
- ^ Гиррезер, Ульрих; Хебер, Дитер; Шютт, Мартин (май 1998 г.). «Легкий синтез в одном горшке 1-арил-2- (диметиламинометил) проп-2-ен-1-онов из арилметилкетонов». Синтез. 1998 (5): 715–717. Дои:10.1055 / с-1998-2056.
- ^ Córdova, A .; Watanabe, S.-I .; Tanaka, F .; Notz, W .; Барбас, К. Ф. (2002). «Высокоэнантиоселективный путь к любому энантиомеру производных α- и β-аминокислот». Журнал Американского химического общества. 124 (9): 1866–1867. Дои:10.1021 / ja017833p. PMID 11866595.
- ^ Mitsumori, S .; Zhang, H .; Cheong, P.H.-Y .; Houk, K .; Tanaka, F .; Барбас, К. Ф. (2006). «Прямые асимметричные реакции типа антиманниха, катализируемые разработанной аминокислотой». Журнал Американского химического общества. 128 (4): 1040–1041. Дои:10.1021 / ja056984f. ЧВК 2532695. PMID 16433496.
- ^ да Роса, Ф. А. Ф .; Rebelo, R.A .; Насименто, М. Г. (2003). «Синтез новых индолкарбоновых кислот, родственных растительному гормону индолуксусной кислоте» (PDF). Журнал Бразильского химического общества. 14 (1): 11–15. Дои:10.1590 / S0103-50532003000100003.
- ^ [1] [2] [3] [4]
- ^ Siegel, H .; Эггерсдорфер, М. «Кетоны». Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a15_077.
- ^ Wilds, A. L .; Новак, Р. М .; Маккалеб, К. Э. (1957). «1-Диэтиламино-3-бутанон (2-бутанон, 4-диэтиламино-)». Органический синтез. 37: 18. Дои:10.15227 / orgsyn.037.0018.; Коллективный объем, 4, п. 281
