Протопарвовирус копытных 1 - Ungulate protoparvovirus 1
| Протопарвовирус копытных 1 | |
|---|---|
| Классификация вирусов | |
| (без рейтинга): | Вирус |
| Область: | Моноднавирия |
| Королевство: | Shotokuvirae |
| Тип: | Cossaviricota |
| Учебный класс: | Quintoviricetes |
| Заказ: | Piccovirales |
| Семья: | Parvoviridae |
| Род: | Протопарвовирус |
| Разновидность: | Протопарвовирус копытных 1 |
| Вирусы участников[1] | |
Парвовирус свиней | |
| Синонимы[2] | |
Парвовирус свиней | |
Парвовирус свиней (PPV), вирус у вида Протопарвовирус копытных 1 рода Протопарвовирус в семействе вирусов Parvoviridae,[3] вызывает репродуктивную недостаточность свинья был характеризован эмбриональный и плод инфекция и смерть, обычно при отсутствии внешнего материнского клинические признаки. Заболевание развивается в основном при серонегативный плотины подвергаются ороназальному воздействию вируса в любое время примерно в первой половине беременность, а концептусы впоследствии заражаются трансплацентарно, прежде чем они станут иммунокомпетентный. Нет никаких окончательных доказательств того, что заражение свиней, кроме как во время беременности, имеет какое-либо клиническое или экономическое значение. Вирус повсеместно распространен среди свиней во всем мире и является энзоотическим в большинстве тестируемых стад. Диагностические исследования показали, что PPV является основной инфекционной причиной гибели эмбрионов и плода.[4][5][6][7][8] В дополнение к своей прямой причинной роли в репродуктивной недостаточности PPV может усиливать эффекты цирковирус свиней инфекция II типа (ЦВС-2) в клиническом течении синдром мультисистемного истощения после отъема (PMWS).[9][10]
Признаки и симптомы
Острая инфекция послеродовых свиней, включая беременных самок, у которых впоследствии развивается репродуктивная недостаточность, обычно носит субклинический характер.[11][12][13][14][15][16] Однако у молодых свиней и, вероятно, у более старших племенных животных вирус широко реплицируется и обнаруживается во многих тканях и органах с высоким уровнем митотический индекс. Популярный антиген особенно концентрируется в лимфоидных тканях[13][14] (Рис. 3A, B). Многие свиньи, независимо от возраста и пола, страдают преходящей, обычно легкой, лейкопенией где-то в течение 10 дней после первоначального контакта с вирусом.[11][17][15][16] PPV и другие структурно похожие вирусы были обнаружены в кале свиней, страдающих диареей.[18][19] Однако нет экспериментальных доказательств того, что PPV широко реплицируется в кишечный крипта эпителий или вызывает кишечное заболевание, как и парвовирусы некоторых других видов.[13][20] PPV также был выделен от свиней с поражениями, описанными как пузырьковые. Причинная роль PPV в таких поражениях четко не определена.[21]
Основным и обычно единственным клиническим ответом на инфекцию PPV является репродуктивная недостаточность матери. Патологический последствия в основном зависят от того, когда происходит воздействие во время беременности. У маток может возобновиться течка, не удастся опороситься, несмотря на анэструс, опоросить несколько свиней в помете или опоросить большую часть мумифицированных плодов. Все они могут отражать гибель эмбриона или плода либо и то, и другое. Единственным внешним признаком может быть уменьшение обхвата живота матери, когда плод умирает в середине беременности или позже, и связанные с ними жидкости рассасываются. Другие проявления материнской репродуктивной недостаточности, а именно бесплодие, аборт, мертворождение, неонатальная смерть и снижение жизнеспособности новорожденных, также приписываются инфицированию PPV.[4][22][23][24][25] Обычно это лишь незначительный компонент болезни. Наличие мумифицированных плодов в помете может продлить оба срока беременности.[24] и период опороса.[26] Любой из них может привести к мертворождению явно нормальных однопометников независимо от того, инфицированы они или нет.

Нет никаких доказательств того, что фертильность или либидо хряков изменен заражением PPV.[27][28]
Причина
PPV относится к роду Парвовирус (Лат. Parvus = маленький) семьи Parvoviridae.[29][30] Все сравниваемые изоляты PPV были обнаружены антигенно схожими, если не идентичными.[31][11][32][12][33] PPV также имеет антигенное родство с несколькими другими членами этого рода.[34][35][36] Однако его идентичность может быть установлена с помощью относительно строгих серологических тестов, таких как нейтрализация вирусов (VN) и подавление гемагглютинации (ЗДРАВСТВУЙ).
Биофизические и биохимические свойства
Биофизические и биохимические свойства PPV широко изучены.[29][37][38] и резюмируются следующим образом. Зрелый вирион имеет кубическую симметрию, два или три капсидных белка, диаметр примерно 20 нм, 32 капсомера, нет конверт или же основные липиды и массой 5,3 × 106 дальтон. Вирусный геном одноцепочечный. дезоксирибонуклеиновая кислота (ДНК) с молекулярный вес 1,4 × 106 (т.е. примерно 26,5% от веса полного вириона). Плавучие плотности (г / мл в хлориде цезия) полных инфекционных вирионов, неполных «пустых» вирионов и извлеченной ДНК вириона составляют 1,38–1,395, 1,30–1,315 и 1,724 соответственно. Вирусная инфекционность, гемагглютинирующая активность, и антигенность необычайно устойчивы к нагреванию, широкому диапазону концентраций ионов водорода и ферменты.
Репликация
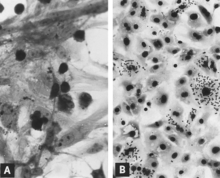
Репликация PPV in vitro является цитоцидный и характеризуется "округлением", пикнозом и лизис клеток (Рис. 1А). Многие из фрагменты клеток часто остаются прикрепленными, что в конечном итоге придает пораженной культуре рваный вид. Внутриядерные включения развивать[31] но они часто редки.[39] Зараженные культуры могут гемадсорб немного[31] (Рис. 1B). Цитопатические изменения значительны, когда адаптированный к культуре клеток вирус размножается в соответствующих условиях. Однако при первоначальном выделении несколько последовательных пассажей вируса[31] или, что лучше, зараженная культура может быть необходима до того, как будут обнаружены эффекты. Использование иммунофлуоресценция (ЕСЛИ) микроскопия значительно увеличивает вероятность обнаружения минимально инфицированных культур.[40][41]
Первичные и вторичные культуры эмбрионов или новорожденных свиней почка клетки чаще всего используются для размножения и титрования PPV, хотя другие виды культур также чувствительны.[42] Репликация усиливается за счет инфицирования митотически активных культур.[31][43][44][45] Многие клетки в таких культурах находятся в S-фазе (т.е. в фазе синтеза ДНК) своего клеточного цикла, где доступны ДНК-полимеразы клеточного происхождения, необходимые для репликации вируса.[46][47][48]
Если плод или взрослый бык сыворотка включается в питательную среду клеточных культур, используемых для размножения PPV, ее необходимо предварительно протестировать на вирусные ингибиторы.[49][50][51] То же самое может относиться к сывороткам некоторых других видов.[52] Поскольку на репликацию PPV влияет митотическая активность, влияние сыворотки на клетки также особенно важно. Кроме того, культуры следует предварительно протестировать на заражение PPV.[40][41] Иногда из инфицированных тканей плода по незнанию готовятся культуры.[41] и послеродовой[31][53][54][55] свиньи. Более того, PPV может случайно попасть в культуру несколькими способами:[56] включая использование загрязненного трипсина.[57][58] Если контаминация обнаруживается до того, как все клетки инфицированы, вирус можно удалить путем многократного пересева клеток в присутствии питательной среды, содержащей антисыворотку PPV.[59]
Некоторые исследователи использовали IF-микроскопию для наблюдения за развитием PPV в культуре клеток.[31][40][60][61][62] В целом последовательность событий такова. Вирусный антиген обнаруживается в цитоплазме клеток вскоре после заражения, если инокулят содержит высокий титр вируса и вирусного антигена. Большая часть, если не вся эта ранняя цитоплазматическая флуоресценция является результатом фагоцитоза антигена из инокулята.[60][63] Посредством последовательных исследований такой антиген может быть обнаружен сначала на внешней поверхности цитоплазматической мембраны, а затем в цитоплазме, часто относительно концентрированной в околоядерном месте. Первым недвусмысленным свидетельством репликации вируса является появление зарождающегося вирусного антигена в ядре (рис. 2А). По крайней мере, в некоторых инфицированных клетках зарождающийся антиген затем появляется в цитоплазме в количестве, достаточном для того, чтобы и цитоплазма, и ядро были ярко флуоресцентными. Инфицированные клетки, обычно наблюдаемые в легких плодов, у которых вырабатывается высокий титр антител к PPV, вероятно, представляют эту стадию репликации (см. Фиг. 8C). Пораженные клетки впоследствии собираются, становятся пикнотическими и распадаются с высвобождением вируса и вирусного антигена (рис. 2B). Другие клетки в культуре, которые не находятся на подходящей стадии для поддержки репликации вируса, продолжают фагоцитировать и накапливать вирусный антиген в своей цитоплазме (рис. 2С). Вторую волну репликации вируса можно вызвать, если эти клетки стимулировать для перехода в S-фазу клеточного цикла, например, путем добавления свежей культуральной среды.
Гемагглютинация
PPV агглютинирует человека, обезьяну, морскую свинку, кошку, курицу, крысу и мышь. эритроциты. Эритроциты других видов животных, которые были протестированы, относительно или полностью нечувствительны, или результаты были неоднозначными.[31][32][43][45][60][64] Некоторые параметры теста гемагглютинации (HA), такие как температура инкубации,[43][60] вид используемых эритроцитов, а в случае куриных эритроцитов - генетический состав[31][33][51] и возраст[32] донора - может количественно повлиять на результаты. Тест HA чаще всего проводится при комнатной температуре, примерно нейтральном pH и с эритроцитами морских свинок. Более высокие титры НА были зарегистрированы, когда в качестве разбавителя использовался верональный буфер, а не физиологический раствор с фосфатным буфером.[33] Элюцию вируса (гемагглютинин является частью вириона) можно вызвать суспендированием эритроцитов в щелочном буфере, pH 9.[45]
Титрование инфекционности
Титрование инфекционности проводят стандартным способом, за исключением того, что, поскольку цитопатические изменения при конечных разведениях часто нечеткие, конечные точки инфекционности часто определяют либо путем исследования культур клеток на предмет внутриядерных включений после соответствующего окрашивания, либо путем исследования среды для культивирования клеток на вирусный гемагглютинин.[31] Процедура титрования, при которой инфицированные клетки выявляются с помощью IF-микроскопии.[60] и анализ налета[65] также были описаны.

Серологический
Тесты Тест HI часто используется для обнаружения и количественного определения гуморальных антител к PPV. Иногда антитела можно обнаружить уже через 5 дней после контакта свиней с живым вирусом, и они могут сохраняться годами.[12] Сыворотки, исследуемые с помощью теста HI, обычно предварительно обрабатывают инактивацией нагреванием (56 ° C, 30 минут) и адсорбцией эритроцитами (для удаления встречающихся в природе гемагглютининов) и каолином (для удаления или уменьшения неантител-ингибиторов HA).[32][60] Трипсин также использовался для удаления неантителовых ингибиторов НА.[31] Подробно изучены параметры теста HI.[66][67]
Тест SN иногда используется для обнаружения и количественного определения гуморальных антител к PPV. Нейтрализация инфекционности обычно подтверждается отсутствием или уменьшением внутриядерных включений или флуоресцентных клеток в культурах или вирусного гемагглютинина в культуральной среде.[50][60][68] Сообщается, что тест SN более чувствителен, чем тест HI.[68][17] Описана микротехника для применения теста SN.[68]
Иммунодиффузия,[69] модифицированный тест прямой фиксации комплемента,[33] и иммуноферментный анализ[70][71] также успешно использовались для обнаружения антител к PPV.
Эволюция
Эти вирусы, по-видимому, возникли около 120 лет назад, и за последние 40–60 лет их популяция быстро увеличилась.[72] Похоже, что они первоначально развились у диких кабанов, а затем распространились на домашних свиней. Скорость эволюции оценивается в 3,86 x 10−4 - 8,23 х 10−4 замен на сайт в год.[73] Этот показатель аналогичен показателям других одноцепочечных ДНК-вирусов.
Эпидемиология
Парвовирус свиней широко распространен среди свиней во всем мире. В основных районах свиноводства, таких как средний запад США, инфекция энзоотический в большинстве стад, за редким исключением, свиноматки иммунны. Кроме того, большая часть свинок естественным образом заражается PPV до зачатия, и в результате у них вырабатывается активный иммунитет, который, вероятно, сохраняется на протяжении всей жизни. В совокупности сероэпидемиологические данные показывают, что воздействие PPV является обычным явлением. Они также подчеркивают высокий риск инфекций и репродуктивных заболеваний среди свинок, у которых до зачатия не развился иммунитет. Наиболее распространенными путями заражения свиней в послеродовой и пренатальный периоды являются ороназальный и трансплацентарный пути соответственно.
Свиньи, питающиеся иммунными плотинами, поглощают высокий титр антител к PPV из молозиво. Эти титры постепенно уменьшаются за счет разбавления по мере роста свиней, а также за счет биологической деградации. Обычно они достигают поддающегося обнаружению уровня через 3–6 месяцев, если сыворотки исследуются с помощью теста HI.[74][75] Иногда пассивно приобретенные антитела сохраняются в течение более длительного интервала. Более того, уровни антител, слишком низкие для обнаружения с помощью теста HI, могут быть обнаружены с помощью теста SN.[12] Основное значение пассивно приобретенных антител состоит в том, что они препятствуют развитию активного иммунитета. Высокие уровни таких антител могут предотвратить инфекцию, а более низкие уровни могут минимизировать распространение от инфицированных свиней.[76][77] Следовательно, некоторые группы свинок не полностью восприимчивы к инфекции и распространению вируса либо незадолго до зачатия, либо во время ранней беременности.
Загрязненные помещения, вероятно, являются основными резервуарами PPV. Вирус термостабилен, устойчив ко многим распространенным дезинфицирующим средствам,[78] и может оставаться заразным в течение нескольких месяцев в секретах и экскрементах остро инфицированных свиней. Экспериментально было показано, что, хотя свиньи передавали PPV только в течение примерно 2 недель после заражения, загоны, в которых они изначально содержались, оставались заразными в течение как минимум 4 месяцев.[79] Повсеместное распространение PPV также повышает вероятность того, что некоторые свиньи постоянно инфицированы и, по крайней мере, периодически выделяют вирус. Однако выделение за пределы периода острой инфекции не было продемонстрировано.[12] Было высказано предположение о возможности иммунотолерантных носителей PPV в результате ранней внутриутробной инфекции.[50] Когда свинок инфицировали PPV до 55 дня беременности, их свиньи рождались инфицированными, но без антител. Вирус выделяли из почек, яичек и семенной жидкости таких свиней, умерщвленных в разное время после рождения до достижения ими 8-месячного возраста; на этом время эксперимент был прекращен.[17] Результаты другого исследования, в котором матери были инфицированы на ранних сроках беременности, а их свиньи родились инфицированными, но без антител, также предполагают приобретенную иммунотолерантность.[80] Сообщается о возможном примере инфицированного иммунотолерантного сексуально активного кабана.[12]
Кабаны могут играть значительную роль в распространении PPV в критический момент. Во время острой инфекции вирус распространяется разными путями, в том числе сперма Сообщалось о выделении PPV из спермы естественно инфицированных хряков.[4][31][81] Сперма может быть загрязнена извне, например, вирусными фекалиями или внутри мужских половых путей. Вирус был выделен из яичка кабана через 5 дней после того, как он был введен кабану. крайняя плоть[82] и из яичек хряков, убитых через 5 и 8 дней после ороназального заражения (Менгелинг, неопубликованные данные, 1976). Вирус также был выделен из лимфатических узлов мошонки хряков, погибших через 5, 8, 15, 21 и 35 дней после ороназального воздействия. После 8-го дня изоляцию осуществляли путем совместного культивирования фрагментов лимфатических узлов с фетальными клетками почек свиньи (Mengeling, неопубликованные данные, 1976). Независимо от своего иммунного статуса, хряки также могут служить средством механического распространения PPV среди восприимчивых самок.
Патогенез
Собаки подвержены репродуктивной недостаточности, вызванной PPV, если инфицированы в любое время примерно в первой половине беременности. На этот интервал материнской восприимчивости указывают коллективные результаты нескольких экспериментальных исследований,[15][16][83][84] путем углубленных эпидемиологических исследований,[85][86] и оценками времени смерти плодов, собранными в ходе эпидемиологических исследований.[5][8] Последствия материнской инфекции в течение этого интервала - гибель эмбриона и плода с последующей резорбцией и мумификацией соответственно. Трансплацентарный инфекция также возникает после заражения матери после середины беременности, но плоды обычно выживают без очевидных клинических эффектов в утробе матери. Вероятная причина в том, что для трансплацентарной инфекции часто требуется 10–14 дней.[84][87] или дольше,[15] и к 70 дню беременности у большинства плодов появляется защитный иммунологический ответ на вирус. В целом, плоды, экспериментально инфицированные путем трансматочной инокуляции вируса, умерли, если были инфицированы до 70 дня беременности, но они выжили и вырабатывали антитела при заражении на более поздних сроках беременности.[63][88][89][90] Сообщалось также о штамме PPV с несколько большей вирулентностью.[91] Обычные последствия инфекции на разных сроках беременности кратко описаны в Таблица 1.
Когда только часть помета инфицирована трансплацентарно, как это часто бывает, один или несколько однопометников часто заражаются последующим внутриутробным распространением вируса. То же самое применимо, если первоначальное заражение произошло через зараженную сперму. В результате любая комбинация или все последствия, указанные в Таблица 1 могут развиваться в одном помете. При инфицировании ранних эмбрионов внутриутробное распространение, вероятно, встречается реже, поскольку они быстро рассасываются после смерти, эффективно удаляя внутриутробный резервуар вируса.[84] В таких случаях нет доказательств того, что опорос приводит к меньшему количеству свиней в помете.
| Период беременности (дни)а | |||
|---|---|---|---|
| Заражение плотины | Заражение концептусаб | Описание Conceptus | Последствия заражения |
| ≤56 | 10–30 | Эмбрион | Смерть и рассасывание |
| 30–70 | Плод | Смерть и мумификация | |
| >56 | 70 – семестр | Плод | Иммунный ответ и обычно выживание в утробе матери. |
аИнтервалы являются приблизительными.
бПредполагается наличие трансплацентарной инфекции через 10–14 дней после заражения матери.
Влияние PPV на яйцеклетку перед овуляцией, если таковое имеется, неизвестно. Вирус прочно прикрепляется к внешней поверхности блестящей оболочки оплодотворенной яйцеклетки свиньи,[92][93] и хотя он, по-видимому, не может проникнуть через этот слой, предполагается, что он может представлять угрозу для эмбриона после вылупления.[92]
Несмотря на веские косвенные доказательства,[80] Прямая причинная роль спермы, загрязненной PPV, в репродуктивной недостаточности не установлена однозначно.[82] Zona pellucida может защитить ранний эмбрион, пока развивается местный иммунитет. И наоборот, вирус может вызвать изменения в матке, несовместимые с беременностью.[94] В любом случае женщина, инфицированная через сперму, является очагом инфекции для других.
За возможным исключением изменений в матке, упомянутых в предыдущем абзаце, репродуктивная недостаточность, вызванная PPV, вызвана прямым воздействием вируса на концептус. В отсутствие иммунного ответа вирус широко реплицируется в этих тканях. К тому времени, когда концептус умирает, большинство его клеток содержат большие количества внутрицитоплазматического вирусного антигена, что можно продемонстрировать с помощью IF-микроскопии. Относительное отсутствие ядерной флуоресценции в момент смерти по сравнению с более ранними стадиями заболевания указывает на то, что при серьезном поражении концептуса митотическая активность и связанные с ней условия, необходимые для репликации вируса, подавляются больше, чем фагоцитарная активность.
Смерть концептуса, вероятно, является результатом коллективного поражения вирусом различных тканей и органов, включая плаценту.[90] Однако при отсутствии иммунного ответа изменений практически в любом жизненно важном органе, вероятно, достаточно, чтобы в конечном итоге вызвать смерть. Одна из наиболее ярких особенностей вирусного распространения - обширное поражение эндотелия. Это, по-видимому, препятствует дальнейшему развитию сосудистой сети концептуса. Подготовка к клеточному митозу (т. Е. Фаза S) приводит к сопутствующей репликации вируса и гибели клеток. На повреждение системы кровообращения плода указывают отек, кровотечение и скопление большого количества серозно-геморрагической жидкости в полостях тела. Некроз эндотелия очевиден под микроскопом.[95]
Механизм трансплацентарной инфекции был исследован с помощью IF-микроскопии для идентификации инфицированных клеток в тканях матери и плода через все более длительные интервалы после воздействия на нос через рот матери.[87] Исследование тканей, прилегающих к соединению матери и плода, выявило вирусный антиген в эндотелиальных и мезенхимальных клетках хориона, причем эти ткани вовлекались все чаще на более поздних стадиях беременности. Вирусный антиген никогда не обнаруживался однозначно ни в эпителии матки, ни в трофэктодерме. Следовательно, не было доказательств передачи вируса материнскому плоду путем репликации через эти ткани. Однако этот маршрут нельзя исключать, так как была исследована лишь небольшая часть общей площади контакта. Рассмотрена передача вируса внутри макрофагов.[96] Каким бы ни был путь, материнская виремия кажется вероятной предпосылкой трансплацентарной инфекции.[15][16]
Поражения
Ни о макроскопических, ни о микроскопических поражениях у небеременных свиней не сообщалось.[13][20] Вполне возможно, что клеточные инфильтрации, описанные впоследствии для плодов, могут быть вызваны инфекцией в перинатальном периоде.
О макроскопических поражениях у беременных самок не сообщалось; однако микроскопические поражения наблюдались в тканях свинок, убитых после заражения их плодов трансматочной инокуляцией вируса. Свинки, которые были серонегативными, когда их плоды были инфицированы на 70-й день беременности, имели очаговые скопления мононуклеарных клеток, прилегающих к эндометрию и в более глубоких слоях собственной пластинки, когда они были умерщвлены через 12 и 21 день. Кроме того, были периваскулярные манжеты плазматических клеток и лимфоцитов в головном, спинном мозге и сосудистой оболочке глаза.[97] Когда плоды были инфицированы на ранних сроках беременности (35, 50 и 60 дней), а их матери погибали через 7 и 11 дней, поражения были аналогичными. Однако поражения матки были более серьезными и также включали обширное наложение на миометриальные и эндометриальные сосуды мононуклеарных клеток.[95] В матках свинок, которые были серопозитивными, когда их плоды были инфицированы, наблюдались только очаговые скопления лимфоцитов.[90]
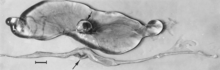
Макроскопические изменения эмбрионов - смерть с последующим рассасыванием жидкости (рис. 4), а затем мягких тканей (рис. 5). Вирус и вирусный антиген широко распространены в тканях инфицированных эмбрионов и их плаценты,[84] и вполне вероятно, что микроскопические очаги некроза и сосудистого повреждения, впоследствии описанные для плодов, также развиваются у продвинутых эмбрионов.
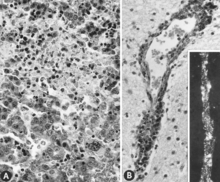
Есть многочисленные макроскопические изменения у инфицированных плодов, прежде чем они станут иммунокомпетентными (рис. 6). К ним относятся различная степень задержки роста, а иногда и очевидная потеря физического состояния до того, как станут очевидны другие внешние изменения; иногда повышенное выступание кровеносных сосудов на поверхности плода из-за скопления и утечки крови в прилегающие ткани; застойные явления, отеки и кровотечения с скоплением серозно-геморрагической жидкости в полостях тела; геморрагическое изменение цвета, постепенно темнеющее после смерти; и обезвоживание (мумификация). Многие из этих изменений также касаются плаценты. Микроскопические поражения состоят в основном из обширного клеточного некроза самых разных тканей и органов.[95][98] (Рис. 7A). Воспаление[98] и внутриядерные включения[95] также были описаны.

Напротив, не сообщалось о макроскопических изменениях для плодов, инфицированных после того, как они стали иммунокомпетентными для PPV. Микроскопические поражения - это в первую очередь гипертрофия эндотелия.[97] и инфильтрации мононуклеарных клеток соответствует иммунному ответу.[97][98] Менингоэнцефалит, характеризующийся периваскулярным наматыванием пролиферирующих адвентициальных клеток, гистиоцитов и нескольких плазматических клеток, наблюдался в сером и белом веществе головного мозга и в лептоменингах мертворожденных свиней, инфицированных PPV. Эти поражения считались патогномоничными для инфекции PPV.[24] Подобные поражения наблюдались у инфицированных PPV живых плодов, взятых на поздних сроках беременности.[97][98] (Рис. 7B).
Оба общих типа микроскопических поражений (т. Е. Некроз и инфильтрация мононуклеарных клеток) могут развиваться у плодов, инфицированных около середины беременности.[95] когда иммунный ответ недостаточен для обеспечения защиты.
Диагностика
PPV следует рассматривать при дифференциальной диагностике репродуктивной недостаточности свиней всякий раз, когда есть доказательства гибели эмбриона или плода, либо того и другого. Описаны патологические последствия материнской инфекции во время беременности (см. Раздел о клинических признаках). Если поражены свиньи, но не свиноматки, материнское заболевание не проявляется во время беременности, имеется мало или совсем нет абортов или аномалий развития плода, а другие данные указывают на инфекционное заболевание, тогда можно поставить предварительный диагноз репродуктивной недостаточности, вызванной PPV. Относительное отсутствие материнских заболеваний, абортов и аномалий развития плода отличает PPV от большинства других инфекционных причин репродуктивной недостаточности. Однако для постановки окончательного диагноза требуется лабораторная поддержка.
Несколько мумифицированных плодов (<16 см в длину) или легких от таких плодов, если они достаточно развиты, должны быть отправлены в диагностическую лабораторию. Более крупные мумифицированные плоды (т.е. гестационный возраст более 70 дней),[99] Мертворожденных свиней и новорожденных свиней не рекомендуется отправлять, если только они не являются единственными доступными образцами. В случае инфицирования их ткани обычно содержат антитела, которые мешают лабораторным тестам на вирус или вирусный антиген.

Если самки не опоросятся, несмотря на анэструс, и их отправляют на бойню, их матки должны быть собраны и исследованы на наличие пораженных плодов. Иногда остаются только остатки тканей плода, когда плод умирает в начале средней трети гестации. Тем не менее, это адекватные образцы, если тестировать на вирусный антиген с помощью IF-микроскопии.[5][63] Отсутствие пораженных плодов или остатков плода не исключает репродуктивную недостаточность, вызванную PPV. Когда все эмбрионы помета умирают и полностью рассасываются после первых нескольких недель беременности, самка может оставаться беременной с эндокринологической точки зрения и не возвращаться к течке до истечения ожидаемого времени опороса.[100]
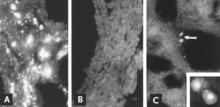
Идентификация вирусного антигена с помощью IF-микроскопии - надежная и чувствительная диагностическая процедура. Срезы тканей плода готовятся с помощью микротома-криостата, а затем вводятся в реакцию со стандартизованными реагентами.[5][26] Тест можно пройти за несколько часов. В отсутствие ответа антител плода антиген виден во всех тканях плода (фиг. 8A, B); даже при наличии антител инфицированные клетки обычно можно обнаружить в легких плода (рис. 8C).
Обнаружение вирусного гемагглютинина также рекомендуется в качестве диагностического метода.[101][102] Ткани растирают в разбавителе, а затем осаждают центрифугированием. Супернатант проверяют на агглютинирующую активность в отношении эритроцитов морских свинок. Для этого теста требуется минимум лабораторного оборудования, и он эффективен при отсутствии антител.
Выделение вируса менее подходит в качестве рутинной диагностической процедуры, чем любой из вышеупомянутых тестов. Инфекция медленно, но постепенно теряется после гибели плода;[63] в результате выделение вируса из мумифицированных плодов, умерших в результате инфекции, иногда оказывается безуспешным.[5] Кроме того, процедура занимает много времени, а загрязнение представляет собой постоянную угрозу из-за стабильности PPV в лаборатории.[31] а также потому, что культуры клеток иногда неосознанно готовятся из инфицированных тканей.[31][41][53][54][55] IF-микроскопия часто используется для определения того, был ли PPV изолирован в культуре клеток.[5][50][103]
В целом серологические процедуры рекомендуются для диагностики только в том случае, если ткани мумифицированных плодов недоступны для тестирования, как описано ранее. Результаты с материнской сывороткой имеют значение, если антитела не обнаруживаются, что исключает PPV как причину, и если образцы, собранные через определенные промежутки времени, показывают сероконверсию PPV, совпадающую с репродуктивной недостаточностью.[23][26][100] Поскольку PPV встречается повсеместно, присутствие антитела в одном образце в остальном бессмысленно. Однако определение относительных количеств антител, присутствующих в виде иммуноглобулинов M и G, может указывать на недавнее инфицирование.[66][69] Обнаружение антител в сыворотках плодов и мертворожденных свиней, а также в сыворотках, взятых у новорожденных свиней до кормления грудью, является свидетельством внутриутробной инфекции, поскольку материнские антитела не проникают через соединение матери и плода.[11][60][17][80][104] Когда сыворотка недоступна, биологические жидкости, взятые у плодов или их внутренностей, которые хранились в пластиковом пакете на ночь при 4 ° C, успешно использовались для демонстрации антител.[101][105]
Лечение и профилактика
Лечения репродуктивной недостаточности, вызванной PPV, не существует.
Свинки должны быть либо естественным образом инфицированы PPV, либо вакцинированы от PPV перед тем, как они будут выведены. Чтобы способствовать естественному инфицированию, обычной практикой является организация контакта между серонегативными свиноматками и серопозитивными свиноматками с ожиданием, что одна или несколько свиноматок будут выделять вирус. Также можно рекомендовать перемещение свинок в потенциально зараженную территорию, в настоящее время или недавно заселенную серопозитивными свиньями. Как только инфекция начинается, вирус быстро распространяется среди полностью восприимчивых свиней. Неизвестно, насколько эффективны эти процедуры в увеличении частоты естественных инфекций. По тем или иным причинам инфекция является обычным явлением, и, вероятно, более половины всех свинок в районах, где PPV является энзоотическим, инфицированы до того, как они будут выведены в первый раз.[60]
Использование вакцина это единственный способ обеспечить развитие у свинок активного иммунитета до зачатия. Оба инактивированы[76][106][107][108][109][110][111][112] и модифицированные живые вирусы (МЖВ) вакцины[113][114] были разработаны. Инактивированная вакцина прошла испытания в полевых условиях,[109][115] и оба типа вакцин были эффективны при тестировании в контролируемых лабораторных условиях.[111][112][113]
Вакцины следует вводить за несколько недель до зачатия, чтобы обеспечить иммунитет на протяжении всего восприимчивого периода беременности, но после исчезновения пассивно приобретенных колостральных антител, которые могут помешать развитию активного иммунитета.[116] Эти ограничения могут определять очень короткий интервал для эффективной вакцинации свинок, выращенных до 7-месячного возраста. Хотя инактивированная вакцина обеспечивает максимальную безопасность, существуют экспериментальные доказательства того, что PPV может быть в достаточной степени аттенуирован, так что маловероятно, что она вызовет репродуктивную недостаточность, даже если ее случайно ввести во время беременности.[113] Очевидная безопасность MLV-вакцины может быть связана с ее пониженной способностью реплицироваться в тканях интактного хозяина и вызывать уровень виремии, необходимый для трансплацентарной инфекции.[117] Более того, с помощью трансматочной инокуляции как вирулентного, так и аттенуированного вируса было показано, что для заражения плода требуется гораздо большая доза аттенуированного вируса.[118] Продолжительность иммунитета после вакцинации неизвестна; однако в одном исследовании титры антител сохранялись в течение по крайней мере 4 месяцев после введения инактивированной вакцины.[107] Низкие уровни антител, оказывающих защитное действие, позволяют предположить, что после того, как иммунная система будет примирована PPV, последующее воздействие вирулентного вируса во время беременности вряд ли приведет к трансплацентарной инфекции, даже если антитела от вакцинации больше не обнаруживаются.[111]
Вакцинация рекомендуется также серонегативным свиноматкам и хрякам. Серонегативные свиноматки обычно встречаются только в стадах без PPV; в таких случаях показана инактивированная вакцина. Опыт показал, что можно ожидать, что немногие стада останутся свободными от PPV, даже если доступ будет тщательно контролироваться. Введение PPV в полностью уязвимое стадо может иметь катастрофические последствия.[85] Вакцинация хряков должна снизить их участие в распространении вируса.
Вакцины широко используются в США и некоторых других странах, где PPV признана экономически важной причиной репродуктивной недостаточности. Все вакцины, лицензированные на федеральном уровне, продаваемые в США, инактивированы.
Смотрите также
Рекомендации
- ^ "Род: Протопарвовирус". Международный комитет по таксономии вирусов (ICTV). Получено 8 января 2019.
- ^ "История таксономии ICTV: Протопарвовирус копытных 1". Международный комитет по таксономии вирусов (ICTV). Получено 9 января 2019.
- ^ «10-й отчет ICTV (2018)».
- ^ а б c Картрайт, С. Ф. и Хак, Р. А. (1967). «Вирусы, выделенные в связи с стадным бесплодием, абортами и мертворождением свиней». Vet Rec. 81: 196–197.
- ^ а б c d е ж грамм Менгелинг, В.Л., В.Л. (1978b). «Распространенность репродуктивной недостаточности, вызванной парвовирусом свиней: исследование на бойнях». J Am Vet Med Assoc. 172 (11): 1291–1294. PMID 659307.
- ^ Такер Б. и Леман А. Д. (1978). «Оценка беременных маток при убое на парвовирусную инфекцию свиней». Proc Int Congr Pig Vet Soc. 5: М – 49.
- ^ Ванье П. и Тиллон Дж. П. (1979). «Диагностика парвовирусной инфекции при проблемах репродукции свиней». Rec Med Vet. 155: 151–158.
- ^ а б Менгелинг, Уильям Л; Лагер, Келли М; Циммерман, Джеффри К.; Самарикермани, Надер; Беран, Джордж W (2016). «Текущая оценка роли парвовируса свиней как причины гибели плода свиней». Журнал ветеринарных диагностических исследований. 3 (1): 33–5. Дои:10.1177/104063879100300107. PMID 1645596.
- ^ Краковка, S; Ellis, J. A .; Михан, B; Кеннеди, S; McNeilly, F; Аллан, Г. (2016). «Синдром вирусного истощения свиней: экспериментальное воспроизведение мультисистемного синдрома истощения после отъема у свиней-гнотобиотиков путем коинфекции цирковирусом 2 свиней и парвовирусом свиней». Ветеринарная патология. 37 (3): 254–63. Дои:10.1354 / вп.37-3-254. PMID 10810990.
- ^ Оприессниг, Т; Fenaux, M; Ю, С; Evans, R.B .; Кавано, Д; Gallup, J.M .; Pallares, F.J .; Thacker, E.L .; Lager, K.M .; Мэн, X.J.; Халбур, П. (2004). «Влияние вакцинации против парвовируса свиней на развитие PMWS у сегрегированных свиней на раннем отъеме, коинфицированных цирковирусом свиней 2 типа и парвовирусом свиней». Ветеринарная микробиология. 98 (3–4): 209–20. Дои:10.1016 / j.vetmic.2003.11.006. PMID 15036529.
- ^ а б c d Джонсон, Р. Х. и Коллингс, Д. Ф. (1969). «Экспериментальное заражение поросят и супоросных свинок парвовирусом». Vet Rec. 85 (16): 446–447. Дои:10.1136 / vr.85.16.446. PMID 5387900.
- ^ а б c d е ж Johnson, R.H .; Donaldson-Wood, C.R .; Джу, Х. С. и Аллендер, У. (1976). «Наблюдения по эпидемиологии парвовируса свиней». Aust Vet J. 52 (2): 80–84. Дои:10.1111 / j.1751-0813.1976.tb13862.x. PMID 985234.
- ^ а б c d Катлип, Р. К. и Менгелинг, В. Л. (1975a). «Экспериментально индуцированная инфекция неонатальных свиней парвовирусом свиней». Am J Vet Res. 36 (8): 1179–1182. PMID 1098530.
- ^ а б Fujisaki, Y .; Моримото, Т .; Сугимори Т. и Сузики Х. (1975). «Экспериментальное заражение свиней парвовирусом свиней». Natl Inst Anim Health Q (Токио). 22: 205–206.
- ^ а б c d е Joo, H. S .; Дональдсон-Вуд, К. Р. и Джонсон, Р. Х. (1976a). «Наблюдения за патогенезом парвовирусной инфекции свиней». Arch Virol. 51 (1–2): 123–129. Дои:10.1007 / BF01317841. PMID 986801.
- ^ а б c d Менгелинг, У. Л. и Катлип, Р. К. (1976). «Репродуктивное заболевание, экспериментально вызванное воздействием на беременных свиней парвовируса свиней». Am J Vet Res. 37 (12): 1393–1400. PMID 999067.
- ^ а б c d Johnson, R.H .; Коллингс, Д. Ф. (1971). «Трансплацентарное заражение поросят парвовирусом свиней». Исследования в области ветеринарии. 12 (6): 570–2. Дои:10.1016 / s0034-5288 (18) 34111-0. PMID 5169329.
- ^ Dea, S .; Элажары, М.А.С. Й .; Мартино, Г. П. и Вайланкур, Дж. (1985). «Парвовирусоподобные частицы, вызывающие диарею у поросят без отъема». Может J Comp Med. 49 (3): 343–345. ЧВК 1236185. PMID 2412678.
- ^ Yasuhara, H .; Matsui, O .; Hirahara, T .; Огтани, Т .; Tanaka, M. L .; Kodama, K .; Накай М. и Сасаки Н. (1989). «Характеристика парвовируса, выделенного из диарейных фекалий свиньи». Jpn J Vet Sci. 51 (2): 337–344. Дои:10.1292 / jvms1939.51.337. PMID 2544760.
- ^ а б Brown, T. T. Jr .; Пол П. С. и Менгелинг В. Л. (1980). «Реакция свиней-отъемышей, выращенных традиционным способом, на экспериментальную инфекцию вирулентным штаммом парвовируса свиней». Am J Vet Res. 41 (8): 1221–1224. PMID 7447115.
- ^ Kresse, J. I .; Taylor, W. D .; Стюарт, В. К. и Эрнисс, К. А. (1985). «Парвовирусная инфекция свиней с некротическими и пузырьковидными поражениями». Ветеринарный микробиол. 10 (6): 525–531. Дои:10.1016/0378-1135(85)90061-6. PMID 3006323.
- ^ Джонсон, Р. Х., Р. Х. (1969). «Поиск Parvoviridae (Picornaviridae)». Vet Rec. 84 (1): 19–20. Дои:10.1136 / vr.84.1.19. PMID 5812965.
- ^ а б Моримото, Т .; Куроги, H .; Miura, Y .; Сугимори Т. и Фудзисаки Ю. (1972b). «Выделение вируса японского энцефалита и гемагглютинирующего ДНК-вируса из мозга мертворожденных поросят». Natl Inst Anim Health Q (Токио). 12: 127–136.
- ^ а б c Нарита, М .; Inui, S .; Kawakami, Y .; Китамура, К. и Маэда, А. (1975). «Гистопатологические изменения мозга у плодов свиней, естественно инфицированных парвовирусом свиней». Natl Inst Anim Health Q (Токио). 15: 24–28.
- ^ Forman, A.J .; Ленгхаус, С .; Хогг, Г. Г. и Хейл, К. Дж. (1977). «Связь парвовируса со вспышкой внутриутробной гибели плода и мумификации у свиней». Aust Vet J. 53 (7): 326–329. Дои:10.1111 / j.1751-0813.1977.tb00241.x. PMID 921639.
- ^ а б c d Mengeling, W. L .; Cutlip, R.C .; Wilson, R.A .; Паркс, Дж. Б. и Маршалл, Р. Ф. (1975). «Мумификация плода, связанная с парвовирусной инфекцией свиней». J Am Vet Med Assoc. 166 (10): 993–995. PMID 1126862.
- ^ Биронт П. и Бонте П. (1983). «Инфекция свиного парвовируса (P.P.V.) у хряков. I. Возможность генитальной локализации у хряка после ороназальной инфекции». Zentralblatt für Veterinärmedizin. Reihe B. 30 (7): 541–545. Дои:10.1111 / j.1439-0450.1983.tb01879.x. PMID 6316695.
- ^ Thacker, B.J .; Joo, H. S .; Винкельман, Н. Л .; Леман, А. Д. и Барнс, Д. М. (1987). "Клинические, вирусологические и гистопатологические наблюдения индуцированной парвовирусной инфекции свиней у хряков". Am J Vet Res. 48 (5): 763–767. PMID 3035971.
- ^ а б Зигл, Гюнтер (1976). Парвовирусы (1-е изд.). Вена, Австрия: Springer-Verlag.
- ^ Бахманн, Питер А; Хогган, Дэвид; Курстак, Эдуард; Мельник, Джозеф Л; Перейра, Helio G; Таттерсолл, Питер; Ваго, Констан (1979). «Parvoviridae: второй отчет». Интервирология. 11 (4): 248–54. Дои:10.1159/000149041. PMID 372134.
- ^ а б c d е ж грамм час я j k л м п Картрайт, С. Ф .; Лукас М. и Гек Р. А. (1969). «Малый гемагглютинирующий ДНК-вирус свиньи. I. Выделение и свойства». J Comp Pathol. 79 (3): 371–377. Дои:10.1016 / 0021-9975 (69) 90053-X. PMID 4899939.
- ^ а б c d Моримото, Т .; Fujisaki, Y .; Ито Ю. и Танака Ю. (1972a). «Биологические и физико-химические свойства парвовируса свиней, выделенного из мертворожденных поросят». Natl Inst Anim Health Q (Токио). 12: 137–144.
- ^ а б c d Ruckerbauer, G.M .; Dulac, G.C. & Boulanger, P (1978). «Демонстрация парвовируса у канадских свиней и антигенных связей с изолятами из других стран». Может J Comp Med. 42 (3): 278–285. ЧВК 1277639. PMID 356941.
- ^ Cotmore, S. F .; Стурценбекер, Л. Дж. И Таттерсолл, П. (1983). «Автономный парвовирус MVM кодирует два неструктурных белка в дополнение к своим полипептидам капсида». Вирусология. 129 (2): 333–343. Дои:10.1016/0042-6822(83)90172-1. PMID 6623929.
- ^ Mengeling, W. L .; Пол, П. С .; Bunn, T.O .; Ридпат, Дж. Ф. (1986). «Антигенные отношения между автономными парвовирусами». Журнал общей вирусологии. 67 (12): 2839–44. Дои:10.1099/0022-1317-67-12-2839. PMID 2432167.
- ^ Mengeling, W. L .; Ridpath, J. F .; Форвальд, А. С. (1988). «Сравнение размеров и антигенных свойств структурных белков отдельных автономных парвовирусов». Журнал общей вирусологии. 69 (4): 825–37. Дои:10.1099/0022-1317-69-4-825. PMID 3356979.
- ^ Molitor, T. W .; Джу, Х. С. и Коллек, М. С. (1983). «Парвовирус свиней: очистка вируса, структурные и антигенные свойства полипептидов вириона». J Virol. 45 (2): 842–854. ЧВК 256478. PMID 6834473.
- ^ Бернс, Кеннет I. (1984). Парвовирусы. Нью-Йорк: Пленум Пресс.
- ^ Рондхейс, П. Р. и Стравер, П. Дж. (1972). "Enige kenmerken van een klien, гемагглютинендный ДНК-вирус, geisoleer uit een verworpen varkensfoetus". Tijdschr Diergeneeskd. 97: 1257–1267.
- ^ а б c Лукас, М. Х. и Наптин, П. (1971). «Метод флуоресцентных антител в исследовании трех вирусов свиней: вирус трансмиссивного гастроэнтерита, вирус рвоты и истощения, а также парвовирус 59e / 63». J Comp Pathol. 81 (1): 111–117. Дои:10.1016/0021-9975(71)90062-4. PMID 4933149.
- ^ а б c d Менгелинг, В.Л., В.Л. (1975). «Парвовирус свиньи: частота встречающихся в природе трансплацентарных инфекций и вирусного заражения культур клеток почек плода свиньи». Am J Vet Res. 36 (1): 41–44. PMID 163603.
- ^ Пиртл, E.C, EC (1974). «Титрование двух респираторных вирусов свиней в культурах клеток млекопитающих путем прямого флуоресцентного окрашивания антител». Am J Vet Res. 35 (2): 249–250. PMID 4591612.
- ^ а б c Mayr, A .; Бахманн, П. А .; Siegl, G .; Манель, Х. и Шеффи, Б.Е. (1968). «Характеристика небольшого свиного ДНК-вируса». Arch Gesamte Virusforsch. 25 (1): 38–51. Дои:10.1007 / BF01243088. PMID 5729634.
- ^ Бахманн, П.А., PA (1972). «Парвовирусная инфекция свиней in vitro: модель исследования для репликации парвовирусов. I. Репликация при различных температурах». Proc Soc Exp Biol Med. 140 (4): 1369–1374. Дои:10.3181/00379727-140-36676. PMID 5066576.
- ^ а б c Hallauer, C .; Зигл, Г. и Кронауэр, Г. (1972). «Парвовирусы как контаминанты постоянных линий клеток человека. III. Биологические свойства выделенных вирусов». Arch Gesamte Virusforsch. 38 (4): 369–382. Дои:10.1007 / bf01262827. PMID 5083410.
- ^ Теннант, Р. У., Р. У. (1971). «Ингибирование митоза и макромолекулярного синтеза в клетках эмбриона крысы вирусом крысы Килхэма». J Virol. 8 (4): 402–408. ЧВК 376213. PMID 5167023.
- ^ Зигл, Г. и Гаучи, М. (1973a). «Размножение парвовируса Lu III в синхронизированной системе культивирования. I. Оптимальные условия для репликации вируса». Arch Gesamte Virusforsch. 40 (1): 105–118. Дои:10.1007 / bf01242642. PMID 4571169.
- ^ Зигл, Г. и Гаучи, М. (1973b). «Размножение парвовируса Lu III в синхронизированной системе культивирования. II. Биохимические характеристики репликации вируса». Arch Gesamte Virusforsch. 40 (1): 119–127. Дои:10.1007 / bf01242643. PMID 4266337.
- ^ Коакли В. и Смит В. В. (1972). «Парвовирусы свиней в Западной Австралии». Aust Vet J. 48 (9): 536. Дои:10.1111 / j.1751-0813.1972.tb02330.x. PMID 4651130.
- ^ а б c d Джонсон, Р. Х. (1973). «Выделение парвовируса свиней в Квинсленде». Aust Vet J. 49 (3): 257–259. Дои:10.1111 / j.1751-0813.1973.tb06768.x. PMID 4574965.
- ^ а б Пини, А, А (1975). «Парвовирус свиней в стадах свиней на юге Африки». J S Afr Vet Assoc. 46 (3): 241–244. PMID 1219104.
- ^ Joo, H. S .; Donaldson-Wood, C.R .; Джонсон, Р. Х. и Уотсон, Д. Л. (1976d). «Антитела к парвовирусам свиней, кошек и крыс у различных видов животных». Res Vet Sci. 21 (1): 112–113. Дои:10.1016 / S0034-5288 (18) 33407-6. PMID 951520.
- ^ а б Huygelen, C. & Peetermans, J. (1967). «Выделение гемагглютинирующего пикорнавируса из первичной культуры клеток почек свиней». Arch Gesamte Virusforsch. 20 (2): 260–262. Дои:10.1007 / BF01241281. PMID 5598013.
- ^ а б Бахманн, П. А. (1969). "Vorkommen und Verbreitung von Picodna (Parvo) - Virus beim Schwein". Zentralbl. Ветеринарный. B. 16 (4): 341–345. Дои:10.1111 / j.1439-0450.1969.tb00118.x. PMID 5816005.
- ^ а б Хафез С. М. и Лисс Б. (1979). «Выделение парвовируса из культур клеток почек гнотобиотических поросят». Zentralbl. Ветеринарный. B. 26 (10): 820–827. Дои:10.1111 / j.1439-0450.1979.tb00793.x. PMID 394537.
- ^ Hallauer, C .; Кронауэр Г. и Зигл Г. (1971). «Парвовирус как контаминант постоянных линий клеток человека. I. Выделение вируса с 1960 по 1970 год». Arch Gesamte Virusforsch. 35 (1): 80–90. Дои:10.1007 / bf01249755. PMID 5167103.
- ^ Кроган, Д. Л., Мэтчетт, А. (1973). "Стерилизация коммерческого трипсина бета-пропиолактоном". Appl Microbiol. 26 (5): 832. ЧВК 379912. PMID 4586933.
- ^ Croghan, D. L .; Матчетт А. и Коски Т. А (1973). «Выделение парвовируса свиней из коммерческого трипсина».. Appl Microbiol. 26 (3): 431–433. ЧВК 379810. PMID 4584585.
- ^ Менгелинг, В.Л., В.Л. (1978а). «Удаление парвовируса свиней из инфицированных культур клеток путем включения гомологичной антисыворотки в питательную среду». Am J Vet Res. 39 (2): 323–324. PMID 629467.
- ^ а б c d е ж грамм час я j Менгелинг, В.Л., В.Л. (1972). «Парвовирус свиней: свойства и распространенность штамма, выделенного в США». Am J Vet Res. 33 (11): 2239–2248. PMID 4628211.
- ^ Siegl, G .; Халлауэр, К. и Новак, А. (1972). «Парвовирусы как контаминанты постоянных клеточных линий человека. IV. Размножение KBSH-вируса в KB-клетках». Arch Gesamte Virusforsch. 36 (3): 351–62. Дои:10.1007 / BF01249866. PMID 4112026.
- ^ Bachmann, P.A., PA; Даннер, К. (1976). «Парвовирусная инфекция свиней in vitro: модель исследования репликации парвовирусов. II. Кинетика производства вируса и антигена». Zentralbl. Ветеринарный. B. 23 (5–6): 355–363. PMID 986740.
- ^ а б c d Менгелинг, В. Л. и Катлип, Р. К. (1975). «Патогенез внутриутробной инфекции: экспериментальное заражение 5-недельных плодов свиней парвовирусом свиней». Am J Vet Res. 36 (8): 1173–1177. PMID 1098529.
- ^ Дарбишир, Дж. Х. и Робертс, Д. Х. (1968). «Некоторые респираторные вирусные и микоплазменные инфекции животных». Дж. Клин Патол. 21 (Дополнение 2): 61–92.
- ^ Kawamura, H .; Фудзита Т. и Имада Т. (1988). «Образование бляшек и репликация парвовируса свиньи в линии эмбриональных клеток почек свиней, клетки ESK». Jpn J Vet Sci. 50 (3): 803–808. Дои:10.1292 / jvms1939.50.803. PMID 3210492.
- ^ а б Ким, Ю. Х. (1974). «Исследования гемагглютинации и реакции торможения гемагглютинации парвовируса свиней». Бык AZABU Vet Coll. 27: 61–65.
- ^ Joo, H. S .; Donaldson-Wood, C.R .; Джонсон, Р. Х. (1976). «Стандартизированный тест на ингибирование гемагглютинации для антител к парвовирусу свиней». Австралийский ветеринарный журнал. 52 (9): 422–4. Дои:10.1111 / j.1751-0813.1976.tb09517.x. PMID 1016168.
- ^ а б c Joo, H. S .; Donaldson-Wood, C.R .; Джонсон, Р. Х. (1975). «Тест микронейтрализации для анализа антител к парвовирусу свиней». Архив вирусологии. 47 (4): 337–41. Дои:10.1007 / BF01347974. PMID 1169929.
- ^ а б Joo, H. S .; Johnson, R.H .; Уотсон, Д. Л. (1978). «Серологические процедуры для определения времени заражения свиней парвовирусом свиней». Австралийский ветеринарный журнал. 54 (3): 125–7. Дои:10.1111 / j.1751-0813.1978.tb05524.x. PMID 687263.
- ^ Хохдацу, Т; Баба, К; Ide, S; Цучимото, М; Нагано, Н; Ямагами, Т; Ямагиши, H; Fujisaki, Y; Матумото, М. (1988). «Обнаружение антител против парвовируса свиней в сыворотке крови свиней с помощью иммуноферментного анализа». Ветеринарная микробиология. 17 (1): 11–9. Дои:10.1016/0378-1135(88)90075-2. PMID 2845632.
- ^ Вестенбринк, Ф; Veldhuis, M.A .; Бринкхоф, J.M.A (1989). «Иммуноферментный анализ для обнаружения антител к парвовирусу свиней». Журнал вирусологических методов. 23 (2): 169–78. Дои:10.1016/0166-0934(89)90130-4. PMID 2542351.
- ^ Кадар, Даниэль; Дан, Адам; Томбац, Ката; Леринц, Марта; Поцелуй, Тимея; Бечкей, Жолт; Спыну, Марина; Туболы, Тамаш; Чагола, Аттила (2012). «Филогения и эволюционная генетика парвовируса свиней диких кабанов». Инфекция, генетика и эволюция. 12 (6): 1163–71. Дои:10.1016 / j.meegid.2012.04.020. PMID 22575819.
- ^ Кадар, Даниэль; Чагола, Аттила; Поцелуй, Тимея; Туболы, Тамаш (2013). «Эволюция капсидных белков и сравнительная филогения новых парвовирусов свиней». Молекулярная филогенетика и эволюция. 66 (1): 243–53. Дои:10.1016 / j.ympev.2012.09.030. PMID 23044400.
- ^ Etoh, M .; Моришита Э. и Ватанабе Ю. (1979). «Переходные антитела и спонтанная инфекция при парвовирусной инфекции свиней». Jpn J Swine Husb Res. 16: 237–239.
- ^ Пол, П. С .; Менгелинг, У. Л. и Пиртл, Э. С. (1982). «Продолжительность и биологический период полураспада пассивно приобретенных колостральных антител к парвовирусу свиней». Am J Vet Res. 43 (8): 1376–1379. PMID 7103222.
- ^ а б Судзуки, Х. и Фудзисаки, Y (1976). «Иммунизирующие эффекты вакцины против парвовируса свиней на поросятах». Natl Inst Anim Health Q (Токио). 16: 81.
- ^ Пол, П. С .; Менгелинг, В. Л. и Браун, Т. Т. младший (1980). «Влияние вакцинального и пассивного иммунитета на экспериментальное заражение свиней парвовирусом свиней». Am J Vet Res. 41 (9): 1368–1371. PMID 7447129.
- ^ Браун, Т. Т. младший, Т. Т. (1981). «Лабораторная оценка выбранных дезинфицирующих средств в качестве вирулицидных агентов против парвовируса свиней, вируса псевдобешенства и вируса трансмиссивного гастроэнтерита». Am J Vet Res. 42 (6): 1033–1036. PMID 6269467.
- ^ Менгелинг, У. Л. и Пол, П. С. (1986). «Относительная важность свиней и зараженных помещений как резервуаров парвовируса свиней». J Am Vet Med Assoc. 188 (11): 1293–1295. PMID 3013820.
- ^ а б c Картрайт, С. Ф .; Лукас М. и Гек Р. А. (1971). «Небольшой гемагглютинирующий вирус ДНК свиньи. II. Биологические и серологические исследования». J Comp Pathol. 81 (1): 145–155. Дои:10.1016/0021-9975(71)90067-3. PMID 4933150.
- ^ Макадараг, Дж. П. и Андерсон, Г. А. (1975). «Передача вирусов через сперму хряка». In Proc 18th Annu Meet Am Assoc Vet Lab Diagn: 69–76.
- ^ а б Лукас, М. Х .; Картрайт, С. Ф. и Рратхолл, А. Э. (1974). «Генитальное заражение свиней парвовирусом свиней». J Comp Pathol. 84 (3): 347–350. Дои:10.1016/0021-9975(74)90008-5. PMID 4480374.
- ^ Менгелинг, В.Л., В.Л. (1979). «Пренатальная инфекция в результате контакта матери с парвовирусом свиньи на седьмой или четырнадцатый день беременности». Может J Comp Med. 43 (1): 106–109. ЧВК 1319949. PMID 427636.
- ^ а б c d е ж Mengeling, W. L .; Пол, П. С. и Браун, Т. Т. младший (1980a). «Трансплацентарная инфекция и гибель эмбрионов в результате контакта матери с парвовирусом свиней во время зачатия». Arch Virol. 65 (1): 55–62. Дои:10.1007 / BF01340540. PMID 7425850.
- ^ а б Donaldson-Wood, C.R .; Джу, Х. С. и Джонсон, Р. Х (1977). «Влияние парвовирусной инфекции свиней на репродуктивную способность в восприимчивом стаде свиней». Vet Rec. 100 (12): 237–239. Дои:10.1136 / vr.100.12.237. PMID 560744.
- ^ Гиллик, Дж. К., Дж. К. (1977). «Вспышка мумификации плода свиней, связанная с парвовирусом свиней». Aust Vet J. 53 (2): 105–106. Дои:10.1111 / j.1751-0813.1977.tb14903.x. PMID 856144.
- ^ а б Mengeling, W. L .; Катлип, Р. К. и Барнетт, Д. (1978). «Парвовирус свиней: патогенез, распространенность и профилактика». Proc Int Congr Pig Vet Soc. 5: КА 15.
- ^ Redman, D. R .; Бол Э. Х. и Фергюсон Л. К. (1974). «Парвовирус свиней: естественные и экспериментальные инфекции плода свиньи и распространенность среди взрослых свиней». Инфекция и иммунитет. 10 (4): 718–723. ЧВК 423012. PMID 4426705.
- ^ Bachmann, P.A., PA; Sheffy, B.E .; Воан, Дж. Т. (1975). «Экспериментальное внутриутробное инфицирование плодных свиней парвовирусом свиньи». Инфекция и иммунитет. 12 (3): 455–460. ЧВК 415307. PMID 1165118.
- ^ а б c Катлип, Р. К. и Менгелинг, В. Л. (1975b). «Патогенез внутриутробной инфекции восьми- и десятинедельных плодов свиней парвовирусом свиней». Am J Vet Res. 36 (12): 1751–1754. PMID 1200446.
- ^ Choi, C. S .; Molitor, T. W .; Джу, Х. С. и Гюнтер, Р. (1987). «Патогенность кожного изолята парвовируса свиней у плодов свиней». Ветеринарный микробиол. 15 (1–2): 19–29. Дои:10.1016/0378-1135(87)90125-8. PMID 2830705.
- ^ а б Wrathall, A. E. и Mengeling, W. L. (1979a). «Влияние парвовируса свиней на развитие оплодотворенных яиц свиней in vitro». Br Vet J. 135 (3): 249–254. Дои:10.1016 / с0007-1935 (17) 32884-1. PMID 435962.
- ^ Wrathall, A. E. и Mengeling, W. L. (1979b). «Эффект переноса зараженных парвовирусом оплодотворенных яиц свиней в серонегативных свинок». Br Vet J. 135 (3): 255–261. Дои:10.1016 / с0007-1935 (17) 32885-3. PMID 435963.
- ^ Wrathall, A. E. и Mengeling, W. L. (1979c). «Эффект осеменения серопозитивных свинок спермой, содержащей парвовирус свиней». Br Vet J. 135 (5): 420–425. Дои:10.1016 / с0007-1935 (17) 32787-2. PMID 487052.
- ^ а б c d е Ленгхаус, С .; Форман, А. Дж. И Хейл, К. Дж. (1978). «Экспериментальное заражение парвовирусом свиней в возрасте 35, 50 и 60 дней». Aust Vet J. 54 (9): 418–422. Дои:10.1111 / j.1751-0813.1978.tb05565.x. PMID 743053.
- ^ Пол, П. С .; Менгелинг, В. Л. и Браун, Т. Т. младший (1979). «Репликация парвовируса свиней в лимфоцитах, моноцитах и перитонеальных макрофагах периферической крови». Инфекция и иммунитет. 25 (3): 1003–1007. ЧВК 414548. PMID 574124.
- ^ а б c d Hogg, G.G .; Ленгхаус, К. и Форман, А. Дж. (1977). «Экспериментальная инфекция парвовируса свиней у плодов свиней, приводящая к аборту, гистологическим повреждениям и образованию антител». J Comp Pathol. 87 (4): 539–549. Дои:10.1016/0021-9975(77)90060-3. PMID 591653.
- ^ а б c d Joo, H. S .; Donaldson-Wood, C.R .; Джонсон, Р. Х. и Кэмпбелл, Р. С. Ф. (1977). «Патогенез парвовирусной инфекции свиней: патология и иммунофлюоресценция у плода». J Comp Pathol. 87 (3): 383–391. Дои:10.1016/0021-9975(77)90028-7. PMID 332722.
- ^ Маррабл, А. В. и Эшдаун, Р. Р. (1967). «Количественные наблюдения за эмбрионами свиней известного возраста». J Agric Sci. 69 (3): 443–447. Дои:10.1017 / S0021859600019134.
- ^ а б Rodeffer, H.E .; Leman, A.D .; Dunne, H.W .; Кроппер, М., Спречер, Д. Дж. (1975).«Репродуктивная недостаточность свиней, связанная с материнской сероконверсией на парвовирус свиней». J Am Vet Med Assoc. 166: 991–995.
- ^ а б Joo, H. S .; Дональдсон-Вуд, К. Р. и Джонсон, Р. Х (1976b). «Методы экспресс-диагностики парвовирусной инфекции свиней у мумифицированных плодов». Aust Vet J. 52 (1): 51–2. Дои:10.1111 / j.1751-0813.1976.tb05380.x. PMID 944570.
- ^ Джу, Х. С. и Джонсон, Р. Х. (1977a). «Наблюдения по экспресс-диагностике парвовируса свиней у мумифицированных плодов». Aust Vet J. 53 (2): 106–107. Дои:10.1111 / j.1751-0813.1977.tb14904.x. PMID 856145.
- ^ Картрайт, С. Ф. (1970). «Доступны тесты для обнаружения некоторых вирусных инфекций свиней и их интерпретация». Ветеринар Анну. 11: 77–82.
- ^ Chaniago, T. D .; Watson, D. L .; Оуэн, Р. А. и Джонсон, Р. Х. (1978). «Иммуноглобулины в сыворотке крови плодных свиней». Австралийский ветеринарный журнал. 54 (1): 30–33. Дои:10.1111 / j.1751-0813.1978.tb00268.x. PMID 655968.
- ^ Cropper, M .; Dunne, H.W .; Leman, A.D .; Старки, А. Л. и Хефлинг, Д. К. (1976). «Распространенность антител к энтеровирусам свиней и парвовирусу свиней в биологических жидкостях плодных свиней из маленьких и больших пометов». J Am Vet Med Assoc. 168 (3): 233–235. PMID 175042.
- ^ Ide, S .; Ямагиши, К .; Yoshimura, M .; Maniwa, E .; Ясуда, Х. и Игараси, Дж. (1977). «Реакция свиней на введение бивалентной вакцины против вируса японского энцефалита В и парвовируса свиней». J Jpn Vet Med Assoc. 30 (6): 322–325. Дои:10.12935 / jvma1951.30.322.
- ^ а б Джу, Х. С. и Джонсон, Р. Х. (1977b). «Серологические реакции у свиней, вакцинированных инактивированным парвовирусом свиней». Aust Vet J. 53 (11): 550–552. Дои:10.1111 / j.1751-0813.1977.tb07945.x. PMID 565631.
- ^ Менгелинг, В. Л. (1977). «Диагностика репродуктивной недостаточности свиней, вызванной парвовирусом». В Proc 20th Annu Meet Am Assoc Vet Lab Diagn: 237–244.
- ^ а б Фудзисаки, Ю. (1978). «Заболеваемость и борьба с мертворождением, вызванным парвовирусом свиней в Японии». Proc Congr Int Pig Vet Soc. 5: КА 14.
- ^ Fujisaki, Y .; Watanabe, Y .; Kodama, K .; Hamada, H .; Murakami, Y .; Сугимори Т. и Сасахара Дж. (1978b). «Защита свиней инактивированной вакциной против парвовируса свиней от внутриутробной инфекции». Natl Inst Anim Health Q (Токио). 18: 185.
- ^ а б c Mengeling, W. L .; Brown, T. T. Jr .; Пол П. С. и Гюнтекунст Д. Э. (1979). «Эффективность вакцины на основе инактивированного вируса для предотвращения репродуктивной недостаточности, вызванной парвовирусом свиней». Am J Vet Res. 40 (2): 204–207. PMID 464358.
- ^ а б Mengeling, W. L .; Пол, П. С .; Gutekunst, D. E .; Пиртл, Э. К. и Браун, Т. Т. младший (1980b). «Вакцинация от репродуктивной недостаточности, вызванной парвовирусом свиней». Proc Int Congr Pig Vet Soc. 6: 61.
- ^ а б c Пол П. С. и Менгелинг В. Л. (1980). «Оценка модифицированной вакцины с живым вирусом для профилактики репродуктивного заболевания свиней, вызванного парвовирусом свиней». Am J Vet Res. 41 (12): 2007–2011. PMID 7212434.
- ^ Фудзисаки Ю. и Муриками Ю. (1982). «Иммунитет к заражению парвовирусом свиней у свиней, инокулированных аттенуированным HT-штаммом». Natl Inst Anim Health (Токио). 22: 36–37.
- ^ Fujisaki, Y .; Ichihara, T .; Sasaki, N .; Shimizu, F .; Murakami, Y .; Сугимори Т. и Сасахара Дж. (1978a). «Полевые испытания вакцины на основе инактивированного парвовируса свиней для предотвращения вирусного мертворождения среди свиней». Natl Inst Anim Health Q (Токио). 18: 184–185.
- ^ Пол П. С. и Менгелинг В. Л. (1986). «Вакцинация свиней инактивированной парвовирусной вакциной свиней при наличии пассивного иммунитета». J Am Vet Med Assoc. 188 (4): 410–413. PMID 3949618.
- ^ Пол П. С. и Менгелинг В. Л. (1984). «Ороназальная и внутримышечная вакцинация свиней модифицированной живой вакциной против парвовируса свиней: размножение и передача вакцинного вируса». Am J Vet Res. 45 (12): 2481–2485. PMID 6098202.
- ^ Mengeling, W. L .; Пейсак, З. и Пол, П.С. (1984). «Биологический анализ аттенуированного штамма NADL-2 и вирулентного штамма NADL-8 парвовируса свиней». Am J Vet Res. 45 (11): 2403–2407. PMID 6098200.
![]() Эта статья включает текст из «Болезни свиней (8-е издание)». Согласно заявлению об авторских правах, "Авторские права не требуются для глав 17, 23, 25, 31 и 64, которые находятся в всеобщее достояние.".
Эта статья включает текст из «Болезни свиней (8-е издание)». Согласно заявлению об авторских правах, "Авторские права не требуются для глав 17, 23, 25, 31 и 64, которые находятся в всеобщее достояние.".
