Аукубин - Aucubin - Wikipedia
Эта статья может быть слишком техническим для большинства читателей, чтобы понять. (Март 2019 г.) (Узнайте, как и когда удалить этот шаблон сообщения) |
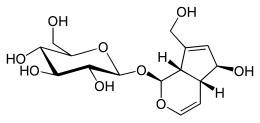 | |
| Имена | |
|---|---|
| Название ИЮПАК (2S,3р,4S,5S,6р)-2-[-(1S, 4ар,5S, 7аS-5-Гидрокси-7- (гидроксиметил-1,4a, 5,7a-тетрагидроциклопента- [c] -пиран-1-ил] окси] -6- (гидроксиметил) оксан-3,4,5-триол | |
| Другие имена Аукубин | |
| Идентификаторы | |
3D модель (JSmol ) | |
| 50340 | |
| ЧЭМБЛ | |
| ChemSpider | |
| ECHA InfoCard | 100.006.856 |
| Номер ЕС |
|
| КЕГГ | |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| C15ЧАС22О9 | |
| Молярная масса | 346.332 г · моль−1 |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Аукубин является иридоид гликозид.[1] Иридоиды обычно содержатся в растениях и действуют как защитные соединения.[1] Иридоиды снижают скорость роста многих травоядных.[2]
Природные явления
Аукубин, как и другие иридоиды, находится в астериды Такие как Аукуба японская (Garryaceae), Eucommia ulmoides (Eucommiaceae), Подорожник азиатский, Подорожник крупный, Подорожник ланцетный (Plantaginaceae), Галиум апарин (Rubiaceae) и другие. Эти растения используются в традиционной китайской и народной медицине.[3]
Агнусид состоит из аукубина и п-гидроксибензойная кислота.[4]
Влияние на здоровье
Было обнаружено, что аукубин защищает от повреждения печени, вызванного четыреххлористый углерод или же альфа-аманитин у мышей и крыс при внутрибрюшинном введении 80 мг / кг.[5]
Химия
Аукубин - это соединение на основе монотерпеноидов.[6] Аукубин, как и все иридоиды, имеет скелет циклопентан- [C] -пиран.[6] Иридоиды могут состоять из десяти, девяти или редко из восьми атомов углерода, в которых C11 чаще отсутствует, чем C10.[6] Аукубин имеет 10 атомов углерода, а углерод C11 отсутствует. Стереохимические конфигурации в C5 и C9 приводят к цис-конденсированным кольцам, которые являются общими для всех иридоидов, содержащих карбоциклический или секо-скелет в неперегруппированной форме.[6] Окислительное расщепление по связи C7-C8 дает секоиридоиды.[7] Последние шаги в биосинтезе иридоидов обычно состоят из О-гликозилирование и О-алкилирование. Аукубин, гликозидный иридоид, имеет О-связанный глюкоза часть.
Биосинтез
Геранилпирофосфат (GPP) является предшественником иридоидов.[8] Геранилфосфат образуется через мевалонатный путь или метилэритритолфосфатный путь.[8] На начальных этапах пути происходит слияние трех молекул ацетил-КоА с образованием соединения С6 3-гидрокси-3-метилглутарил-КоА (HMG-CoA).[8] Затем HMG-CoA восстанавливается в два этапа под действием фермента HMG-CoA редуктазы.[8] Результирующий мевалонат затем последовательно фосфорилируется двумя отдельными киназами, мевалонаткиназой и фосфомевалонаткиназой, с образованием 5-пирофосфомевалоната.[8] Фосфомевалонатдекарбоксилаза в результате согласованной реакции декарбоксилирования дает изопентенилпирофосфат (IPP).[8] IPP является основным строительным блоком C5, который добавляется к косубстратам пренилфосфата для образования более длинных цепей.[8] IPP изомеризуется в аллиловый эфир диметилаллил пирофосфат (DMAPP) с помощью изомеразы IPP.[8] Посредством многостадийного процесса, включающего дефосфорилирование, DMAPP, IPP и DMAPP объединяются с образованием соединения C10. геранилпирофосфат (GPP).[8] Геранилпирофосфат является основным местом разветвления терпеноид синтез.[8]
Текущий[когда? ] Исследования биосинтеза показывают, что наиболее вероятная синтетическая последовательность от 10-гидроксигеринола до 8-эпи-iriotrial представляет собой следующее: дефосфорилирование GPP приводит к геранильному катиону, который затем гидроксилируется с образованием 10-гидроксигераниола; 10-гидроксилгераниол изомеризуется в 10-гидроксинерол; 10-гидроксинерол окисляется с помощью НАД с образованием триальдегида; наконец, триальдегид подвергается двойному добавлению по Майклу с получением 8-эпиридотриала.[9] 8-Эпиридотриал - еще одно промежуточное звено точки ветвления.[6]
Реакция циклизирования с образованием иридоид-пиранового кольца может происходить по одному из двух путей:
- маршрут 1 - гидридная нуклеофильная атака на C1 приведет к 1-Оатака атома карбонила на C3 с образованием лактонового кольца;
- маршрут 2 - потеря протона из углерода 4 приводит к образованию двойной связи C3-C4; следовательно, 3-О-карбонильный атом присоединяется к С1.[6]
Основываясь на исследованиях слежения за дейтерием, путь биосинтеза аубуцина из циклизованного промежуточного лактона является специфическим для организма.[6] В Гардения жасминоидная промежуточный циклизованный лактон гликозилируется с образованием бошналозида, который затем гидроксилируется по C10; бошналозид окисляется до генипозидовая кислота; затем генипозидовая кислота декарбоксилируется с образованием бартизиозида; затем бартизиозид гидроксилируется с образованием аукубина.[6] В Скрофулярия умброза биосинтетический путь отличается от Гардения жасминоидная. В Скрофулярия умброза промежуточный лактон гликозилируется и окисляется по C11 карбонилу с образованием 8-эпидексо-логановой кислоты, которая затем превращается в дезоксигенипозидиновую кислоту; дезоксигенипозидовая кислота гидроксилирована по С10 до генипозидовой кислоты; декарбоксилирование и гидроксилирование C6 приводит к обуцину.[10]
Рекомендации
- ^ а б Nieminen M; Suomi J; Ван Нууис С (2003). «Влияние содержания иридоидных гликозидов на выбор растения-хозяина для яйцекладки и паразитов у специализированного травоядного животного». J. Chem. Ecol. 29 (4): 823–843. Дои:10.1023 / А: 1022923514534. PMID 12775146.
- ^ Puttick G, Bowers M (1998). «Влияние качественного и количественного изменения аллелохимических веществ на универсальное насекомое: иридоидные гликозиды и южный совок». J. Chem. Ecol. 14: 335–351. Дои:10.1007 / BF01022550.
- ^ Сух Н, Шим С., Ли М., Ким С., Чанг И. (1991). «Фармакокинетическое исследование иридоидного глюкозида: аукубина». Фармацевтические исследования. 8 (8): 1059–1063. Дои:10.1023 / А: 1015821527621. PMID 1924160.
- ^ Ева Хоберг; Beat Meier & Otto Sticher (сентябрь – октябрь 2000 г.). «Аналитический метод высокоэффективной жидкостной хроматографии для определения содержания агнусида и п-гидроксибензойной кислоты во фруктозе Агни-касти». Фитохимический анализ. 11 (5): 327–329. Дои:10.1002 / 1099-1565 (200009/10) 11: 5 <327 :: AID-PCA523> 3.0.CO; 2-0.
- ^ Ян К., Квон С., Чхве Х, Юн Х, Чанг И (1983). «Защитный эффект Aucuba japonica против повреждения carbontetrackmkxmms у крыс». Drug Chem. Токсикол. 6 (5): 429–441. Дои:10.3109/01480548309014165. PMID 6628265.
- ^ а б c d е ж грамм час Сампио-Сантос М, Каплан М (2001). «Значение биосинтеза иридоидов в хемосистематике». J. Braz. Chem. Soc. 12 (2): 144–153. Дои:10.1590 / S0103-50532001000200004.
- ^ Эль-Наггар Л., Бил Дж. (1980). «Иридоиды: обзор». J. Nat. Прод. 43 (6): 649–707. Дои:10.1021 / np50012a001. PMID 20707392.
- ^ а б c d е ж грамм час я j McGarbey, D; Крото Р. (1995). «Терпеноидный метаболизм». Растительная клетка. 7 (3): 1015–26. Дои:10.1105 / tpc.7.7.1015. ЧВК 160903. PMID 7640522.
- ^ Нангиа А., Прасуна Г., Рао П. (1997). «Синтез циклопента [c] пиранового скелета иридоидных лактонов». Тетраэдр. 53 (43): 14507–14545. Дои:10.1016 / S0040-4020 (97) 00748-5.
- ^ Дамтофт С, Дженсен С, Джессен С, Кнудсен Т (1993). «Поздние стадии биосинтеза аукубина в Scrophularia». Фитохимия. 35 (5): 1089–1093. Дои:10.1016 / 0031-9422 (93) 85028-П.
