Реакция Белоусова – Жаботинского - Belousov–Zhabotinsky reaction

А Реакция Белоусова – Жаботинского, или же БЖ реакция, является одним из класса реакций, которые служат классическим примером неравновесная термодинамика, что привело к созданию нелинейный химический осциллятор. Единственным общим элементом в этих генераторах является включение брома и кислоты. Эти реакции важны для теоретической химии, поскольку показывают, что в химических реакциях необязательно доминировать равновесная термодинамика поведение. Эти реакции далеки от равновесия, остаются таковыми в течение значительного времени и развиваются. хаотично.[1] В этом смысле они представляют собой интересную химическую модель неравновесного биологического[требуется разъяснение ] явления; как таковые, математические модели и моделирование реакций BZ сами по себе представляют теоретический интерес, показывая явление как порядок, вызванный шумом.[2]

Существенным аспектом реакции БЖ является ее так называемая «возбудимость»; под влиянием стимулов паттерны развиваются в том, что в противном случае было бы совершенно неподвижной средой. Некоторые часы реакции, такие как Бриггс-Раушер и БЖ с помощью трис (бипиридин) рутений (II) хлорид как катализатор может быть возбужден в самоорганизующийся активность через влияние света.
История

Открытие этого явления приписывают Борис Белоусов. В 1951 году при попытке найти неорганический аналог Цикл Кребса, он отметил, что в сочетании бромат калия, сульфат церия (IV), малоновая кислота, и лимонная кислота в разбавленном серная кислота соотношение концентраций ионов церия (IV) и церия (III) колебалось, в результате чего цвет раствора колебался между желтым и бесцветным растворами. Это происходит из-за того, что ионы церия (IV) восстанавливаются малоновой кислотой до ионов церия (III), которые затем окисляются обратно до ионов церия (IV) ионами бромата (V).
Белоусов предпринял две попытки опубликовать свое открытие, но ему было отказано на том основании, что он не мог объяснить свои результаты к удовлетворению редакторов журналов, в которые он отправлял свои результаты.[3] Советский биохимик Симон Эльевич Шнолль призвал Белоусова продолжить свои усилия по публикации своих результатов. В 1959 году его работа была наконец опубликована в менее респектабельном, нерецензируемом журнале.[4]
После публикации Белоусова Шноль передал проект в 1961 году аспиранту, Анатолий Жаботинский, подробно исследовавший последовательность реакций;[5] однако результаты работы этих людей все еще не получили широкого распространения и не были известны на Западе до конференции в г. Прага в 1968 г.
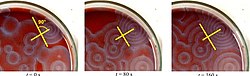
Ряд коктейлей BZ доступен в химической литературе и в Интернете. Ферроин, а сложный из фенантролин и утюг, является обычным индикатор. Эти реакции, если их проводить в чашки Петри, приводят к образованию первых цветных пятен. Эти пятна превращаются в серию расширяющихся концентрических колец или, возможно, расширяющихся спиралей, подобных узорам, генерируемым циклический клеточный автомат. Цвета исчезают, если посуду встряхивать, а затем снова появляются. Волны продолжаются до тех пор, пока не израсходуются реагенты. Реакцию также можно проводить в стакан с помощью магнитная мешалка.
Андрей Адамацки,[6] компьютерный ученый в Университет Западной Англии, сообщил о жидких логических вентилях с помощью реакции БЖ.[7]
Поразительно похожие колебательные спиральные паттерны появляются повсюду в природе, в очень разных пространственных и временных масштабах, например паттерн роста Dictyostelium discoideum, земляной дом амеба колония.[8] В реакции BZ размер взаимодействующих элементов является молекулярным, а время реакции составляет минуты. В случае почвенной амебы размер элементов типичен для одноклеточных организмов, и время на это от нескольких дней до нескольких лет.
Исследователи также изучают возможность создания «влажного компьютера», используя самосоздающиеся «клетки» и другие методы для имитации определенных свойств нейроны.[9]
Химический механизм
Механизм этой реакции очень сложен и, как считается, включает около 18 различных этапов, которые были предметом ряда исследовательских работ.[10][11]
Подобным образом Реакция Бриггса – Раушера, два ключевых процесса (оба автокаталитический ) происходить; процесс A генерирует молекулярный бром, придающий красную окраску, а процесс B потребляет бром с образованием ионов бромида.[12]
Один из наиболее распространенных вариантов этой реакции использует малоновая кислота (CH2(CO2ЧАС)2) как кислота и бромат калия (KBrO3) как источник брома. Общее уравнение:[12]
- 3 канала2(CO2ЧАС)2 + 4 Братан−
3 → 4 руб.− + 9 СО2 + 6 часов2О
Варианты
Существует множество вариантов реакции. Единственным ключевым химическим веществом является окислитель бромата. Ионом катализатора чаще всего является церий, но это также может быть марганец или комплексы железа, рутения, кобальта, меди, хрома, серебра, никеля и осмия. Можно использовать множество различных восстановителей. (Жаботинский, 1964б; Филд, Бургер, 1985)[13]
Когда реакция проходит в микроэмульсия.
Смотрите также
- Автоволна
- Автоволновый ревербератор
- Реакция Бриггса – Раушера
- Рассеивание
- Возбудимая среда
- Порядок, вызванный шумом
- Узоры в природе
- Реакция – диффузия
- Автоколебание
- Самоорганизация
- Алан Тьюринг кто математически предсказал осциллирующие химические реакции в начале 1950-х
- Брюсселятор
- Орегонатор
Рекомендации
- ^ Hudson, J.L .; Манкин, Дж. К. (1981). «Хаос в реакции Белоусова – Жаботинского». J. Chem. Phys. 74 (11): 6171–6177. Дои:10.1063/1.441007.
- ^ Matsumoto, K .; Цуда, И. (1983). «Шумовой порядок». J Stat Phys. 31 (1): 87–106. Дои:10.1007 / BF01010923. S2CID 189855973.
- ^ Уинфри, А. Т. (1984). «Предыстория осциллятора Белоусова-Жаботинского». Журнал химического образования. 61 (8): 661–663. Bibcode:1984JChEd..61..661W. Дои:10.1021 / ed061p661.
- ^ Белоусов Б.П. (1959). "Периодически действующая реакция и ее механизм" [Периодически действующая реакция и ее механизм]. Сборник рефератов по радиационной медицине. 147: 145.
- ^ А. М. Жаботинский (1964). «Периодический процесс окисления малоновой кислоты растворе». Биофизика. 9: 306–311.
- ^ "Энди Адамацки". Университет Западной Англии, Бристоль. Архивировано из оригинал на 2019-04-12. Получено 2006-10-23.
- ^ Motoike, Ikuko N .; Адамацки, Эндрю (2005). «Трехзначные логические ворота в реакционно-диффузионных возбудимых средах». Хаос, солитоны и фракталы. 24 (1): 107–14. Bibcode:2005CSF .... 24..107M. Дои:10.1016 / j.chaos.2004.07.021.
- ^ "Картинная галерея". Отделение биофизики, Магдебургский университет Отто фон Герике.
- ^ Палмер, Дж. (11 января 2010 г.). «Химический компьютер, который имитирует создаваемые нейроны». BBC (Новости науки).
- ^ Филд, Ричард Дж .; Ферстерлинг, Хорст Дитер (1986). "О константах скорости химии оксибромина с ионами церия в механизме Филда-Корёша-Нойеса реакции Белоусова-Жаботинского: равновесный HBrO2 + BrO3− + H + → 2 BrO2• + H2О ". Журнал физической химии. 90 (21): 5400–7. Дои:10.1021 / j100412a101.
- ^ Сиримунгкала, Атчара; Фёрстерлинг, Хорст-Дитер; Дласк, Владимир; Филд, Ричард Дж. (1999). «Реакции бромирования, важные в механизме системы Белоусова-Жаботинского». Журнал физической химии A. 103 (8): 1038–43. Bibcode:1999JPCA..103.1038S. Дои:10.1021 / jp9825213.
- ^ а б Листер, Тед (1995). Демонстрации классической химии (PDF). Лондон: Отдел образования Королевского химического общества. С. 3–4. ISBN 978-1-870343-38-1. Архивировано из оригинал (PDF) на 2014-08-16.
- ^ Жаботинский, Анатолий (2007). "Реакция Белоусова-Жаботинского". Scholarpedia. 2 (9): 1435. Дои:10.4249 / scholarpedia.1435.
дальнейшее чтение
- Строгац, С. (2003). SYNC, развивающаяся наука о спонтанном порядке. Гиперион. С. 212–216, 219. ISBN 0-7868-6844-9.
- Pabian, R.K .; Зариньш, А. Полосатые агаты, происхождение и включения. Учебный циркуляр. 12. Университет Небраски-Линкольн.
- Ичино, Т .; Asahi, T .; Kitahata, H .; Магоме, Н .; Агладзе, К .; Йошикава, К. (2008). «Микрофрахт, доставленный химическими волнами». Журнал физической химии C. 112 (8): 3032–5. Дои:10.1021 / jp7097922.
внешняя ссылка
- Интерактивный научный эксперимент, демонстрирующий реакцию BZ (A-level)[постоянная мертвая ссылка ]
- Обзорная статья по математике реакции БЖ
- Статья в Scholarpedia о реакции Белоусова-Жаботинского
- Реакция Белоусова – Жаботинского.
- Реакция Белоусова-Жаботинского
- Феноменология реакции Белоусова – Жаботинского с иллюстрациями
- БЖ реакция и объяснение в Периодическая таблица видео
- Реакция Белоусова – Жаботинского. (Файл PDF)
- "Бумажный груз прибывает на химические волны" - Осциллирующие химические волны, вызванные реакциями BZ, могут перемещать небольшие объекты, Новый ученый, 18 февраля 2008 г.
- Домашняя страница Анатолия Михайловича Жаботинского
- Моделирование реакций Белоусова-Жаботинского в Pixel Bender Симуляция реакции Белоусова – Жаботинского, работающая внутри Flash Player.
