Информатика биоизображений - Bioimage informatics
Информатика биоизображений является подполем биоинформатика и вычислительная биология.[1] Он фокусируется на использовании вычислительных методов для анализа биоизображений, особенно изображений клеток и молекул, в крупном масштабе и с высокой пропускной способностью. Цель - получить полезные знания из сложного и разнородного изображения и связанных с ним метаданные.
Автоматические микроскопы могут собирать большое количество изображений с минимальным вмешательством. Это привело к взрывному росту объемов данных, который абсолютно требует автоматической обработки. Вдобавок, что удивительно, для некоторых из этих задач есть доказательства того, что автоматизированные системы могут работать лучше, чем люди.[2][3] Кроме того, автоматизированные системы беспристрастны, в отличие от человеческого анализа, на оценку которого (даже неосознанно) может повлиять желаемый результат.
Все больше внимания уделяется развитию романа. обработка изображений, компьютерное зрение, сбор данных, базы данных и методы визуализации для извлечения, сравнения, поиска и управления биологическими знаниями в этих проблемах с большим объемом данных.[4][5]
Модальности данных
Используются несколько систем и платформ сбора данных, для которых требуются различные методы для оптимальной обработки.
Флуоресцентная микроскопия

Флуоресцентная микроскопия позволяет прямую визуализацию молекул на субклеточном уровне как в живых, так и в фиксированный клетки. Интересующие молекулы отмечены либо зеленый флуоресцентный белок (GFP), другой флуоресцентный белок или флуоресцентно меченый антитело. Регулярно используются несколько типов микроскопов: широкопольные, конфокальный, или же двухфотонный. Большинство систем микроскопии также поддерживают сбор временных рядов (фильмов).
Как правило, фильтры используются так, чтобы каждый краситель отображался отдельно (например, синий фильтр используется для изображения Hoechst, затем быстро переключился на зеленый фильтр для изображения GFP). Для потребления изображения часто отображаются в ложный цвет показывая каждый канал другим цветом, но они могут даже не иметь отношения к исходным используемым длинам волн. В некоторых случаях исходное изображение могло быть получено даже в невидимых длинах волн (инфракрасное излучение является обычным явлением).
Выбор на этапе получения изображения влияет на анализ и часто требует специальной обработки. Конфокальные стеки потребуют 3D-обработки, а псевдостеки с широким полем часто выигрывают от цифровая деконволюция чтобы убрать расфокусированный свет.
Появление автоматических микроскопов, которые могут автоматически получать множество изображений, является одной из причин, почему анализ нельзя проводить на глаз (в противном случае аннотации быстро стали бы узким местом исследования). Использование автоматических микроскопов означает, что некоторые изображения могут быть не в фокусе (системы автоматического определения фокуса иногда могут работать неправильно), содержать небольшое количество клеток или быть заполненными мусором. Следовательно, полученные изображения будет труднее анализировать, чем изображения, полученные оператором, поскольку он выбрал бы другие места для изображения и правильной фокусировки. С другой стороны, оператор может внести неосознанную ошибку в свой выбор, выбрав только те клетки, фенотип которых наиболее похож на тот, который ожидался до эксперимента.
Гистология

Гистология представляет собой приложение для микроскопии, при котором срезы тканей окрашивают и наблюдают под микроскопом (обычно с помощью светового микроскопа, но также используется электронная микроскопия).
При использовании светового микроскопа, в отличие от флуоресцентного изображения, изображения обычно получают с использованием стандартных цветных камер. Это частично отражает историю области, где люди часто интерпретировали изображения, но также и тот факт, что образец можно освещать белым светом и собирать весь свет, а не возбуждать флуорофоры. Когда используется более одного красителя, необходимым этапом предварительной обработки является размешивание каналов и получение оценки интенсивностей, характерных для чистого красителя.
Было показано, что субклеточное расположение окрашенных белков можно определить по гистологическим изображениям.
Если целью является медицинская диагностика, то приложения гистологии часто попадают в сферу цифровая патология или же автоматический анализ изображений тканей, которые являются родственными областями информатики биоизображений. Часто применимы одни и те же вычислительные методы, но цели скорее медицинские, чем исследовательские.
Важные проблемы
Анализ субклеточного местоположения

Анализ субклеточного местоположения был одной из первых проблем в этой области. В контролируемом режиме проблема состоит в том, чтобы изучить классификатор, который может распознавать изображения из основной ячейки. органеллы на основе изображений.
Используемые методы основаны на машинное обучение, Здание дискриминантный классификатор на основе числовые функции вычисляется из изображения. Возможности - это либо общие функции из компьютерное зрение, Такие как Особенности текстуры Haralick или особенности, специально разработанные для захвата биологических факторов (например, совместная локализация с ядерным маркером является типичным примером).
Для основной проблемы идентификации органелл можно получить очень высокие значения точности, в том числе лучше чем? полученные результаты.[2] Эти методы полезны в фундаментальных исследованиях клеточной биологии, но также применяются для открытия белков, местоположение которых изменяется в раковых клетках.[6]
Однако разделение на органеллы представляет собой ограниченную форму проблемы, поскольку многие белки будут локализоваться в нескольких местах одновременно (смешанные структуры), и можно различить многие структуры, даже если они не являются разными мембраносвязанными компонентами. В этой области есть несколько нерешенных проблем, и исследования продолжаются.
Скрининг с высоким содержанием

Экраны с высокой пропускной способностью с использованием технологии автоматизированной обработки изображений (иногда называемой высококонтентный просмотр ) стали стандартным методом как для открытия лекарств, так и для фундаментальных биологических исследований. Используя многолуночные планшеты, робототехнику и автоматизированную микроскопию, один и тот же анализ можно применить к большой библиотеке возможных реагентов (обычно либо маленькие молекулы или же РНКи ) очень быстро, получая тысячи изображений за короткое время. Из-за большого объема генерируемых данных автоматический анализ изображений необходим.[7]
Когда доступны положительные и отрицательные контроли, к проблеме можно подойти как к проблеме классификации, и можно применить те же методы вычисления и классификации признаков, которые используются для анализа субклеточного местоположения.
Сегментация
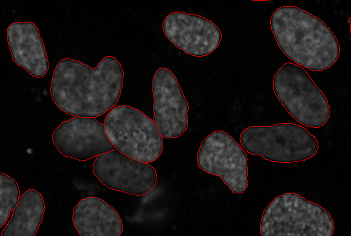
Сегментация ячеек - важная подзадача во многих областях ниже (и иногда полезна сама по себе, если цель состоит только в подсчете количества ячеек в анализ жизнеспособности ). Цель состоит в том, чтобы определить границы ячеек на многоклеточном изображении. Это позволяет обрабатывать каждую ячейку индивидуально для измерения параметров. В трехмерных данных сегментация должна выполняться в трехмерном пространстве.
Поскольку отображение ядерного маркера является обычным явлением для многих изображений, широко используется протокол для сегментации ядер. Это может быть полезно само по себе, если необходимы ядерные измерения, или может служить для посева водораздел который расширяет сегментацию на все изображение.
Все основные методы сегментации были описаны на изображениях клеток, начиная с простых пороговое значение нивелировать установленные методы. Поскольку существует несколько модальностей изображения и разные типы ячеек, каждый из которых предполагает разные компромиссы, единого принятого решения для этой проблемы не существует.
Сегментация изображения клеток как важная процедура часто используется для изучения экспрессии генов, взаимосвязи колокализации и т. Д. Отдельных клеток. В таких случаях одноклеточного анализа часто необходимо однозначно определить идентичность клеток при сегментировании клеток. Такая задача распознавания часто является нетривиальной в вычислительном отношении. Для модельных организмов, таких как C. elegans, которые имеют четко определенные клеточные клоны, можно явно распознать идентичность клеток с помощью анализа изображений, комбинируя методы сегментации изображения и распознавания образов.[9] Одновременная сегментация и распознавание клеток[10] также был предложен как более точное решение этой проблемы, когда доступен «атлас» или другая априорная информация о ячейках. Поскольку экспрессия генов при разрешении отдельных клеток может быть получена с использованием этих типов подходов на основе визуализации, можно комбинировать эти методы с другими методами количественной оценки экспрессии генов отдельных клеток, такими как RNAseq.
Отслеживание
Отслеживание - еще одна традиционная проблема обработки изображений, которая появляется в информатике биоизображений. Проблема в том, чтобы связать объекты, которые появляются в последующих кадрах фильма. Как и в случае с сегментацией, проблема может быть поставлена как в двух-, так и в трехмерной форме.[11]
В случае флуоресцентной визуализации отслеживание часто должно выполняться на очень низкоконтрастных изображениях. Поскольку получение высокого контраста достигается за счет большего количества света, который повреждает образец и разрушает краситель, освещенность сведена к минимуму. Часто бывает полезно подумать о бюджете фотонов: количество фотонов, которые можно использовать для построения изображения до того, как образец будет поврежден, настолько велико, что данным больше нельзя доверять. Следовательно, если необходимо получить высококонтрастные изображения, можно использовать только несколько кадров; тогда как для длинных фильмов каждый кадр будет иметь очень низкий контраст.
Постановка на учет
Когда рассматриваются образцы данных изображений различной природы, например, соответствующие различным методам маркировки, различным лицам, выборкам в разные моменты времени и т. Д., Изображения часто необходимо регистрировать для лучшего сравнения. Одним из примеров является сбор данных о динамике времени, изображения в последующих кадрах часто должны быть зарегистрированный чтобы можно было скорректировать незначительные сдвиги в положении камеры. Другой пример: когда много изображений модельного животного (например, C. elegans или же Мозг дрозофилы или мозг мыши ), часто существует значительная потребность в регистрации этих изображений для сравнения их паттернов (например, они соответствуют одной или разной популяции нейронов, имеют общую или различаются экспрессией генов и т. д.).
Пакеты программного обеспечения для регистрации медицинских изображений были ранними попытками использования приложений для регистрации микроскопических изображений. Однако из-за часто гораздо большего размера файла изображения и гораздо большего количества образцов в экспериментах во многих случаях необходимо разработать новое программное обеспечение для регистрации трехмерных изображений. В BrainAligner[12] - это программное обеспечение, которое использовалось для автоматизации процесса трехмерной деформируемой и нелинейной регистрации с использованием стратегии надежного сопоставления ориентиров. Он в основном использовался для создания более 50 000 стандартизированных трехмерных изображений мозга плодовых мух на ферме Janelia в HHMI, а также для других приложений, включая стрекоз и мышей.
Важные места
Консорциум ученых из университетов и исследовательских институтов организовал ежегодные встречи по информатике биоизображений.[13] с 2005 года. ISMB конференция имела Биоимиджинг и визуализация данных трек с 2010 года. Журнал Биоинформатика также представил Информатика биоизображений трек 2012 года. Журнал OpenAccess BMC Bioinformatics есть раздел, посвященный анализу биоизображений, визуализации и связанным с ними приложениям. Другой журналы по вычислительной биологии и биоинформатике также регулярно публикуют работы по информатике биоизображений. Действие Европейского союза по затратам под названием NEUBIAS (сеть европейских аналитиков по биоизображениям) с 2017 года организует ежегодные конференции, а также учебные школы и таггатоны для аналитиков по биоизображениям.
Программного обеспечения
Существует несколько пакетов, которые делают методы информатики биоизображений доступными через графический интерфейс пользователя, например ImageJ, ФИДЖИ, CellProfiler или же Ледяной. Платформы визуализации и анализа, такие как Vaa3D появились в последние годы и использовались как в крупномасштабных проектах, особенно в нейробиологии, так и в настольных приложениях.

Другие исследователи разрабатывают свои собственные методы, обычно основанные на языке программирования с хорошей поддержкой компьютерного зрения, например Python, C ++, или же MATLAB. В Махотас библиотека для Python - один из популярных примеров. Хотя, примеры разработанных исследователем методов на языках программирования с меньшей поддержкой компьютерного зрения, как р существуют (например, trackdem [14]).
Смотрите также
- Наложение фокуса Техника объединения нескольких изображений с разным фокусным расстоянием в одно.
- Скрининг с высоким содержанием
- цифровая патология
- Медицинская визуализация
внешняя ссылка
- Vaa3D: высокопроизводительная визуализация и анализ многомерных изображений
- Биоформаты Механизм ввода-вывода файлов изображений, поддерживающий десятки форматов
Рекомендации
- ^ Пэн, H; Бейтман А; Валенсия А; Рен Дж. Д. (2012). «Информатика биоизображений: новая категория в биоинформатике». Биоинформатика. 28 (8): 1057. Дои:10.1093 / биоинформатика / bts111. ЧВК 3324521. PMID 22399678.
- ^ а б Мерфи, Роберт; Веллисте, М .; Поррека, Г. (2003). «Надежные числовые функции для описания и классификации паттернов субклеточного расположения на изображениях флуоресцентного микроскопа». Журнал обработки сигналов СБИС. 35 (3): 311–321. CiteSeerX 10.1.1.186.9521. Дои:10.1023 / б: vlsi.0000003028.71666.44. S2CID 8134907.
- ^ Натткемпер, Тим; Торстен Твеллманн; Хельге Риттер; Вальтер Шуберт (2003). «Человек против машины: оценка флуоресцентных микрофотографий». Компьютеры в биологии и медицине. 33 (1): 31–43. CiteSeerX 10.1.1.324.4664. Дои:10.1016 / S0010-4825 (02) 00060-4. PMID 12485628.
- ^ Пэн Х (сентябрь 2008 г.). «Биоизображение информатики: новое направление инженерной биологии». Биоинформатика. 24 (17): 1827–36. Дои:10.1093 / биоинформатика / btn346. ЧВК 2519164. PMID 18603566.
- ^ «В поисках количественной микроскопии». Природные методы. 9 (7): 627. 2012. Дои:10.1038 / nmeth.2102. PMID 22930824.
- ^ Слава, Эстель; Джастин Ньюберг; Роберт Ф. Мерфи (2008). «Автоматическое сравнение паттернов субклеточного расположения белков между изображениями нормальных и злокачественных тканей». Биомедицинская визуализация: от нано к макро, 2008. ISBI 2008. 5-й международный симпозиум IEEE по.
- ^ Шариф, Абид; Джошуа Кангас; Луис Педро Коэльо; Шеннон Куинн; Роберт Ф. Мерфи (2010). «Автоматический анализ изображений для просмотра и анализа высокого содержания». Журнал биомолекулярного скрининга. 15 (7): 726–734. Дои:10.1177/1087057110370894. PMID 20488979.
- ^ Коэльо, Луис Педро; Абид Шариф; Роберт Ф. Мерфи (2009). «Ядерная сегментация в изображениях клеток микроскопа: сегментированный вручную набор данных и сравнение алгоритмов». Биомедицинская визуализация: от нано к макро, 2009. ISBI'09. Международный симпозиум IEEE по. IEEE. Дои:10.1109 / ISBI.2009.5193098. ЧВК 2901896.
- ^ Long, Fuhui; Peng, H .; Лю, X .; Kim, S .; Майерс, E.W (сентябрь 2009 г.). «Цифровой трехмерный атлас C. elegans и его применение для анализа отдельных клеток». Природные методы. 6 (9): 667–672. Дои:10.1038 / nmeth.1366. ЧВК 2882208. PMID 19684595.
- ^ Цюй, Лей; Long, F .; Лю, X .; Kim, S .; Myers, E.W .; Пэн, Х. (2011). «Одновременное распознавание и сегментация клеток: применение в C. elegans». Биоинформатика. 27 (20): 2895–2902. Дои:10.1093 / биоинформатика / btr480. ЧВК 3187651. PMID 21849395.
- ^ Дюфур, Александр; Василий Шинин; Шахрагим Таджбахш; Нэнси Гильен-Агион; JC. Оливо-Марин; Кристоф Циммер (2005). «Сегментирование и отслеживание флуоресцентных клеток в динамической трехмерной микроскопии со связанными активными поверхностями» (PDF). Обработка изображений, Транзакции IEEE на 14, вып. 9. С. 1396–1410. Дои:10.1109 / TIP.2005.852790. Архивировано из оригинал (PDF) на 2014-03-02..
- ^ Пэн, Ханьчуань; Chung, P .; Long, F .; Qu, L .; Jenett, A .; Семена, А .; Myers, E.W .; Симпсон, Дж. Х (2011). "BrainAligner: 3D-атласы регистрации мозга дрозофилы". Природные методы. 8 (6): 493–498. Дои:10.1038 / nmeth.1602. ЧВК 3104101. PMID 21532582.
- ^ «Ежегодное собрание по биоизображению информатики».
- ^ Бруйнинг, Марджолейн; Visser, Marco D .; Hallmann, Caspar A .; Йонгеянс, Элке; Голдинг, Ник (2018). "trackdem: автоматическое отслеживание частиц для получения подсчета населения и распределения размеров из видео в r". Методы в экологии и эволюции. 9 (4): 965–973. Дои:10.1111 / 2041-210X.12975. ISSN 2041–210X.
