Эксперимент с голубой бутылкой - Blue bottle experiment
В эксперимент с голубой бутылкой меняет цвет редокс химическая реакция. Водный раствор, содержащий глюкоза, гидроксид натрия, метиленовый синий готовится в закрытой бутылке с воздухом. Стоя, самопроизвольно отворачивается от синий к бесцветный. Однако встряхивание бутылки приводит к тому, что раствор снова быстро становится синим. При дальнейшем встряхивании этот цикл смены цвета можно повторять много раз.[1] Этот эксперимент представляет собой классическую демонстрацию химии, которую можно использовать на лабораторных курсах в качестве общего химического эксперимента для изучения химическая кинетика и механизм реакции.[2] Реакция также работает с другими восстановители помимо глюкозы[3] и другие индикатор окислительно-восстановительного потенциала красители помимо метиленового синего.[4]
Реакции
История и общая концепция
Механизм эксперимента с голубой бутылкой требует понимания ставки и механизмы сложных взаимодействующих химических реакций. В сложных химических реакциях отдельные субреакции могут протекать одновременно, но со значительно разной скоростью. На них, в свою очередь, может повлиять реагент. концентрация и температура. В большинстве случаев общая скорость реакции определяется самой быстрой однокомпонентной реакцией. Однако, когда в некоторых процессах образуются промежуточные молекулы, которые затем вступают в реакцию в других процессах с образованием конечного продукта, скорость общей реакции определяется скоростью самой медленной реакции. В таких обстоятельствах промежуточные продукты обычно находятся в устойчивом состоянии при низких концентрациях, поскольку они обладают высокой реакционной способностью.[7] Состояние равновесия требует, чтобы все прямые и обратные реакции происходили с одинаковой скоростью.[8] Таким образом, общая чистая реакция определяется суммой всех этапов механизма, скорость которых зависит от концентрации и температуры. Эксперимент с голубой бутылкой иллюстрирует этот принцип взаимодействия реакций с разной скоростью.[4]
Для эксперимента с голубой бутылкой требуется всего три реагента: гидроксид калия решение, декстроза раствор и разбавить метиленовый синий решение. Эти реагенты добавляются в колбу, перемешиваются и колбу закрывают пробкой. Первоначальный цвет раствора синий, но после непродолжительного отстаивания он самопроизвольно становится бесцветным, поскольку раствор щелочной декстрозы восстанавливает метиленовый синий до бесцветного. лейко-метиленовый синий. При встряхивании колбы в растворе растворяется кислород, присутствующий в воздухе над головой. окислять лейко-метиленовый синий снова вернулся в свою цветную форму.[9] Другой вариант использует метиленовый синий в воде, глюкоза, и каустическая сода (NaOH ).[10]
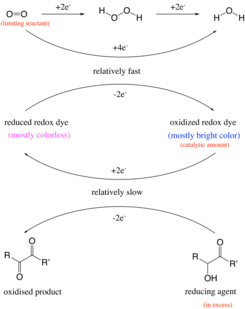
Раньше считалось, что реакция происходит за счет окисления альдегид группа в карбоновая кислота под щелочной условия. Например, глюкоза окисляется до глюконат от кислород.[11] Однако эксперимент также работает с такими соединениями, как витамин C и бензоин, не содержащие альдегидной группы.[4] Таким образом, реакция фактически представляет собой окисление ацилоин или связанные α -гидрокси -карбонил группа, которая является структурной особенностью глюкозы, до 1,2 дикетон.[12] Восстановленный окислительно-восстановительный краситель (бесцветное состояние) образуется из окисленного окислительно-восстановительного красителя (синий). Изменение цвета, которое происходит в эксперименте с голубой бутылкой, имеет черты часы реакция, при котором видимое изменение концентрации одного или нескольких реагентов внезапно происходит после исчерпания ограничивающего реагента. Например, ограничивающий реагент, кислород, потребляется другим реагентом, бензоином, с помощью сафранина в качестве катализатора. Когда ограниченное количество кислорода израсходовано, катализатор не может изменить форму, и в результате раствор меняет цвет.

Классическая версия
Водный раствор в классической реакции содержит глюкоза, гидроксид натрия и метиленовый синий.[13] На первом этапе ацилоин глюкозы образуется. Следующий шаг - это окислительно-восстановительная реакция ацилоина с метиленовым синим, в котором глюкоза окисляется до дикетон в щелочном растворе[6] а метиленовый синий восстанавливается до бесцветного лейкометиленового синего. Если имеется достаточно кислорода (например, после встряхивания бутылки), лейкометиленовый синий немедленно повторно окисляется до метиленового синего, и синий цвет раствора сохраняется. Однако, когда раствор оставляют в покое, растворенный кислород постепенно расходуется, и в точке, где он полностью истощен, восстановление глюкозы метиленового синего протекает беспрепятственно, и цвет раствора быстро исчезает.[14] Реакция Первый заказ в глюкозе, метиленовом синем и гидроксид-ионе и нулевого порядка по кислороду. Процесс можно описать как реакция псевдопервого порядка, и может использоваться для иллюстрации изменения концентраций реагентов в ходе реакции, когда раствор снова меняется с синего на бесцветный.[1]
Конечные продукты окисления глюкозы, помимо глюконата натрия, были идентифицированы как D-арабино-гексос-2-улоза (глюкозон), анион D-арабиноната после отщепления формиат-аниона и арабиноновая кислота.[12]
Зеленая версия
Веллман и Ноубл предложили новую формулировку эксперимента с голубой бутылкой, в котором витамин С служит восстановителем вместо глюкозы; метиленовый синий и кислород все еще используются.[15] Медь добавляется в качестве катализатора повторного окисления лейкометиленовый синий к метиленовый синий. Эти модификации дают эксперимент, в котором образуется меньшее количество отходов, которые менее агрессивны и легче нейтрализовать, и поэтому являются примером зеленая химия модификация.[16]
Быстрая версия
Чен[17] Автоокисление бензоина провело аналогичный эксперимент в отношении классической и зеленой версий. Было обнаружено, что светофор и исчезающая валентинка эксперименты могут быть успешными независимо от того, добавлен ли сахар. Один вариант более быстрый: количество циклов смены цвета не длится так долго, как классическая и зеленая версии, потому что реагенты присутствуют в меньших количествах; Кроме того, восстановителем для этого эксперимента является бензоин, который добавляется, чтобы помочь увеличить количество циклов в растворе. Кроме того, период использования в этом эксперименте довольно короткий. Хотя эксперимент готовится в течение ночи, восстанавливающий агент может быть добавлен в любое время, чтобы можно было больше наблюдать за раствором.[18]
Ферментативная версия
Чжан, Цитков и Гесс из Колумбийского университета[19]предложил ферментативный вариант «эксперимента с голубой бутылкой». Они назвали это «экспериментом с зеленой бутылкой», поскольку система окрашена в зеленый цвет, а реагенты более безопасны, чем классические подходы. Эксперимент проводится в прозрачном стеклянном флаконе, содержащем два общих фермента (глюкозооксидаза и пероксидаза хрена ), глюкоза и 2,2'-азино-бис (3-этилбензотиазолин-6-сульфоновая кислота) (сокращенно ABTS) в буфере PBS. Тонкий слой масла используется для защиты раствора от воздуха. Раствор сначала становится зеленым, а затем становится бесцветным по мере истощения растворенного кислорода. Встряхивание раствора вводит свежий кислород и снова окрашивает раствор в зеленый цвет до тех пор, пока кислород не будет израсходован.
Эта версия основана на трех ферментативных реакциях. Во-первых, глюкозооксидаза катализирует окисление глюкозы в присутствии кислорода и производит перекись водорода. Во-вторых, пероксидаза хрена использует перекись водорода для окисления ABTS до его катион-радикальной формы, ABTS.+•. Когда растворенный кислород расходуется в растворе, происходит третья реакция: глюкозооксидаза катализирует восстановление ABTS.+• вернуться к ABTS при наличии глюкозы. Эта система также может образовывать красивые узоры, возникающие в результате вызванной реакцией конвекции Рэлея-Бенара.[20]
Вариация красителей
Химические реакции и механизм в эксперименте с голубой бутылкой основаны на окислении сахара с помощью воздуха и окислительно-восстановительного красителя в основном растворе. Сообщалось о других вариантах этой реакции, в которых используются четыре семейства редокс красители: тиазины, оксазины, азины, и индиго кармин сообщалось, что все работают с глюкоза и каустическая сода.[18]
Химический светофор эксперимент
Химический светофор - это окислительно-восстановительная реакция с изменением цвета, связанная с эксперимент с голубой бутылкой. Одна из ранних формул состоит из глюкоза, гидроксид натрия, индиго кармин, и воды. Другая формула состоит из индиго кармин, краситель, аскорбиновая кислота (Витамин C ), бикарбонат натрия, хлорид натрия, сульфат меди (II), гидроксид натрия и воды.[16] Тем самым, химические отходы и уровень разъедающий химикатов снижается. Количество растворенных в эксперименте твердых химикатов можно было уменьшить с 60 до 6 граммов. И pH можно снизить с 13 до 3, что легче нейтрализовать pH до 7, добавив пищевая сода перед утилизацией.[15] Кроме того, это более безопасно, и реакции также происходят быстрее и их легче выполнять.
Сначала все химические вещества складываются вместе, и цвет становится желтым. После встряхивания цвет становится зеленым, а затем меняется на красный, если его не трогать. При дальнейшем наблюдении цвет снова становится желтым, поэтому раствор называют химическим светофором. Эта реакция может повторяться много раз, но требует дополнительных кислород или индиго кармин.

Эта реакция происходит путем окисления и восстановления раствора, в котором щелочной раствор глюкозы действует как Восстановитель. Раствор глюкозы добавляют к раствору, содержащему индикатор (краситель индигокармин) происходят изменения цвета. Эта реакция также известна как химические часы эксперимент, потому что концентрации продуктов и реагентов изменились за определенный период.[21] Когда раствор встряхивают, кислород растворяется в растворе и окисляет индигокармин. Раствор становится красным, если растворяется небольшое количество кислорода, и зеленым, если весь индигокармин окисляется.[22] Раствор вернется к первоначальному желтому цвету, когда концентрация кислорода упадет.[23]
Замедленная съемка химической реакции светофора

Химическая реакция светофора (желтый)

Химическая реакция светофора (красный)

Химическая реакция светофора (зеленый)
Исчезающий Валентина эксперимент
Эксперимент с исчезающим валентинкой - еще одна химическая реакция, эксперимент с голубой бутылкой. Эта реакция происходит, когда вода, глюкоза, гидроксид натрия, и Ресазурин смешивается в колбе. Когда раствор встряхивается, он меняет цвет с голубого на красноватый. Раствор снова становится светло-голубым, если его оставить на некоторое время. Эта реакция может повторяться несколько раз.[24]
После смешивания всех компонентов встряхните флакон, и цвет станет красным или розовым, в зависимости от количества резазурина в растворе. Больше резазурина приведет к тому, что раствору потребуется больше времени, чтобы вернуть цвет и интенсивность красного цвета.

Химическая реакция стимулирует глюкозу превращать резазурин в резоруфин. Затем он снова будет восстановлен до бесцветного соединения, называемого дигидрорезоруфином. Когда дигидрорезоруфин встряхивают, он снова окисляется до резоруфина. Это связано с тем, что при встряхивании кислород в бутылке превращается в окисленный дигидрорезоруфин обратно в резоруфин.[25]
раствор превращается из бесцветного в красный
уменьшенный цвет эксперимента
окисленный цвет опыта
Другие
- Gatorade
Эриоглауцин, пищевой краситель и окислительно-восстановительный краситель, оказался эффективным заменителем метиленового синего в эксперименте с синей бутылкой. Поскольку некоторые конфеты и напитки, такие как Gatorade содержат краситель и редуцирующий сахар, нужно добавить только гидроксид натрия, чтобы превратить эти пищевые продукты в раствор для синей бутылки.[26]
- Фиолетовая колба
Тионин может использоваться в зеленой версии эксперимента в сочетании с катализатором медь / железо для создания фиолетовой колбы.[27]
Формирование паттерна
Формирование паттерна это когда раствор, содержащий NaOH, глюкозу и краситель, наливается в чашка Петри это открыто для атмосферы.[28] Это приведет к тому, что раствор со временем изменит свою структуру. Структуры возникают в результате молекулярного транспорта через распространение и химическая кинетика. Узоры, сформированные в чашке Петри, можно описать как мозаичный узор; паутина, динамическая спираль, ветвление и линии, соединяющиеся друг с другом.[29]
Изменения в формировании рисунка неоднородны и могут зависеть от нескольких факторов. Различные типы красителей в растворе дадут одинаковый узор из-за образования связи, и динамика останется той же, потому что раствор имеет тот же цвет, что и краситель. Различное количество красителя может привести к изменению плотности раствора, что приводит к изменению конвективного движения. Различное количество красителя может привести к разному количеству обычных клеток, которые также образованы разным количеством глюкозы и окисленного продукта. Это может привести к интересным пространственным явлениям. Время также может повлиять на формирование паттерна. Со временем один узор постепенно исчез. Спирали и ветви начали исчезать и в конце концов исчезли полностью. Эти факты указывают на то, что кислород влияет на химическую реакцию, и это играет фундаментальную роль в формировании рисунка. Формирование рисунка может также происходить из-за химической конвективной нестабильности. Это означает, что материальный обмен происходит через поверхность раздела воздух-реакционная смесь из-за колебаний молекулярной природы химических систем.[30] Температура может повлиять на формирование рисунка.[6] Более низкая температура сформировала более четкую картину, чем высокая температура. Форма чашки Петри также способствовала формированию рисунка.[6]
Формирование узора из эксперимента с голубой бутылкой в покадровой ванне с ледяной водой

Формирование узора в результате эксперимента с голубой бутылкой в ледяной ванне
Формирование узора из эксперимента с голубой бутылкой в покадровой ванне с холодной водой

Формирование узора из эксперимента с голубой бутылкой в холодной воде
Формирование рисунка в эксперименте с голубой бутылкой при покадровой съемке при комнатной температуре

Формирование узора в эксперименте с голубой бутылкой при комнатной температуре
Формирование узора из эксперимента с голубой бутылкой в покадровой ванне с теплой водой

Формирование узора из эксперимента с голубой бутылкой в теплой водяной бане
Построение схемы экспериментов на химических светофорах в контейнерах разной формы Покадровая съемка

Формирование картины эксперимента химического светофора в контейнерах разной формы
Группа исследователей Университет Глазго по имени Понс, Батист и Пчелы пришли к небольшому выводу о формировании паттерна в системе метиленовый синий-глюкоза. Они пришли к убедительному утверждению, что подобный узор может быть сформирован в контейнере с доступным кислородом. Этот результирующий эффект поверхностного натяжения не требуется для возникновения нестабильности. В крышке контейнера также были обнаружены небольшие отверстия, недоступные для кислорода, в результате чего количество кислорода стало тонким, синим и меньшим. В одном из их экспериментов были исследованы длина и временная шкала структуры из-за различий в вязкости и глубине жидкости. Эксперимент показывает, что длина волны формируется, поскольку узор начинает формироваться быстро. Тогда длина волны или структура могут сохраняться или колебаться в течение некоторого времени.[31]
использованная литература
- ^ а б Бейкер, Колин (1 ноября 2006 г.). «Реакция« синей бутылки »». Образование в области химии. Vol. 43 нет. 6. Королевское химическое общество. п. 155.
- ^ Engerer, Стивен С .; Кук, А. Гилберт (1999). «Реакция синей бутылки как общий химический эксперимент по механизмам реакции». Журнал химического образования. 76 (11): 1519–1520. Дои:10.1021 / ed076p1519.
- ^ Кук, А. Гилберт; Толливер, Рэнди М .; Уильямс, Джанель Э. (1994). «Повторение эксперимента с голубой бутылкой: насколько синяя? Насколько сладкая?». Журнал химического образования. 71 (2): 160. Bibcode:1994JChEd..71..160C. Дои:10.1021 / ed071p160.
- ^ а б c Лимпанупарб, Тавитам; Арикул, Черпранг; Монтриват, Пунчали; Райчакит, Уравади (2017). «Эксперимент с голубой бутылкой: изучение химии без знания химических веществ». Журнал химического образования. 94 (6): 730. Bibcode:2017JChEd..94..730L. Дои:10.1021 / acs.jchemed.6b00844.
- ^ Лимпанупарб, Тавитам; Роонгруангсри, Пакпонг; Арикул, Черпранг (2017). «Исследование методом DFT эксперимента с голубой бутылкой: E ∘ полуэлементный анализ автоокисления, катализируемого окислительно-восстановительными индикаторами». Королевское общество открытой науки. 4 (11): 170708. Дои:10.1098 / rsos.170708. ЧВК 5717635. PMID 29291061.
- ^ а б c d Лимпанупарб, Тавитам; Ручавапол, Чаттарин; Паквилайкиат, Пух; Kaewpichit, Chatchapong (2019). «Химические закономерности в самоокислении, катализируемые редокс-красителями» (PDF). СКУД Омега. 4 (4): 7891–7894. Дои:10.1021 / acsomega.9b00802.
- ^ Кэмпбелл, Дж. А. (1963). «Кинетика рано и часто». Журнал химического образования. 40 (11): 578–583. Дои:10.1021 / ed040p578.
- ^ Микки, Чарльз Д. (1980). «Химическая кинетика: скорость реакции». Журнал химического образования. 57 (9): 659. Дои:10.1021 / ed057p659.
- ^ Даттон, Ф. Б. (1960). «Метиленовый синий - восстановление и окисление». Журнал химического образования. 37 (12): A799. Дои:10.1021 / ed037pA799.1.
- ^ Лимпанупарб, Тавитам; Ручавапол, Чаттарин; Sathainthammanee, Dulyarat (2019). «Повторение часовой реакции: катализированные окислительно-восстановительные реакции, разрушающие субстрат». Журнал химического образования. 96 (4): 812−818. Дои:10.1021 / acs.jchemed.8b00547.
- ^ Олах, Герберт В. Роски (2007). Захватывающие химические эксперименты (1-е изд.). Вайнхайм: Wiley-VCH. ISBN 978-3-527-31865-0.
- ^ а б Андерсон, Лоуренс; Витткопп, Стейси М .; Художник Кристофер Дж .; Лигель, Джессика Дж .; Шрайнер, Родни; Белл, Джерри А .; Шахашири, Бассам З. (2012). «Что происходит, когда отбеливается синяя бутылка: исследование окисления глюкозы воздухом, катализируемого метиленовым синим». Журнал химического образования. 89 (11): 1425–1431. Дои:10.1021 / ed200511d.
- ^ Шахашири, Бассам З. (1985). Химические демонстрации ([Nachdr.] Ред.). Мэдисон, Висконсин: Univ. из Wisconsin Press. С. 142–143. ISBN 978-0-299-10130-5.
- ^ Саммерлин, Ли Р. (1988). Химические демонстрации (2-е изд.). Вашингтон, округ Колумбия: American Chem. Общество. п. 127. ISBN 9780841214811.
- ^ а б Wellman, Whitney E .; Благородный, Марк Э .; Хили, Том (2003). «Озеленение синей бутылки». Журнал химического образования. 80 (5): 537. Bibcode:2003JChEd..80..537W. Дои:10.1021 / ed080p537.
- ^ а б Раджакит, Уравади; Лимпанупарб, Тавитхам (2016). «Озеленение светофора: окисление воздуха витамином С, катализируемое индикаторами». Журнал химического образования. 93 (8): 1486–1489. Bibcode:2016JChEd..93.1486R. Дои:10.1021 / acs.jchemed.5b00630.
- ^ Чен, Филип С. (1970). «Автоокисление бензоина». Журнал химического образования. 47 (1): A67. Bibcode:1970JChEd..47 ... 67C. Дои:10.1021 / ed047pA67.1.
- ^ а б Раджакит, Уравади; Лимпанупарб, Тавитхам (2016). «Быстрый эксперимент с синей бутылкой: самоокисление бензоина, катализируемое индикаторами окислительно-восстановительного потенциала». Журнал химического образования. 93 (8): 1490–1494. Bibcode:2016JChEd..93.1490R. Дои:10.1021 / acs.jchemed.6b00018.
- ^ Чжан, Ифэй; Цитков, Станислав; Гесс, Генри (2018). «Сложная динамика в двухферментной реакционной сети с конкуренцией субстрата». Природный катализ. 1 (4): 276–281. Дои:10.1038 / s41929-018-0053-1.
- ^ Фильм можно найти здесь: Эксперимент с зеленой бутылкой
- ^ Манн, Джорджия. «Неделя химии: химический светофор». Получено 17 июля 2019.
- ^ «Химический светофор». MEL Science. Получено 17 июля 2019.
- ^ Альтотт, апрель. "Светофор". Получено 17 июля 2019.
- ^ "Демонстрация химии исчезающего Валентина". Получено 13 ноября 2015.[постоянная мертвая ссылка ]
- ^ "Исчезающий Валентин" (PDF). Архивировано из оригинал (PDF) 16 февраля 2016 г.. Получено 13 ноября 2015.
- ^ Кэмпбелл, Дин Дж .; Staiger, Felicia A .; Петерсон, Джошуа П. (2015). "Вариации демонстрации" синей бутылки "с использованием продуктов питания, содержащих FD&C Blue # 1". Журнал химического образования. 92 (10): 1684–1686. Дои:10.1021 / acs.jchemed.5b00190.
- ^ Вайнберг, Ричард Б. (2019). «Пурпурный флакон: новая формулировка реакции синего флакона». Журнал химического образования. Дои:10.1021 / acs.jchemed.9b00627.
- ^ Адамчикова, Любица; Севчик, Питер (1998-12-01). «Эксперимент с голубой бутылкой - простая демонстрация самоорганизации». Журнал химического образования. 75 (12): 1580. Дои:10.1021 / ed075p1580. ISSN 0021-9584.
- ^ Pons, A.J .; Sague´s, F .; Пчелы, М. А .; Соренсен, П. Граэ (2000). «Формирование картины в системе метилен-синий-глюкоза». Журнал физической химии B. 104 (10): 2251–2259. Дои:10.1021 / jp9935788.
- ^ Adamčíková, L`; Шевчик, П. (1997). «Эксперимент с голубой бутылкой и формирование узора в этой системе». З. Натурфорш. 52 (8–9): 650–654. Дои:10.1515 / zna-1997-8-918.
- ^ Pons, A.J .; Batiste, O .; Пчелы, М.А. (2008). «Нелинейная хемоконвекция в системе метиленовый синий – глюкоза: двумерные мелкие слои». Физический обзор E. 78 (1): 016316. Дои:10.1103 / PhysRevE.78.016316. HDL:2445/18933. PMID 18764059.