Капролактон - Caprolactone - Wikipedia
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название IUPAC 2-оксепанон | |||
| Систематическое название ИЮПАК Гексано-6-лактон | |||
| Другие имена Капролактон ε-капролактон Эпсилон-капролактон 6-гексанолактон Гексан-6-олид 1-окса-2-оксоциклогептан | |||
| Идентификаторы | |||
3D модель (JSmol ) | |||
| ЧЭБИ | |||
| ЧЭМБЛ | |||
| ChemSpider | |||
| ECHA InfoCard | 100.007.217 | ||
| КЕГГ | |||
PubChem CID | |||
| UNII | |||
| |||
| |||
| Характеристики | |||
| C6ЧАС10О2 | |||
| Молярная масса | 114,14 г / моль | ||
| Плотность | 1,030 г / см3 | ||
| Температура плавления | -1 ° С (30 ° F, 272 К) | ||
| Точка кипения | 241 ° С (466 ° F, 514 К)[2] | ||
| Смешиваемый [1] | |||
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
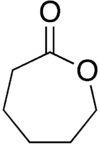
ε-капролактон или просто капролактон это лактон (циклический сложный эфир ), обладающий семичленным кольцом. Его название происходит от капроновая кислота. Эта бесцветная жидкость смешивается с большинством органических растворителей и водой. Когда-то он производился в больших масштабах как предшественник капролактам.[3]
Производство и использование
Капролактон получают промышленным способом Окисление Байера-Виллигера из циклогексанон с перуксусная кислота.
Капролактон - это мономер, используемый в производстве узкоспециализированных полимеры. Полимеризация с раскрытием кольца, например, дает поликапролактон.[3] Другой полимер полиглекапрон, используется в качестве шовного материала в хирургии.[4]
Реакции
Хотя капролактон больше не был экономичным, его когда-то производили как предшественник капролактама. Капролактон обрабатывают аммиаком при повышенных температурах, чтобы получить лактам:
- (CH2)5CO2 + NH3 → (CH2)5С (О) NH + H2О
Карбонилирование капролактона после гидролиза дает пимелиновая кислота. Лактоновое кольцо легко открывается нуклеофилами, включая спирты и воду, с образованием полилактонов и, в конечном итоге, 6-гидроксиадипиновой кислоты.
Родственные соединения
Известно несколько других капролактонов. Эти изомеры включают α-, β-, γ- и δ-капролактоны. Все хиральны. (р) -γ-капролактон входит в состав цветочные ароматы и ароматов некоторых фруктов и овощей,[5] а также производится Жук-хапра как феромон.[6] δ-капролактон содержится в нагретом молочном жире.[7]
Эфир капролактона используется в качестве связующего для AP /AN /Al ракетное топливо HTCE: эфир капролактона с концевыми гидроксильными группами [8]
Безопасность
Капролактон быстро гидролизуется, и образующаяся гидроксикарбоновая кислота проявляет неисключительную токсичность, как и другие гидроксикарбоновые кислоты.[9] Известно, что он вызывает сильное раздражение глаз. Воздействие может привести к травме роговицы.[1]
Рекомендации
- ^ а б «Отчет об первоначальной оценке СВДС ε-капролактона» (PDF). ОЭСР. Архивировано из оригинал (PDF) на 2011-08-15. Получено 2017-10-12.
- ^ «Паспорт продукта Capa Monomer» (PDF). Perstorp. 2015-02-27. Архивировано из оригинал (PDF) на 2017-02-02. Получено 2017-10-11.
- ^ а б Кёпник, Хорст; Шмидт, Манфред; Брюггинг, Вильгельм; Рютер, Йорн; Каминский, Уолтер (2002). «Полиэфиры». Энциклопедия промышленной химии Ульмана (6-е изд.). Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a21_227.
- ^ «Сводный отчет по сополимеру гликолида Е-капролактона». CureHunter. Получено 2017-10-11.
- ^ Мосандл, А .; Гюнтер, К. (1989). «Стереоизомерные ароматические соединения: структура и свойства гамма-лактонных энантиомеров». Журнал сельскохозяйственной и пищевой химии. 37: 413–418. Дои:10.1021 / jf00086a031.
- ^ Нуньес, М. Тереза; Мартин, Виктор С. (1990). «Эффективное окисление фенильных групп до карбоновых кислот тетраоксидом рутения. Простой синтез (R) -гамма-капролактона, феромона Trogoderma granarium". Журнал органической химии. 55 (6): 1928–1932. Дои:10.1021 / jo00293a044.
- ^ Парламент, Томас Х .; Nawar, Wassef W .; Фагерсон, Ирвинг С. (1965). «Дельта-капролактон в подогретом молочном жире». Журнал молочной науки. 48 (5): 615–616. Дои:10.3168 / jds.S0022-0302 (65) 88298-4.
- ^ HTCE
- ^ Мильтенбергер, Карлхайнц (2002). «Гидроксикарбоновые кислоты алифатические». Энциклопедия промышленной химии Ульмана (6-е изд.). Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a13_507.