Соотношение Клаузиуса – Клапейрона - Clausius–Clapeyron relation
В Соотношение Клаузиуса – Клапейрона, названный в честь Рудольф Клаузиус[1] и Бенуа Поль Эмиль Клапейрон,[2] это способ охарактеризовать прерывистый фаза перехода между двумя фазы материи одного компонента.
Определение
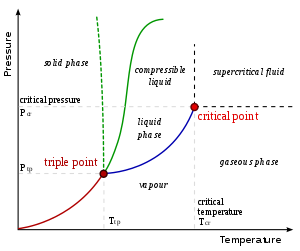
На давление –температура (P – T) диаграмма, линия, разделяющая две фазы, известна как кривая сосуществования. Соотношение Клаузиуса – Клапейрона дает склон из касательные к этой кривой. Математически,
куда - наклон касательной к кривой сосуществования в любой точке, это конкретный скрытая теплота, это температура, это удельный объем изменение фазового перехода, и это удельная энтропия изменение фазового перехода.
Производные
Вывод из постулата государства
С использованием государственный постулат, возьми удельная энтропия для однородный субстанция быть функцией удельный объем и температура .[3]:508
Соотношение Клаузиуса – Клапейрона характеризует поведение закрытая система во время изменение фазы, во время которого температура и давление постоянны по определению. Следовательно,[3]:508
Используя соответствующие Отношение Максвелла дает[3]:508
куда это давление. Поскольку давление и температура постоянны, по определению производная давления по температуре не изменяется.[4][5]:57, 62 & 671 Следовательно частная производная удельной энтропии может быть изменено на полная производная
а полная производная давления по температуре может быть исключено когда интеграция с начальной фазы к финальной фазе ,[3]:508 чтобы получить
куда и - соответственно изменение удельной энтропии и удельного объема. Учитывая, что изменение фазы - это внутреннее обратимый процесс, и что наша система закрыта, первый закон термодинамики держит
куда это внутренняя энергия системы. Учитывая постоянное давление и температуру (во время фазового перехода) и определение удельная энтальпия , мы получаем
При постоянном давлении и температуре (во время фазового перехода) получаем[3]:508
Подставляя определение удельная скрытая теплота дает
Подставляя этот результат в приведенную выше производную давления (), мы получаем[3]:508[6]
Этот результат (также известный как Уравнение Клапейрона) приравнивает наклон касательной к кривая сосуществования в любой заданной точке кривой к функции удельной скрытой теплоты , температура , а изменение удельного объема .
Вывод из соотношения Гиббса – Дюгема.
Предположим две фазы, и , находятся в контакте и находятся в равновесии друг с другом. Их химические потенциалы связаны соотношением
Кроме того, вдоль кривая сосуществования,
Поэтому можно использовать Гиббс-Дюгем связь
(куда это конкретный энтропия, это удельный объем, и это молярная масса ) чтобы получить
Перестановка дает
из которого вывод уравнения Клапейрона продолжается как в предыдущий раздел.
Приближение идеального газа при низких температурах
Когда фаза перехода вещества находится между газовая фаза и конденсированная фаза (жидкость или же твердый ), и происходит при температурах много ниже критическая температура этого вещества, удельный объем газовой фазы значительно превосходит конденсированную фазу . Следовательно, можно приблизить
на низком уровне температуры. Если давление также низкий, газ может быть аппроксимирован закон идеального газа, так что
куда давление, это удельная газовая постоянная, и это температура. Подставляя в уравнение Клапейрона
мы можем получить Уравнение Клаузиуса – Клапейрона[3]:509
для низких температур и давлений,[3]:509 куда это удельная скрытая теплота вещества.
Позволять и быть любыми двумя точками вдоль кривая сосуществования между двумя фазами и . В целом, колеблется между любыми двумя такими точками в зависимости от температуры. Но если постоянно,
Эти последние уравнения полезны, потому что они связывают равновесие или же давление насыщенного пара и температура к скрытой теплоте фазового перехода, без требующие данных конкретного объема.
Приложения
Химия и химическая инженерия
Для переходов между газом и конденсированной фазой с описанными выше приближениями выражение можно переписать как
куда - константа для перехода жидкость-газ, это удельная скрытая теплота (или же удельная энтальпия ) из испарение; для перехода твердое тело - газ, это удельная скрытая теплота сублимация. Если скрытая теплота известна, то знание одной точки на кривая сосуществования определяет остальную часть кривой. И наоборот, связь между и линейно, и поэтому линейная регрессия используется для оценки скрытой теплоты.
Метеорология и климатология
Атмосферный водяной пар управляет многими важными метеорологический явления (особенно осадки ), мотивируя интерес к ее динамика. Уравнение Клаузиуса – Клапейрона для водяного пара в типичных атмосферных условиях (около стандартная температура и давление ) является
куда:
- является давление насыщенного пара
- является температура
- это удельная скрытая теплота из испарение воды
- это газовая постоянная водяного пара
Температурная зависимость скрытой теплоты (и давления насыщенного пара ) нельзя пренебрегать в этом приложении. К счастью, Формула Августа – Роша – Магнуса дает очень хорошее приближение:
В приведенном выше выражении в гПа и в Цельсия, тогда как везде на этой странице является абсолютной температурой (например, в Кельвинах) (иногда ее также называют Магнус или же Магнус-Тетенс приблизительно, хотя эта атрибуция исторически неточна.)[10] Но см. Также это обсуждение точности различных аппроксимирующих формул для давления насыщенного пара воды.
В типичных атмосферных условиях знаменатель из показатель степени слабо зависит от (единицей измерения является Цельсий). Следовательно, уравнение Августа – Роша – Магнуса подразумевает, что давление насыщенного водяного пара изменяется примерно экспоненциально с температурой в типичных атмосферных условиях, и, следовательно, водоудерживающая способность атмосферы увеличивается примерно на 7% на каждый 1 ° C повышения температуры.[11]
Пример
Одно из применений этого уравнения - определить, произойдет ли фазовый переход в данной ситуации. Рассмотрим вопрос о том, какое давление необходимо, чтобы растопить лед при температуре ниже 0 ° C. Обратите внимание, что вода необычна тем, что ее объем при таянии отрицательный. Мы можем предположить
и подставив
- (скрытая теплота плавления для воды),
- K (абсолютная температура), и
- (изменение удельного объема от твердого к жидкому),
мы получаем
Чтобы дать грубый пример того, какое это давление, чтобы растопить лед при -7 ° C (температура кататься на коньках катки установлены на) потребует балансировки небольшого автомобиля (масса = 1000 кг[12]) на наперсток (площадь = 1 см2).
Вторая производная
Хотя соотношение Клаузиуса-Клапейрона дает наклон кривой сосуществования, оно не дает никакой информации о ее кривизне или вторая производная. Вторая производная кривой сосуществования фаз 1 и 2 определяется выражением [13]
где нижние индексы 1 и 2 обозначают разные фазы, это конкретный теплоемкость при постоянном давлении, это коэффициент теплового расширения, и это изотермическая сжимаемость.
Смотрите также
Рекомендации
- ^ Клаузиус, Р. (1850). "Ueber die bewegende Kraft der Wärme und die Gesetze, welche sich daraus für die Wärmelehre selbstableiten lassen" [О движущей силе тепла и законах, которые могут быть выведены из нее, применительно к теории тепла]. Annalen der Physik (на немецком). 155 (4): 500–524. Bibcode:1850АнП ... 155..500С. Дои:10.1002 / andp.18501550403. HDL:2027 / uc1. $ B242250.
- ^ Клапейрон, М. К. (1834). "Mémoire sur la puissance motrice de la chaleur". Политехнический журнал de l'École (На французском). 23: 153–190. ark: / 12148 / bpt6k4336791 / f157.
- ^ а б c d е ж грамм час Уорк, Кеннет (1988) [1966]. «Обобщенные термодинамические соотношения». Термодинамика (5-е изд.). Нью-Йорк, штат Нью-Йорк: McGraw-Hill, Inc. ISBN 978-0-07-068286-3.
- ^ а б Engel, Yunus A .; Болес, Майкл А. (1998) [1989]. Термодинамика - инженерный подход. Серия Макгроу-Хилл в Машиностроение (3-е изд.). Бостон, Массачусетс: Макгроу-Хилл. ISBN 978-0-07-011927-7.
- ^ Зальцман, Уильям Р. (21 августа 2001 г.). «Уравнения Клапейрона и Клаузиуса – Клапейрона». Химическая термодинамика. Университет Аризоны. Архивировано из оригинал на 2007-06-07. Получено 2007-10-11.
- ^ Мастертон, Уильям Л .; Херли, Сесиль Н. (2008). Химия: принципы и реакции (6-е изд.). Cengage Learning. п. 230. ISBN 9780495126713. Получено 3 апреля 2020.
- ^ Алдухов Олег; Эскридж, Роберт (1997-11-01), Улучшенная аппроксимация формы Магнуса давления насыщенного пара, NOAA, Дои:10.2172/548871 - Уравнение 25 предоставляет эти коэффициенты.
- ^ Алдухов Олег А .; Эскридж, Роберт Э. (1996). «Улучшенная аппроксимация формы Магнуса давления насыщенного пара». Журнал прикладной метеорологии. 35 (4): 601–9. Bibcode:1996JApMe..35..601A. Дои:10.1175 / 1520-0450 (1996) 035 <0601: IMFAOS> 2.0.CO; 2. Уравнение 21 предоставляет эти коэффициенты.
- ^ Лоуренс, М. Г. (2005). «Взаимосвязь между относительной влажностью и температурой точки росы во влажном воздухе: простое преобразование и применение» (PDF). Бюллетень Американского метеорологического общества. 86 (2): 225–233. Bibcode:2005БАМС ... 86..225л. Дои:10.1175 / БАМС-86-2-225.
- ^ IPCC, Climate Change 2007: Working Group I: The Physical Science Basis, «FAQ 3.2 Как меняются осадки?», URL http://www.ipcc.ch/publications_and_data/ar4/wg1/en/faq-3-2.html В архиве 2018-11-02 в Wayback Machine
- ^ Зорина, Яна (2000). «Масса автомобиля». Книга фактов по физике.
- ^ Крафчик, Мэтью; Санчес Веласко, Эдуардо (2014). «За пределами Клаузиуса-Клапейрона: Определение второй производной линии фазового перехода первого рода». Американский журнал физики. 82 (4): 301–305. Bibcode:2014AmJPh..82..301K. Дои:10.1119/1.4858403.
Библиография
- Яу, М.К .; Роджерс, Р.Р. (1989). Краткий курс физики облаков (3-е изд.). Баттерворт-Хайнеманн. ISBN 978-0-7506-3215-7.
- Iribarne, J.V .; Годсон, W.L. (2013). «4. Системы вода-воздух § 4.8. Уравнение Клаузиуса – Клапейрона». Атмосферная термодинамика. Springer. С. 60–. ISBN 978-94-010-2642-0.
- Каллен, Х. (1985). Термодинамика и введение в термостатистику. Вайли. ISBN 978-0-471-86256-7.


































































![{ displaystyle { begin {align} { frac { mathrm {d} ^ {2} P} { mathrm {d} T ^ {2}}} = { frac {1} {v_ {2} - v_ {1}}} left [{ frac {c_ {p2} -c_ {p1}} {T}} - 2 (v_ {2} alpha _ {2} -v_ {1} alpha _ {1 }) { frac { mathrm {d} P} { mathrm {d} T}} right] + {} { frac {1} {v_ {2} -v_ {1}}} left [(v_ {2} kappa _ {T2} -v_ {1} kappa _ {T1}) left ({ frac { mathrm {d} P} { mathrm {d} T}} right) ^ {2} right], end {выравнивается}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6b1f9040b083bf122ad453b25f90fd71f4504034)


