Противоион - Counterion

А противоион (произносится как два слова, то есть «счетчик», «ион», а иногда записывается как два слова) - это ион который сопровождает ионные частицы, чтобы поддерживать электрическую нейтральность. В поваренной соли (NaCl) ион натрия (положительно заряженный) является противоионом для иона хлора (отрицательно заряжен) и наоборот.
Противоион чаще будет называться анион или катион в зависимости от того, заряжен он положительно или отрицательно. Таким образом, противоион аниону будет катионом, и наоборот.
Межфазная химия
Противоионы - это подвижные ионы в ионообменных полимерах и коллоиды.[1] Ионообменные смолы представляют собой полимеры с чистым отрицательным или положительным зарядом. Катионообменные смолы состоят из анионного полимера с противокатионами, обычно Na+ (натрий). Смола имеет более высокое сродство к сильно заряженным противокатионам, например, к Ca2+ (кальций) в случае умягчение воды. Соответственно, анионообменные смолы обычно предоставляются в форме хлорида. Cl−, который представляет собой высокомобильный кутеранион.
Противоионы используются в фазовый катализ. В типичном применении липофильный противокатион, такой как бензалконий солюбилизирует реагенты в органических растворителях.
Химия раствора
Растворимость солей в органических растворителях зависит как от катиона, так и от аниона. Растворимость катионов в органических растворителях может быть повышена, если анион является липофильным. Точно так же растворимость анионов в органических растворителях увеличивается за счет липофильных катионов. Наиболее распространенными липофильными катионами являются катионы четвертичного аммония, называемые «четвертичными солями».
- Липофильные противоанионы
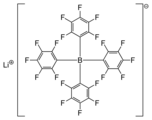
Литий тетракис (пентафторфенил) борат представляет собой литиевую соль высоколипофильного тетраарилборат-аниона, часто называемого слабо координирующий анион.[2]

Тетрафенилборат менее липофильно, чем перфторированное производное, но широко используется в качестве осаждающего агента.
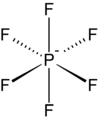
Гексафторфосфат это общий слабо координирующий анион.
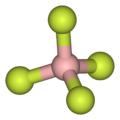
Как проиллюстрировано небольшой контранион тетрафторборат (BF−
4) липофильные катионы обычно симметричны и однозарядны.
- Липофильные противокатионы

Бис (трифенилфосфин) иминия хлорид представляет собой хлоридную соль объемного липофильного катиона фосфония [Ph3ПНФФ3]+.

Тетрафенилфосфония хлорид (C6ЧАС5)4PCl, сокращенно Ph4PCl или PPh4Cl представляет собой хлорид симметричного катиона фосфония, который часто используется в металлоорганическая химия. Также хорошо известна арсониевая соль.
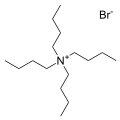
Бромидная соль тетрабутиламмоний, один из самых распространенных противокатионов. Известно много аналогичных четвертичных солей.

Катионы щелочных металлов, связанные краун-эфиры являются распространенными липофильными противокатионами, как показано [Li (12-crown-4)2]+.
Многие катионные металлоорганические комплексы изолированы с инертными некоординирующими противоионами. Тетрафторборат ферроцения один из таких примеров.
Электрохимия
Для достижения высокой ионной проводимости электрохимические измерения проводятся в присутствии избытка электролита. В воде электролит часто представляет собой простую соль, такую как хлорид калия. Для измерений в неводных растворах используются соли, состоящие как из липофильных катионов, так и из анионов, например, гексафторфосфат тетрабутиламмония. Даже в таких случаях на потенциалы влияют ионная пара, эффект, который усиливается в растворителях с низким диэлектрическая постоянная.[3]
Стабильность противоионов
Для многих применений противоион просто обеспечивает заряд и липофильность, что позволяет манипулировать своим ионом-партнером. Ожидается, что противоион будет химически инертным. Для контрранионов инертность выражается в терминах низкой Основность Льюиса. Противоионы идеально прочны и инертны. Для противокатионов четвертичного аммония и фосфония инертность связана с их устойчивостью к разложению сильными основаниями и сильными нуклеофилами.
Рекомендации
- ^ ИЮПАК, Сборник химической терминологии 2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) "противоионы ". Дои:10.1351 / goldbook.C01371
- ^ И. Кроссинг и И. Раабе (2004). «Несогласованные анионы - факт или вымысел? Обзор вероятных кандидатов». Angewandte Chemie International Edition. 43 (16): 2066–2090. Дои:10.1002 / anie.200300620. PMID 15083452.
- ^ Гейгер, У. Э., Барриер, Ф., "Металлоорганическая электрохимия на основе электролитов, содержащих слабо координирующие фторарилборатные анионы", Acc. Chem. Res. 2010, 43, 1030. Дои:10.1021 / ar1000023








