Тетрафторборат ферроцения - Ferrocenium tetrafluoroborate
 | |
 | |
 | |
| Имена | |
|---|---|
| Другие имена дициклопентадиенил тетрафторборат железа | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ChemSpider | |
| ECHA InfoCard | 100.156.161 |
PubChem CID |
|
| |
| Характеристики | |
| C10ЧАС10BFeF4 | |
| Молярная масса | 272,84 г / моль |
| Внешность | темно-синий порошок |
| Температура плавления | 178 ° С (352 ° F, 451 К) (разлагается) |
| Растворимость в ацетонитрил | Растворимый[нужна цитата ] |
| Опасности[1] | |
| Паспорт безопасности | Внешний паспорт безопасности материалов |
| Пиктограммы GHS |  |
| Сигнальное слово GHS | Опасность |
| H314 | |
| P280, P305 + 351 + 338, P310 | |
| Родственные соединения | |
Родственные соединения | Ферроцен |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
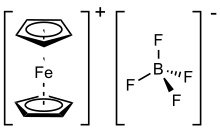
Тетрафторборат ферроцения является металлоорганическое соединение с формулой [Fe (C5ЧАС5)2] BF4. Эта соль состоит из катиона [Fe (C5ЧАС5)2]+ и тетрафторборат анион (BF−
4). Связанные гексафторфосфат также является популярным реагентом с аналогичными свойствами. Катион часто обозначается аббревиатурой Fc.+ или же Cp2Fe+. Соль темно-синего цвета и парамагнитный.Соли ферроцения иногда используются как одноэлектронные окислители, а восстановленный продукт, ферроцен, инертен и легко отделяется от ионных продуктов. Пара ферроцен – ферроцений часто используется в качестве эталона в электрохимии. Стандартный потенциал ферроцена-ферроцения составляет 0,400 В по сравнению с нормальным водородным электродом (NHE).[2] и часто считается инвариантным для разных растворителей.
Подготовка
Имеющееся в продаже соединение может быть получено окислением ферроцена, обычно солями трехвалентного железа с последующим добавлением фторборная кислота.[3] Также хорошо работают различные другие окислители, такие как нитрозилтетрафторборат.[4] Известно много аналогичных солей ферроцения.[5]
Рекомендации
- ^ «Тетрафторборат ферроцения 482358». Сигма-Олдрич.
- ^ Bard, A.J .; Parsons, R .; Джордан, Дж. (1985). Стандартные потенциалы в водном растворе. Нью-Йорк: ИЮПАК.
- ^ Коннелли, Н.Г .; Гейгер, В. Э. (1996). «Химические окислительно-восстановительные агенты для металлоорганической химии». Chem. Ред. 96 (2): 877–910. Дои:10.1021 / cr940053x. PMID 11848774.
- ^ Нильсон, Роджер М .; МакМанис, Джордж Э .; Safford, Lance K .; Уивер, Майкл Дж. (1989). «Влияние растворителя и электролита на кинетику самообмена ферроцений-ферроцен. Переоценка». J. Phys. Chem. 93 (5): 2152. Дои:10.1021 / j100342a086.
- ^ Le Bras, J .; Jiao, H .; Meyer, W. E .; Hampel, F .; Гладыш, Дж. А. (2000). "Синтез, кристаллическая структура и реакции 17-валентно-электронного метильного комплекса рения [(η5-C5Мне5) Re (НЕТ) (P (4-C6ЧАС4CH3)3) (CH3)]+ В (3,5-С
6ЧАС
3(CF
3)
2)−
4: Экспериментальные и вычислительные сравнения связывания с 18-электронными метиловыми и метилиденовыми комплексами ». J. Organomet. Chem. 616: 54–66. Дои:10.1016 / S0022-328X (00) 00531-3.
