Ферроцен - Ferrocene
| |||
| |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК ферроцен, бис (η5-циклопентадиенил) железо | |||
| Другие имена дициклопентадиенил железо | |||
| Идентификаторы | |||
3D модель (JSmol ) | |||
| ЧЭБИ | |||
| ChemSpider | |||
| ECHA InfoCard | 100.002.764 | ||
PubChem CID | |||
| UNII | |||
| |||
| |||
| Свойства | |||
| C10ЧАС10Fe | |||
| Молярная масса | 186,04 г / моль | ||
| Внешность | светло-оранжевый порошок | ||
| Запах | камфора -любить | ||
| Плотность | 1,107 г / см3 (0 ° C), 1,490 г / см3 (20 ° С)[1] | ||
| Температура плавления | 172,5 ° С (342,5 ° F, 445,6 К)[3] | ||
| Точка кипения | 249 ° С (480 ° F, 522 К) | ||
| Нерастворим в воде, растворим в большинстве органических растворителей | |||
| журнал п | 2.04050 [2] | ||
| Структура | |||
| D5d / D5ч | |||
| Металлоцен | |||
| Отсутствие постоянного дипольного момента из-за быстрого вращения Cp[4] | |||
| Опасности | |||
| Основной опасности | Очень опасно при проглатывании. Опасно при контакте с кожей (раздражитель), при попадании в глаза (раздражитель), при вдыхании[6] | ||
Классификация ЕС (DSD) (устарело) |   | ||
| NFPA 704 (огненный алмаз) | |||
| NIOSH (Пределы воздействия на здоровье в США): | |||
PEL (Допустимо) | TWA 15 мг / м3 (всего) TWA 5 мг / м3 (соответственно)[7] | ||
REL (Рекомендуемые) | TWA 10 мг / м3 (всего) TWA 5 мг / м3 (соответственно)[7] | ||
IDLH (Непосредственная опасность) | N.D.[7] | ||
| Родственные соединения | |||
Родственные соединения | кобальтоцен, никелоцен, хромоцен, рутеноцен, осмоцен, пламбоцен | ||
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Ферроцен является металлоорганическое соединение с формулой Fe (C
5ЧАС
5)
2. Молекула состоит из двух циклопентадиенил кольца, связанные на противоположных сторонах центрального утюг атом. Это оранжевое твердое вещество с запахом камфары, которое возвышенный выше комнатной температуры и растворим в большинстве органических растворителей. Он отличается стабильностью: не подвержен воздействию воздуха, воды, сильных оснований и может нагреваться до 400 ° C без разложения. В окислительных условиях он может обратимо реагировать с сильными кислотами с образованием ферроцений катион Fe (C
5ЧАС
5)+
2.[8]
Быстрый рост металлоорганическая химия часто связывают с ажиотажем, связанным с открытием ферроцена и его многочисленных аналоги (металлоцены ).
История
Открытие
Ферроцен был открыт случайно - трижды. Первый известный синтез, возможно, был сделан в конце 1940-х годов неизвестными исследователями в Union Carbide, который пытался пропустить горячие пары циклопентадиена через железную трубу. Пар вступал в реакцию со стенкой трубы, создавая «желтый осадок», который забивал трубу. Спустя годы был получен образец накопленного осадка, который был проанализирован Э. Бримм, вскоре после прочтения статьи Кили и Паусона, и было обнаружено, что он состоит из ферроцена.[8][9]
Второй раз был около 1950 года, когда С. Миллер, Дж. Теббот, и Дж. Тремейн, исследователи в Британский кислород, пытались синтезировать амины из углеводородов и азот в модификации Процесс Габера. Когда они попытались прореагировать циклопентадиеном с азотом при 300 ° C и атмосферном давлении, они были разочарованы, увидев, что углеводород вступает в реакцию с некоторым источником железа, давая ферроцен. Хотя они тоже наблюдали его замечательную стабильность, они отложили это наблюдение и не опубликовали его до тех пор, пока Паусон не сообщил о своих выводах.[8][10][11] Фактически, Миллер и др. Предоставили образец Кили и Паусону, которые подтвердили, что это одно и то же соединение.[9]
В 1951 г. Питер Л. Паусон и Томас Дж. Кили в Duquesne University пытался подготовить фульвален ((C
5ЧАС
4)
2) окислительной димеризацией циклопентадиен (C
5ЧАС
6). С этой целью они отреагировали на Гриньяр соединение циклопентадиенилмагнийбромид в диэтиловый эфир с участием хлорид железа как окислитель.[8] Однако вместо ожидаемого фульвалена они получили светло-оранжевый порошок «замечательной стабильности» с формулой C
10ЧАС
10Fe.[9][12]
Определение структуры

Паусон и Кили предположили, что соединение имеет две циклопентадиенильные группы, каждая из которых имеет одну ковалентную связь от насыщенного атома углерода к атому железа.[8] Однако эта структура несовместима с существовавшими тогда моделями связывания и не объясняет неожиданную стабильность соединения, и химики изо всех сил пытались найти правильную структуру.[11][13]
Структура была выведена и сообщена независимо тремя группами в 1952 году:[14]
- Woodward и Уилкинсон из Имперский колледж Лондон пришел к выводу, наблюдая, что ферроцен претерпевает реакции, типичные для ароматических соединений, таких как бензол[15]
- Э. Фишер из Мюнхенский технический университет вывел структуру (которую он назвал «двойной конус»), а также начал синтезировать другие металлоцены такие как никелоцен и кобальтоцен.[16][17][18]
- П. Ф. Эйланд и Р. Пепинский подтвердил структуру через Рентгеновская кристаллография а позже ЯМР.[11][19][20][21]
Понимание структуры
"Сэндвич" структура ферроцена была шокирующе новой, и для ее объяснения требовалась новая теория. Применение теория молекулярных орбиталей с предположением Fe2+ центр между двумя циклопентадиенид анионы C
5ЧАС−
5 привело к успешному Модель Дьюара – Чатта – Дункансона, позволяющий правильно предсказать геометрию молекулы, а также объяснить ее замечательную стабильность.[22][23]
Влияние
Ферроцен не был первым известным металлоорганическим соединением. Соль Цейзе K [PtCl
3(C
2ЧАС
4)]·ЧАС2О было сообщено в 1831 г.,[24][25] Монда открытие Ni (CO)4 произошло в 1888 г.,[26] и литийорганические соединения были разработаны в 1930-е годы.[27] Однако можно утверждать, что именно открытие ферроцена началось. металлоорганическая химия как отдельная область химии. Это также привело к взрыву интереса к соединениям d-блок металлы с углеводородами.
Открытие было сочтено настолько значительным, что Уилкинсон и Фишер поделились результатами исследования 1973 года. Нобелевская премия по химии »за их пионерские работы, выполненные независимо, по химии металлоорганических соединений, так называемых сэндвич-смеси ".[28]
Структура и склеивание
Мессбауэровская спектроскопия указывает на то, что железному центру в ферроцене следует присвоить степень окисления +2. Тогда каждому циклопентадиенильному (Cp) кольцу должен быть присвоен один отрицательный заряд. Таким образом, ферроцен можно описать как железо (II) бис (циклопентадиенид ), Fe2+[C
5ЧАС−
5]
2.
Тогда количество π-электронов на каждом кольце равно шести, что делает его ароматный согласно с Правило Хюккеля. Эти двенадцать π-электронов затем делятся с металлом посредством ковалентной связи. Поскольку Fe2+ имеет шесть d-электронов, комплекс достигает 18-электронный конфигурации, что обеспечивает ее стабильность. В современных обозначениях эта сэндвич-структурная модель молекулы ферроцена обозначается как Fe (η5
-C
5ЧАС
5)
2.
Расстояния углерод-углеродной связи вокруг каждого пятичленного кольца все составляют 1,40 Å, а расстояния связи Fe-C составляют 2,04 Å. От комнатной температуры до 164К, Рентгеновская кристаллография дает моноклинную пространственную группу; циклопентадиенидные кольца представляют собой ступенчатую конформацию, что приводит к центросимметричной молекуле с группа симметрии D5d.[19] Однако ниже 110 К ферроцен кристаллизуется в ромбической кристаллической решетке, в которой кольца Cp упорядочены и затмеваются, так что молекула имеет группу симметрии D5ч.[29] В газовой фазе электронная дифракция[30] и вычислительные исследования[31] показывают, что кольца Cp затмеваются.
Кольца Cp вращаются с низким барьером вокруг Cp(центроид)–Fe – Cp(центроид) ось, как наблюдали измерения на замещенных производных ферроцена с использованием 1Рука 13C ядерный магнитный резонанс спектроскопия. Например, метилферроцен (CH3C5ЧАС4FeC5ЧАС5) имеет синглет для C5ЧАС5 кольцо.[32]
Синтез
Через реактив Гриньяра
Первые сообщения о синтезе ферроцена были почти одновременными. Паусон и Кили синтезировали ферроцен, используя хлорид железа (III) и реактив Гриньяра, циклопентадиенилмагнийбромид. Хлорид железа (III) взвешен в безводный диэтиловый эфир и добавлен к реактиву Гриньяра.[12] А окислительно-восстановительная реакция происходит, образуя циклопентадиенил радикальный и ионы железа (II). Дигидрофульвален производится радикально-радикальная рекомбинация в то время как железо (II) реагирует с реактивом Гриньяра с образованием ферроцена. Окисление дигидрофулвалена до фульвалена железом (III), результат, которого добивались Кили и Паусон, не происходит.[9]
Газометаллическая реакция

Другой ранний синтез ферроцена был произведен Миллером. и другие.,[10] кто непосредственно реагировал на металлическое железо с газ -фаза циклопентадиена при повышенной температуре.[33] Подход с использованием пентакарбонил железа также сообщалось.[34]
- Fe (CO)5 + 2 С5ЧАС6(ж) → Fe (C5ЧАС5)2 + 5 CO (г) + H2(г)
Через циклопентадиенид щелочного металла
Более эффективные препаративные методы обычно представляют собой модификацию оригинальных трансметалляция последовательность с использованием имеющихся в продаже циклопентадиенид натрия[35] или недавно треснутый циклопентадиен депротонированный гидроксид калия[36] и реагировал с безводным хлоридом железа (II) в эфирных растворителях.
Известны современные модификации оригинального подхода Гриньяра Паусона и Кили:
- Использование циклопентадиенида натрия: 2 NaC5ЧАС5 + FeCl2 → Fe (C5ЧАС5)2 + 2 NaCl
- Использование свежеиспеченного циклопентадиена: FeCl2· 4H2O + 2 С5ЧАС6 + 2 КОН → Fe (C5ЧАС5)2 + 2 KCl + 6 H2О
- Использование соли железа (II) с реактивом Гриньяра: 2 ° C5ЧАС5MgBr + FeCl2 → Fe (C5ЧАС5)2 + 2 MgBrCl
Даже некоторые амин базы (такие как диэтиламин ) можно использовать для депротонирования, но реакция протекает медленнее, чем при использовании более сильных оснований:[35]
- 2 С5ЧАС6 + 2 (CH3CH2)2NH + FeCl2 → Fe (C5ЧАС5)2 + 2 (CH3CH2)2NH2Cl
Прямая трансметалляция может также использоваться для получения ферроцена из других металлоценов, таких как манганоцен:[37]
- FeCl2 + Mn (C5ЧАС5)2 → MnCl2 + Fe (C5ЧАС5)2
Свойства

Ферроцен - это воздуха -стойкое твердое вещество оранжевого цвета с запахом камфоры. Как и ожидалось для симметричных незаряженных частиц, ферроцен растворим в обычных органических растворителях, таких как бензол, но не растворим в воде. Он устойчив к температурам до 400 ° C.[38]
Ферроцен охотно возвышенный, особенно при нагревании в вакууме. Давление пара составляет около 1 Па при 25 ° C, 10 Па при 50 ° C, 100 Па при 80 ° C, 1000 Па при 116 ° C и 10000 Па (почти 0,1 банкомат ) при 162 ° С.[39][40]
Реакции
С электрофилами
Ферроцен претерпевает множество реакций, характерных для ароматических соединений, что позволяет получать замещенные производные. Обычный студенческий эксперимент - это Реакция Фриделя – Крафтса ферроцена с уксусный ангидрид (или ацетилхлорид ) в присутствии фосфорная кислота как катализатор. В условиях Реакция Манниха, ферроцен дает N, N-диметиламинометилферроцен.

Протонирование ферроцена позволяет выделить [Cp2FeH] PF6.[41]
В присутствии хлорид алюминия меня2NPCl2 и ферроцен реагируют с образованием ферроценилдихлорфосфина,[42] тогда как лечение с фенилдихлорфосфин при аналогичных условиях формирует п,п-диферроценил-п-фенилфосфин.[43]
Ферроцен реагирует с п4S10 образует дисульфид диферроценилдитиадифосфетана.[44]
Литиация
Ферроцен реагирует с бутиллитий дать 1,1'-дилитиоферроцен, который является универсальным нуклеофил. Трет-бутиллитий производит монолитиоферроцен.[45] Дилитиоферроцен реагирует с S8, хлорфосфины, и хлорсиланы. Деформированные соединения претерпевают полимеризация с раскрытием кольца.[46]

В фосфиновый лиганд 1,1'-бис (дифенилфосфино) ферроцен (dppf) получают из дилитиоферроцена.
Редокс-химия - ион ферроцения
Ферроцен подвергается одноэлектронному окислению при напряжении около 0,5 В по сравнению с насыщенный каломельный электрод (SCE). Это обратимое окисление использовалось в качестве стандарта в электрохимии как Fc+/ Fc = 0,40 В относительно стандартный водородный электрод.[47] Тетрафторборат ферроцения - обычный реагент.[48] Замечательно обратимое окислительно-восстановительное поведение широко использовалось для управления процессами переноса электронов в электрохимической промышленности.[49][50] и фотохимические[51][52] системы.

Заместители на циклопентадиенильных лигандах изменяют окислительно-восстановительный потенциал ожидаемым образом: электроноакцепторные группы, такие как карбоновая кислота сдвинуть потенциал в анодный направление (т.е. стал более положительным), тогда как группы, высвобождающие электроны, такие как метил группы сдвигают потенциал в катодный направление (более отрицательное). Таким образом, декаметилферроцен гораздо легче окисляется, чем ферроцен, и даже может окисляться до соответствующего дикатона.[53] Ферроцен часто используют как внутренний стандарт для калибровки окислительно-восстановительных потенциалов в неводных электрохимия.
Стереохимия замещенных ферроценов

Дизамещенные ферроцены могут существовать в виде 1,2-, 1,3- или 1,1'-изомеров, ни один из которых не является взаимопревращаемым. Ферроцены, которые асимметрично дизамещены в одном кольце, являются хиральными, например [CpFe (EtC5ЧАС3Меня)]. Эта плоская хиральность возникает, несмотря на то, что ни один атом не является стереогенный центр. Показанный справа замещенный ферроцен (производное 4- (диметиламино) пиридина) показал свою эффективность при использовании для кинетическое разрешение из рацемический вторичный спирты.[54]Было разработано несколько подходов для асимметричной 1,1'-функционализации ферроцена.[55]
Применение ферроцена и его производных
Ферроцен и его многочисленные производные не имеют крупномасштабного применения, но имеют множество нишевых применений, которые используют необычную структуру (лигандные каркасы, фармацевтические кандидаты), надежность (антидетонационные составы, прекурсоры материалов) и окислительно-восстановительный потенциал (реагенты и окислительно-восстановительные стандарты) .
Как лигандный каркас
Хиральный ферроценил фосфины используются в качестве лигандов для реакций, катализируемых переходными металлами. Некоторые из них нашли промышленное применение в синтезе фармацевтических и агрохимических препаратов. Например, дифосфин 1,1'-бис (дифенилфосфино) ферроцен (dppf) оценивается для палладий -реакции сочетания и Иозифосский лиганд полезен для катализа гидрирования.[56] Они названы в честь техника, который сделал первый, Джози Пулео.[57][58]

Присадки к топливу
Ферроцен и его производные являются антидетонационные агенты используется в топливе для бензиновые двигатели. они безопаснее, чем использовались ранее тетраэтилсвинец.[59] Растворы присадок к бензину, содержащие ферроцен, могут быть добавлены к неэтилированному бензину, чтобы его можно было использовать в старинных автомобилях, предназначенных для работы на этилированном бензине.[60] В утюг -содержащие отложения, образованные из ферроцена, могут образовывать проводящий покрытие на свеча зажигания поверхности. Сополимеры ферроцена и полигликоля, полученные в результате реакции поликонденсации между производным ферроцена и замещенным дигидроксиспиртом, имеют многообещающие преимущества в качестве компонента ракетного топлива. Эти сополимеры придают ракетному топливу термостойкость, служат связующим веществом для ракетного топлива и регулируют скорость его горения.[61]
Было обнаружено, что ферроцен эффективен для уменьшения дыма и образования триоксида серы при сжигании угля. Добавление любыми практическими средствами, например пропиткой угля или добавлением ферроцена в камеру сгорания, может значительно снизить количество этих нежелательных побочных продуктов, даже с небольшим количеством металлического циклопентадиенильного соединения.[62]
Фармацевтическая
Производные ферроцена исследовались как лекарственные средства.[63] Только один препарат прошел клинические испытания, Феррохин (7-хлор-N- (2 - ((диметиламино) метил) ферроценил) хинолин-4-амин), противомалярийный.[64][65] Исследованы системы доставки лекарств на основе ферроцен-содержащих полимеров.[66]

Противораковая активность производных ферроцена была впервые исследована в конце 1970-х годов, когда производные, несущие амин или амид группы были протестированы против лимфоцитов лейкемия.[67] Некоторые соли ферроцения проявляют противоопухолевую активность, но ни одно соединение не было оценено в клинике.[68] Производные ферроцена обладают сильной ингибирующей активностью против линии клеток рака легких человека A549, линии клеток колоректального рака HCT116 и линии клеток рака груди MCF-7.[69] Сообщалось об экспериментальном препарате, который представляет собой ферроцениловую версию тамоксифен.[70] Идея заключается в том, что тамоксифен связывается с эстроген сайты связывания, что приводит к цитотоксичности.[70][71]
Ферроцифены используются для лечения рака французской биотехнологической компанией Feroscan, основанной проф. Жерар Жауэн.
Твердотопливное ракетное топливо
Ферроцен и родственные производные используются в качестве мощных катализаторов скорости горения в Композитное топливо на основе перхлората аммония. [72]
Производные и вариации
Аналоги ферроцена можно получить с вариантами циклопентадиенила. Например, бисинденилирон и бисфторенилирон.[58]

Атомы углерода могут быть заменены гетероатомами, как показано на примере Fe (η5-C5меня5)(η5-П5) и Fe (η5-C5ЧАС5)(η5-C4ЧАС4N) ("азаферроцен "). Азаферроцен возникает в результате декарбонилирования Fe (η5-C5ЧАС5) (CO)2(η1-пиррол) в циклогексан.[73] Это соединение при кипячении под рефлюкс в бензол превращается в ферроцен.[74]
Из-за легкости замещения было получено много структурно необычных производных ферроцена. Например, пента (ферроценил) циклопентадиенильный лиганд,[75] содержит циклопентадиенильный анион, дериватизированный пятью ферроценовыми заместителями.


В гексаферроценилбензол, С6[(η5-C5ЧАС4) Fe (η5-C5ЧАС5)]6, все шесть позиций на бензол молекула имеет ферроценильные заместители (р).[76] дифракция рентгеновских лучей анализ этого соединения подтверждает, что циклопентадиенильные лиганды не копланарны с бензольным ядром, а имеют чередующиеся двугранные углы от + 30 ° до -80 °. Из-за стерического скучивания ферроценилы слегка изогнуты с углами 177 ° и имеют удлиненные связи C-Fe. Четвертичные циклопентадиенильные атомы углерода также являются пирамидальный. Также бензольное ядро имеет конформация стула с двугранными углами 14 ° и дисплеями длина облигации чередование 142,7вечера и 141,1 пм, оба показателя стерического скопления заместителей.
Сообщалось о синтезе гексаферроценилбензола с использованием Муфта Негиши гексаиодидобензола и диферроценилцинка, используя трис (дибензилиденацетон) дипалладий (0) так как катализатор, в тетрагидрофуран:[76]
В Уступать составляет всего 4%, что является дополнительным доказательством, согласующимся с существенными стерический скопление вокруг ядра арены.
Химия материалов
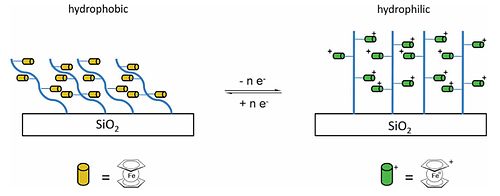
Ферроцен, предшественник наночастиц железа, можно использовать в качестве катализатора для производства углеродных нанотрубок.[78] В винилферроцен может быть сделано Реакция Виттига из альдегид, а фосфониевая соль, и гидроксид натрия.[79] Винилферроцен можно превратить в полимер (поливинилферроцен, PVFc), ферроценильную версию полистирол (фенильные группы заменены ферроценильными группами). Другая полиферроцен который может быть образован, представляет собой поли (2- (метакрилоилокси) этилферроценкарбоксилат), PFcMA. Помимо использования основных цепей из органических полимеров, эти боковые ферроценовые звенья присоединены к неорганическим основным цепям, таким как полисилоксаны, полифосфазены, и полифосфинобораны, (–PH (R) –BH2–)п, и полученные материалы демонстрируют необычные физические и электронные свойства, относящиеся к окислительно-восстановительной паре ферроцен / ферроциний.[77] И PVFc, и PFcMA были привязаны к кремнезем вафли и смачиваемость измеряется, когда полимерные цепи не заряжены и когда ферроценовые фрагменты окисляются с образованием положительно заряженных групп. В угол контакта с водой на пластинах с покрытием PFcMA было на 70 ° меньше после окисления, в то время как в случае PVFc уменьшение составило 30 °, и переключение смачиваемости обратимо. В случае PFcMA эффект удлинения цепей и, следовательно, введения большего количества ферроценовых групп заключается в значительно большем уменьшении краевого угла смачивания при окислении.[77][80]
Смотрите также
использованная литература
- ^ «Ферроцен (102-54-5)». Получено 3 февраля 2010.
- ^ "FERROCENE_msds".
- ^ Лиде, Д. Р., изд. (2005). CRC Справочник по химии и физике (86-е изд.). Бока-Ратон (Флорида): CRC Press. п. 3.258. ISBN 0-8493-0486-5.
- ^ Мохаммади, Наргес; Ганесан, Аравиндхан; Чантлер, Кристофер Т .; Ван, Фэн (2012). «Дифференциация конформеров ферроцена D5d и D5h с помощью ИК-спектроскопии». Журнал металлоорганической химии. 713: 51–59. Дои:10.1016 / j.jorganchem.2012.04.009.
- ^ «Паспорт безопасности материала. Ферроцен. MSDS № 03388. Раздел» (PDF). Северо-западный государственный университет штата Миссури.
- ^ «Ферроценовый паспорт безопасности материалов». Научная лаборатория. Архивировано из оригинал на 2015-12-12. Получено 2015-11-25.
- ^ а б c Карманный справочник NIOSH по химической опасности. "#0205". Национальный институт охраны труда и здоровья (NIOSH).
- ^ а б c d е Вернер, Х (2012). «По крайней мере, 60 лет ферроцена: открытие и повторное открытие сэндвич-комплексов». Энгью. Chem. Int. Эд. 51 (25): 6052–6058. Дои:10.1002 / anie.201201598. PMID 22573490.
- ^ а б c d Паусон, Питер Л. (2001). «Ферроцен - как все начиналось». Журнал металлоорганической химии. 637–639: 3–6. Дои:10.1016 / S0022-328X (01) 01126-3.
- ^ а б c Miller, S.A .; Теббот, Дж. А .; Тремейн, Дж. Ф. (1952). «114. Дициклопентадиенилирон». J. Chem. Soc.: 632–635. Дои:10.1039 / JR9520000632.
- ^ а б c Ласло, Пьер; Хоффманн, Роальд (2000). «Ферроцен: броненосная история или рассказ Расомона?» (PDF). Angewandte Chemie International Edition. 39 (1): 123–124. Дои:10.1002 / (SICI) 1521-3773 (20000103) 39: 1 <123 :: AID-ANIE123> 3.0.CO; 2-Z. PMID 10649350.
- ^ а б c Кили, Т. Дж .; Паусон, П.Л. (1951). «Новый тип железоорганического соединения». Природа. 168 (4285): 1039–1040. Bibcode:1951 г., природа. 168,1039K. Дои:10.1038 / 1681039b0. S2CID 4181383.
- ^ Федерман Нето, Альберто; Пелегрино, Алессандра Карамори; Дарин, Витор Андре (2004). «Ферроцен: 50 лет металлоорганической химии переходных металлов - от органической и неорганической к супрамолекулярной химии (аннотация)». Тенденции в металлоорганической химии. Тенденции исследований. 4: 147–169.
- ^ Вернер, Х. (2008). Вехи в химии органо-переходных металлов: личное мнение. Нью-Йорк: Springer Science. С. 161–63. ISBN 978-0-387-09847-0.
- ^ Уилкинсон, Г.; Розенблюм, М .; Whiting, M.C .; Вудворд, Р. Б. (1952). «Структура железа бис-циклопентадиенил ». Варенье. Chem. Soc. 74 (8): 2125–2126. Дои:10.1021 / ja01128a527.
- ^ Фишер, Э.; Пфаб, В. (1952). "Zur Kristallstruktur der Di-Cyclopentadienyl-Verbindungen des zweiwertigen Eisens, Kobalts und Nickels" [О кристаллической структуре бис-циклопентадиенильных соединений двухвалентного железа, кобальта и никеля]. Zeitschrift für Anorganische und Allgemeine Chemie (на немецком). 7 (6): 377–339. Дои:10.1002 / zaac.19532740603.
- ^ Фишер, Э.; Пфаб, В. (1952). "Zur Kristallstruktur der Di-Cyclopentadienyl-Verbindungen des zweiwertigen Eisens, Kobalts und Nickels" [О кристаллической структуре бис-циклопентадиенильных соединений двухвалентного железа, кобальта и никеля]. Zeitschrift für Naturforschung B. 7 (7): 377–379. Дои:10.1515 / znb-1952-0701.
- ^ Окуда, июн (2016-12-28). «Ферроцен - 65 лет спустя». Европейский журнал неорганической химии. 2017 (2): 217–219. Дои:10.1002 / ejic.201601323. ISSN 1434-1948.
- ^ а б Эйланд, Филип Франк; Пепинский, Рэй (1952). «Рентгенологическое исследование бисциклопентадиенила железа». Варенье. Chem. Soc. 74 (19): 4971. Дои:10.1021 / ja01139a527.
- ^ Dunitz, J. D .; Оргель, Л. Э. (1953). «Бис-циклопентадиенил - молекулярный сэндвич». Природа. 171 (4342): 121–122. Bibcode:1953Натура.171..121D. Дои:10.1038 / 171121a0. S2CID 4263761.
- ^ Dunitz, J .; Оргель, Л .; Рич А. (1956). «Кристаллическая структура ферроцена». Acta Crystallogr. 9 (4): 373–375. Дои:10.1107 / S0365110X56001091.
- ^ Минго, D.M.P. (2001). "Историческая перспектива выдающегося вклада Дьюара в металлоорганическую химию". J. Organomet. Chem. 635 (1–2): 1–8. Дои:10.1016 / S0022-328X (01) 01155-X.
- ^ Mehrotra, R.C .; Сингх, А. (2007). Металлоорганическая химия: единый подход (2-е изд.). Нью-Дели: New Age International. С. 261–67. ISBN 978-81-224-1258-1.
- ^ Zeise, W.C. (1831). "Von der Wirkung zwischen Platinchlorid und Alkohol, und von den dabei entstehenden neuen Substanzen". Annalen der Physik (на немецком). 97 (4): 497–541. Bibcode:1831АнП .... 97..497Z. Дои:10.1002 / andp.18310970402.
- ^ Хант, Л. (1984). «Первые металлоорганические соединения: Уильям Кристофер Цейзе и его платиновые комплексы» (PDF). Platinum Metals Rev. 28 (2): 76–83.
- ^ Leigh, G.J .; Уинтертон, Н., ред. (2002). Современная координационная химия: наследие Джозефа Чатта. Кембридж, Великобритания: RSC Publishing. С. 101–10. ISBN 978-0-85404-469-6.
- ^ Эйш, Джон Дж. (2002). «Генри Гилман: американский пионер в области металлоорганической химии в современной науке и технологиях †». Металлоорганические соединения. 21 (25): 5439–5463. Дои:10.1021 / om0109408. ISSN 0276-7333.
- ^ "Нобелевская премия по химии 1973 г.". Нобелевский фонд. Получено 12 сентября 2010.
- ^ Зайлер, П .; Дуниц, Дж. Д. (1982). «Низкотемпературная кристаллизация орторомбического ферроцена: структурный анализ при 98 К». Acta Crystallographica Раздел B. 38 (6): 1741–1745. Дои:10.1107 / s0567740882007080. ISSN 0567-7408.
- ^ Haaland, A .; Нильссон, Дж. Э. (1968). «Определение барьеров внутреннего вращения с помощью дифракции электронов. Ферроцен и рутеноцен». Acta Chem. Сканд. 22: 2653–2670. Дои:10.3891 / acta.chem.scand.22-2653.
- ^ Кориани, Соня; Хааланд, Арне; Хельгакер, Трюгве; Йоргенсен, Поул (2006). «Равновесная структура ферроцена». ХимФисХим. 7 (1): 245–249. Дои:10.1002 / cphc.200500339. PMID 16404766.
- ^ Abel, E.W .; Лонг, Н. Дж .; Оррелл, К. Г .; Осборн, А.Г .; Сик В. (1991). «Динамические ЯМР-исследования вращения кольца в замещенных ферроценах и рутеноценах». J. Org. Chem. 403 (1–2): 195–208. Дои:10.1016 / 0022-328X (91) 83100-I.
- ^ Уилкинсон, Г.; Паусон, П.Л.; Коттон, Ф. (1954). «Бис-циклопентадиенильные соединения никеля и кобальта». Варенье. Chem. Soc. 76 (7): 1970. Дои:10.1021 / ja01636a080.
- ^ Уилкинсон, Г.; Коттон, Ф. (1959). «Циклопентадиенильные и ареновые соединения металлов». Прогресс в неорганической химии. 1. С. 1–124. Дои:10.1002 / 9780470166024.ch1. ISBN 978-0-470-16602-4.
- ^ а б Уилкинсон, Г. (1956). «Ферроцен». Органический синтез. 36: 31. Дои:10.15227 / orgsyn.036.0031.; Коллективный объем, 4, п. 473
- ^ Веселый, У. Л. (1970). Синтез и характеристика неорганических соединений.. Нью-Джерси: Прентис-Холл.
- ^ Уилкинсон, Г.; Коттон, Ф.; Бирмингем, Дж. М. (1956). «О циклопентадиениде марганца и некоторых химических реакциях нейтральных бис-циклопентадиенильных соединений металлов». J. Inorg. Nucl. Chem. 2 (2): 95. Дои:10.1016/0022-1902(56)80004-3.
- ^ Соломонс, Грэм; Фрайл, Крейг (2006). Органическая химия (9-е изд.). США: John Wiley & Sons.
- ^ Monte, Manuel J. S .; Сантос, Луис М. Н. Б. Ф .; Фулем, Михал; Fonseca, José M. S .; Соуза, Карлос А. Д. (2006). «Новый статический аппарат и давление пара стандартных материалов: нафталин, бензойная кислота, бензофенон и ферроцен». J. Chem. Англ. Данные. 51 (2): 757. Дои:10.1021 / je050502y.
- ^ Фулем, Михал; Ружичка, Кветослав; Червинка, Цтирад; Rocha, Marisa A. A .; Сантос, Луис М. Н. Б. Ф .; Берг, Роберт Ф. (2013). «Рекомендуемое давление пара и теплофизические данные для ферроцена». Журнал химической термодинамики. 57: 530–540. Дои:10.1016 / j.jct.2012.07.023.
- ^ Малищевский, Мориц; Сеппельт, Конрад; Саттер, Йорг; Heinemann, Frank W .; Диттрих, Биргер; Мейер, Карстен (2017-09-19). "Протонирование ферроцена: исследование низкотемпературной рентгеновской дифракции [Cp2FeH] (PF6) Обнаруживает связанный с железом гидридо-лиганд ». Angewandte Chemie International Edition. 56 (43): 13372–13376. Дои:10.1002 / anie.201704854. PMID 28834022.
- ^ Knox, G.R .; Паусон, П.Л.; Уиллисон, Д. (1992). «Производные ферроцена. 27. Ферроценилдиметилфосфин». Металлоорганические соединения. 11 (8): 2930–2933. Дои:10.1021 / om00044a038.
- ^ Sollott, G.P .; Mertwoy, H.E .; Портной, С .; Снид, Дж. Л. (1963). "Несимметричные третичные фосфины ферроцена реакциями Фриделя – Крафтса. I. Ферроценилфенилфосфины". J. Org. Chem. 28 (4): 1090–1092. Дои:10.1021 / jo01039a055.
- ^ Марк Р. Сент-Дж. Форман, Александра М. З. Славин, Дж. Дерек Вуллинз (1996). 2,4-Дисульфид 2,4-Диферроценил-1,3-дитиадифосфетана; структура и реакции с катехолами и [PtCl2(PR3)2] (R = Et или Bun) ". J. Chem. Soc., Dalton Trans. (18): 3653–3657. Дои:10.1039 / DT9960003653.CS1 maint: несколько имен: список авторов (ссылка на сайт)
- ^ Ребьер, Ф .; Samuel, O .; Каган, Х. Б. (1990). «Удобный метод приготовления монолитиоферроцена». Tetrahedron Lett. 31 (22): 3121–3124. Дои:10.1016 / S0040-4039 (00) 94710-5.
- ^ Герберт, Дэвид Э .; Майер, Ульрих Ф. Дж .; Манеры, Ян (2007). «Напряженные металлоценофаны и родственные металлоорганические кольца, содержащие пи-углеводородные лиганды и центры переходных металлов». Энгью. Chem. Int. Эд. 46 (27): 5060–5081. Дои:10.1002 / anie.200604409. PMID 17587203.
- ^ К. Э. Хаукрофт и А. Г. Шарп, Неорганическая химия 4-е издание, 2012, с. 925.
- ^ Коннелли, Н.Г .; Гейгер, В. Э. (1996). «Химические окислительно-восстановительные агенты для металлоорганической химии». Chem. Ред. 96 (2): 877–910. Дои:10.1021 / cr940053x. PMID 11848774.
- ^ Sirbu, D .; Turta, C .; Гибсон, Э. А .; Беннистон, А. К. (11 августа 2015 г.). «Эффект ферроцена: усиленное электрокаталитическое производство водорода с использованием комплексов мезо-тетраферроценилпорфирина, палладия (II) и меди (II)». Dalton Transactions. 44 (33): 14646–14655. Дои:10.1039 / C5DT02191J. ISSN 1477-9234. PMID 26213204.
- ^ Леннокс, Аластер Дж. Дж .; Nutting, Jordan E .; Шталь, Шеннон С. (2018-01-03). «Селективная электрохимическая генерация бензильных радикалов с помощью медиаторов переноса электрона на основе ферроцена». Химическая наука. 9 (2): 356–361. Дои:10.1039 / C7SC04032F. ISSN 2041-6539. ЧВК 5909123. PMID 29732109.
- ^ Dannenberg, J. J .; Ричардс, Дж. Х. (1965-04-01). «Фотосенсибилизация ферроценом. Фотохимия высших электронных возбужденных состояний». Журнал Американского химического общества. 87 (7): 1626–1627. Дои:10.1021 / ja01085a048. ISSN 0002-7863.
- ^ Sirbu, D .; Turta, C .; Benniston, A.C .; Abou-Chahine, F .; Lemmetyinen, H .; Ткаченко, Н. В .; Wood, C .; Гибсон, Э. (23 мая 2014 г.). «Синтез и свойства порфирина цинка (II) с добавлением мезотрис-ферроцена и критическая оценка его характеристик сенсибилизированного красителем солнечного элемента (DSSC)». RSC Advances. 4 (43): 22733–22742. Дои:10.1039 / C4RA03105A. ISSN 2046-2069.
- ^ Малищевский, М .; Adelhardt, M .; Sutter, J .; Мейер, К .; Сеппельт, К. (12 августа 2016 г.). «Выделение, структурная и электронная характеристика солей дикатионов декаметилферроцена». Наука. 353 (6300): 678–682. Bibcode:2016Научный ... 353..678М. Дои:10.1126 / science.aaf6362. ISSN 0036-8075. PMID 27516596. S2CID 43385610.
- ^ Рубль, J.C .; Latham, H.A .; Фу, Г. С. (1997). «Эффективное кинетическое разрешение вторичных спиртов с планарно-хиральным аналогом 4- (диметиламино) пиридина. Использование Fe (C5Ph5) Группа в асимметричном катализе ». Варенье. Chem. Soc. 119 (6): 1492–1493. Дои:10.1021 / ja963835b.
- ^ Аткинсон, Роберт С. Дж .; Гибсон, Вернон С.; Лонг, Николас Дж. (2004-06-08). «Синтезы и каталитические применения несимметричных ферроценовых лигандов». Обзоры химического общества. 33 (5): 313–328. Дои:10.1039 / B316819K. ISSN 1460-4744. PMID 15272371.
- ^ а б Блазер, Ханс-Ульрих (2002). Темы в катализе. 19: 3–16. Дои:10.1023 / а: 1013832630565. S2CID 95738043. Отсутствует или пусто
| название =(Помогите) - ^ Привилегированные хиральные лиганды и катализаторы Ци-Линь Чжоу 2011
- ^ а б Степницка, Петр (2008). Ферроцены: лиганды, материалы и биомолекулы. Хобокен, штат Нью-Джерси: Дж. Вили. ISBN 978-0-470-03585-6.
- ^ «Применение топливных присадок» (PDF). Архивировано из оригинал (PDF) на 2006-05-05.
- ^ США 4104036, Чао, Тай С., "Железосодержащие моторные топливные композиции и способ их использования", выпущенный 1 августа 1978 г.
- ^ Дьюи, Фред М. Ферроценовые полигликоли. Патент США 3,598,850, поданный 11 июня 1969 г. и выданный 10 августа 1971 г. [онлайн] Доступно: https://patentimages.storage.googleapis.com/6f/2a/1c/dad6147ea46bcb/US3598850.pdf
- ^ Керли, Роберт В. Процесс и состав сжигания угля. Патент США 3 927 992, поданный 23 ноября 1971 г. и опубликованный 23 декабря 1975 г. [Онлайн] Доступно: https://patentimages.storage.googleapis.com/0d/03/57/c94e635d15e1fb/US3927992.pdf
- ^ Ван Ставерен, Дэйв Р.; Метцлер-Нольте, Нильс (2004). «Биоорганометаллическая химия ферроцена». Chem. Ред. 104 (12): 5931–5986. Дои:10.1021 / cr0101510. PMID 15584693.
- ^ Biot, C .; Nosten, F .; Fraisse, L .; Тер-Минасян, Д .; Khalife, J .; Дайв, Д. (2011). «Антималярийный феррохин: от лавки к клинике». Паразит. 18 (3): 207–214. Дои:10.1051 / parasite / 2011183207. ISSN 1252-607X. ЧВК 3671469. PMID 21894260.

- ^ Roux, C .; Био, К. (2012). «Противомалярийные препараты на основе ферроцена». Future Med. Chem. 4 (6): 783–797. Дои:10.4155 / fmc.12.26. PMID 22530641.
- ^ Гу, Хайбинь; Му, Шэндун; Цю, Гуйжун; Лю, Сюн; Чжан, Ли; Юань, Яньфэй; Астрюк, Дидье (июнь 2018 г.). «Системы доставки лекарств, реагирующие на окислительно-восстановительный механизм, с супрамолекулярными ферроценилсодержащими полимерами для контролируемого высвобождения». Обзоры координационной химии. 364: 51–85. Дои:10.1016 / j.ccr.2018.03.013. ISSN 0010-8545.
- ^ Орнелас, Катя (2011). «Применение ферроцена и его производных в исследованиях рака». Новый журнал химии. 35 (10): 1973. Дои:10.1039 / c1nj20172g. S2CID 56521492.
- ^ Бабин, В. Н .; и другие. (2014). «Ферроцены как потенциальные противоопухолевые препараты. Факты и гипотезы». Русь. Chem. Бык. 63 (11): 2405–2422. Дои:10.1007 / s11172-014-0756-7. S2CID 94618726.
- ^ Юн, Цзяньпин и Лу, Цаньчжун. Производное ферроцена, способ получения и использование. Патент США 9738673, поданный 29 ноября 2016 г. и опубликованный 22 августа 2017 г. [Онлайн] Доступно: https://patentimages.storage.googleapis.com/dd/6e/d6/9fd8e3c5c96b67/US9738673.pdf
- ^ а б Вверху, S .; Vessières, A .; Leclercq, G .; Quivy, J .; Tang, J .; Vaissermann, J .; Huché, M .; Jaouen, Г. (2003). «Исследования синтеза, биохимических свойств и молекулярного моделирования металлоорганических модуляторов специфических эстрогеновых рецепторов (SERM), ферроцифенов и гидроксиферроцифенов: доказательства антипролиферативного эффекта гидроксиферроцифенов как на гормонозависимые, так и на гормононезависимые клеточные линии рака молочной железы». Chem. Евро. Дж. 9 (21): 5223–36. Дои:10.1002 / chem.200305024. PMID 14613131.
- ^ Рон Дагани (16 сентября 2002 г.). «Биологическая сторона металлоорганических соединений». Новости химии и техники. 80 (37): 23–29. Дои:10.1021 / cen-v080n037.p023.
- ^ «Катализатор скорости горения ферроцена». www.rocketmotorparts.com. Получено 2020-01-13.
- ^ Zakrzewski, J .; Джаннотти, Чарльз (1990). «Улучшенный фотохимический синтез азаферроцена». J. Organomet. Chem. 388 (1–2): 175–179. Дои:10.1016 / 0022-328X (90) 85359-7.
- ^ Эфрати, Ави; Джубран, Нусралла; Гольдман, Александр (1982). "Химия некоторых η5-пирролил- и η1-N-пирролилированные комплексы железа ». Неорг. Chem. 21 (3): 868. Дои:10.1021 / ic00133a006.
- ^ Yu, Y .; Bond, A.D .; Леонард, П. У .; Воллхардт, К. П. С .; Уайтнер, Г. Д. (2006). «Синтезы, структуры и реакционная способность радиальных олигоциклопентадиенильных комплексов металлов: пента (ферроценил) циклопентадиенил и конгенеры». Энгью. Chem. Int. Эд. 45 (11): 1794–1799. Дои:10.1002 / anie.200504047. PMID 16470902.
- ^ а б Ю, Йонг; Бонд, Эндрю Д .; Леонард, Филип В .; Лоренц, Ульрих Дж .; Тимофеева, Татьяна В .; Фоллхардт, К. Питер С .; Whitener, Glenn D .; Яковенко, Андрей А. (2006). «Гексаферроценилбензол». Chem. Commun. (24): 2572–2574. Дои:10,1039 / b604844g. PMID 16779481.
- ^ а б c Пичниг, Рудольф (2016). «Полимеры с подвесными ферроценами». Chem. Soc. Ред. 45 (19): 5216–5231. Дои:10.1039 / C6CS00196C. PMID 27156979.
- ^ Конройя, Девин; Мойсалаб, Анна; Кардосоа, Сильвана; Виндлеб, Алан; Дэвидсон, Джон (2010). «Реактор на углеродных нанотрубках: разложение ферроцена, рост частиц железа, агрегация нанотрубок и масштабирование». Chem. Англ. Sci. 65 (10): 2965–2977. Дои:10.1016 / j.ces.2010.01.019.
- ^ Лю, Ван-и; Сюй, Ци-хай; Ма, Юн-сян; Лян, Юн-минь; Дун, Нин-ли; Гуань, Де-пэн (2001). «Бессольвентный синтез производных ферроценилэтилена». J. Organomet. Chem. 625: 128–132. Дои:10.1016 / S0022-328X (00) 00927-X.
- ^ Elbert, J .; Gallei, M .; Rüttiger, C .; Brunsen, A .; Didzoleit, H .; Stühn, B .; Рехан, М. (2013). «Ферроценовые полимеры для переключаемой смачиваемости поверхности». Металлоорганические соединения. 32 (20): 5873–5878. Дои:10.1021 / om400468p.
внешние ссылки
- Ферроцен в Периодическая таблица видео (Ноттингемский университет)
- Карманный справочник NIOSH по химической опасности (Центры по контролю и профилактике заболеваний)







