Кинетическое разрешение - Kinetic resolution
В органическая химия, кинетическое разрешение это средство различения двух энантиомеры в рацемическая смесь. При кинетическом разрешении два энантиомера реагируют с разными скорость реакции в химическая реакция с хиральный катализатор или реагент, в результате чего получают энантиообогащенный образец менее реакционноспособного энантиомера.[1] В отличие от хиральное разрешение, кинетическое разрешение зависит не от различных физических свойств диастереомерных продуктов, а от различных химических свойств рацемических исходных материалов. Этот энантиомерный избыток (ee) непрореагировавшего исходного материала непрерывно увеличивается по мере образования большего количества продукта, достигая 100% непосредственно перед полным завершением реакции. Кинетическое разрешение зависит от различий в реакционной способности энантиомеров или энантиомерных комплексов. Кинетическое разрешение - это концепция органическая химия и может быть использован для получения хиральных молекул в органический синтез. Реакции кинетического разделения с использованием чисто синтетических реагентов и катализаторов гораздо менее распространены, чем использование ферментативного кинетического разрешения в применении к органическому синтезу, хотя за последние 30 лет был разработан ряд полезных синтетических методов.[2]

История
Первое зарегистрированное кинетическое разрешение было достигнуто Луи Пастер. После реакции водного рацемического аммония тартрат с помощью плесени из Penicillium glaucum он повторно изолировал оставшийся тартрат и обнаружил, что это левовращающий.[3] Хиральные микроорганизмы, присутствующие в плесени, катализируют метаболизм (р,р) -тартрат выборочно, оставляя избыток (S,S)-тартрат.
Кинетическое разрешение синтетическими средствами впервые было сообщено Марквальд и Маккензи в 1899 г. в этерификация из рацемический миндальная кислота с оптически активным (-) -ментол. При избытке присутствующей рацемической кислоты они наблюдали образование сложного эфира, полученного из (+) -миндальная кислота быть быстрее, чем образование сложного эфира из (-) - миндальной кислоты. Непрореагировавшая кислота имеет небольшой избыток (-) - миндальной кислоты, и позднее было показано, что сложный эфир дает (+) - миндальную кислоту при омылении. Важность этого наблюдения заключалась в том, что теоретически, если бы использовалась половина эквивалента (-) - ментола, можно было бы приготовить высокоэнантиообогащенный образец (-) - миндальной кислоты. Это наблюдение привело к успешному кинетическому разделению других хиральных кислот, положив начало использованию кинетического разрешения в органической химии.[4][5]
Теория
Кинетическое разрешение - это возможный метод необратимой дифференциации пары энантиомеров из-за (потенциально) различных энергий активации. Хотя оба энантиомера находятся в одном и том же Свободная энергия Гиббса уровень по определению, и продукты реакции с обоими энантиомерами также находятся на равных уровнях, , или энергия переходного состояния, могут различаться. На изображении ниже R-энантиомер имеет более низкий и, таким образом, будет реагировать быстрее, чем энантиомер S.
Идеальное кинетическое разрешение - это такое разрешение, при котором реагирует только один энантиомер, то есть kр>> kS. В избирательность (s) кинетического разрешения связано с константы скорости реакции энантиомеров R и S, kр и kS соответственно через s = kр/ kS, вилкар> kS. Эту селективность также можно назвать относительные скорости реакции. Это можно записать через разность свободной энергии между состояниями переходов с высокой и низкой энергией: .[6]
Селективность также может быть выражена в единицах ее извлеченного исходного материала и конверсии (c), если предполагается кинетика первого порядка (в субстрате). Если предполагается, что S-энантиомер исходного материала рацемат будут извлечены в избытке, можно выразить концентрации (мольные доли) энантиомеров S и R как
где ее - ее исходного материала. Обратите внимание, что для c = 0, что означает начало реакции, , где означают начальные концентрации энантиомеров. Тогда для стехиометрического хирального разлагающего агента B *
Обратите внимание, что если разделяющий агент стехиометрический и ахиральный, с хиральным катализатором, термин [B *] не появляется. Тем не менее, используя аналогичное выражение для R, мы можем выразить s как
Если мы хотим выразить это в терминах энантиомерного избытка продукта, ee ", мы должны использовать тот факт, что для продуктов R 'и S' из R и S, соответственно
Отсюда мы видим, что
что дает нам
что, когда мы вставляем в наше выражение для s, полученное выше, получаем
Кроме того, выражения для c и ee можно параметризовать, чтобы получить явные выражения для C и ee в терминах t. Во-первых, явное решение для [S] и [R] как функций от t дает
который, включенный в выражения для ee и c, дает
Без ограничения общности можно допустить, что kS= 1, что дает kр= s, упрощая приведенные выше выражения. Точно так же выражение для ee ″ как функции от t может быть получено
Таким образом, графики ee и ee ″ в зависимости от c могут быть построены с t в качестве параметр и разные значения s создают разные кривые, как показано ниже.
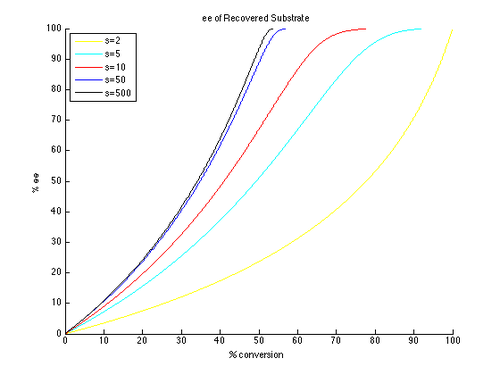

Как можно видеть, для непрореагировавшего исходного материала гораздо легче достичь высоких энантиомерных избытков. Однако существует компромисс между ее и конверсией: более высокий ее (восстановленного субстрата) получается при более высокой конверсии и, следовательно, более низкий выход изолированного продукта. Например, при коэффициенте селективности всего 10 возможно 99% ее при конверсии примерно 70%, что дает выход примерно 30%. Напротив, для получения хорошего э.и.и. выхода продукта необходимы очень высокие коэффициенты селективности. Например, при коэффициенте селективности 10 ee ″ выше приблизительно 80% недостижимо, а для более реалистичных преобразований получаются значительно более низкие значения ee ″. Селективность выше 50 требуется для высокоэнантиообогащенного продукта с разумным выходом.
Следует отметить, что это упрощенная версия истинной кинетики кинетического разрешения. Предположение, что реакция является первым порядком по субстрату, является ограничивающим, и возможно, что зависимость от субстрата может зависеть от конверсии, что приводит к гораздо более сложной картине. В результате общий подход состоит в том, чтобы измерять и сообщать только урожайность и ее, поскольку формула для krel применимо только к идеализированному кинетическому разрешению. Несложно учесть начальное образование комплекса субстрат-катализатор, которое может свести на нет кинетику первого порядка. Однако сделанные общие выводы по-прежнему полезны для понимания влияния селективности и конверсии на ее.
Практичность
С появлением асимметричный катализ, необходимо учитывать практичность использования кинетического разрешения для приготовления энантиочистых продуктов. Даже для продукта, который может быть получен с помощью асимметричного каталитического или вспомогательного пути, рацемат может быть значительно дешевле, чем энантиочистый материал, что приводит к повышенной рентабельности даже с присущей «потерей» 50% материала. В качестве необходимых условий для практического кинетического разрешения были предложены следующие условия:[6]
- недорогой рацемат и катализатор
- нет подходящего энантиоселективного, хиральный бассейн, или же классическое разрешение маршрут возможен
- разрешение происходит избирательно при низких загрузках катализатора
- разделение исходного материала и продукта легко
На сегодняшний день разработан ряд катализаторов для кинетического разделения, которые удовлетворяют большинству, если не всем, указанным выше критериям, что делает их весьма практичными для использования в органическом синтезе. В следующих разделах будет обсуждаться ряд ключевых примеров.
Реакции с использованием синтетических реагентов
Реакции ацилирования

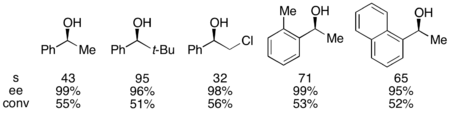
Грегори Фу и коллеги разработали методологию использования хирального DMAP аналог для достижения отличного кинетического разрешения вторичных спиртов.[7] Первоначальные исследования с использованием эфир в качестве растворителя, низкие загрузки катализатора (2 мол.%), уксусный ангидрид в качестве ацилирующего агента, и триэтиламин при комнатной температуре дает селективность в пределах 14-52, что соответствует ее высокой степени регенерированного спиртового продукта 99,2%.[8] Однако проверка растворителей доказала, что использование трет-амиловый спирт увеличили как реактивность, так и селективность.[9]

Для эталонного субстрата 1-фенилэтанола это соответствовало 99% ее непрореагировавшего спирта при конверсии 55% при работе при 0 ° C. Эта система оказалась способной к разделению ряда арилалкилкарбинолов с селективностью до 95 и низкой загрузкой катализатора 1%, как показано ниже, с использованием (-) - энантиомера катализатора. Это привело к получению высокоэнантиообогащенных спиртов с очень низкой степенью конверсии, что также дало превосходные выходы. Кроме того, высокая селективность приводит к получению высокоэнантиообогащенных ацилированных продуктов с 90% э.и. пробы ацилированного спирта для о-толилметилкарбинола с s = 71.
Кроме того, Fu сообщил о первом высокоселективном ацилировании рацемических диолов (а также о десимметризации мезодиолов). При низкой загрузке катализатора, составляющей 1%, энантиообогащенный диол был извлечен с ее выходом 98% и выходом 43%, а диацетат - с выходом 39% и выходом 99%. Остаток материала извлекали в виде смеси моноацетата.

Было также показано, что планарно-хиральный катализатор DMAP эффективен при кинетическом разделении пропаргиловый спирты.[10] Однако в этом случае селективность оказалась самой высокой без присутствия основания. При работе с 1 мол.% Катализатора при 0 ° C можно было достичь селективности до 20. Ограничения этого метода включают требование наличия ненасыщенной функциональной группы, такой как карбонил или алкены, в удаленном алкинильном положении. Спирты, разделенные с использованием (+) - энантиомера катализатора DMAP, показаны ниже.

Фу также продемонстрировал способность своего хирального катализатора DMAP растворять аллильный спирты.[11]Эффективная селективность зависела от наличия геминального или цис-заместителя у спиртосодержащей группы, за заметным исключением транс-фенилового спирта, который проявлял наивысшую селективность. Используя 1-2,5 мол.% (+) - энантиомера катализатора DMAP, спирты, показанные ниже, были разделены в присутствии триэтиламина.


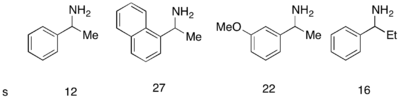
Хотя катализатор-аналог Фу DMAP работал исключительно хорошо для кинетического разделения рацемических спиртов, его не удалось использовать для кинетического разделения аминов. Был разработан аналогичный катализатор PPY *, который при использовании с новым ацилирующим агентом позволил успешно провести ацилирование аминов с кинетическим разрешением. С 10 мол.% (-) - PPY * в хлороформ при –50 ° C наблюдалась селективность от хорошей до очень хорошей при ацилировании аминов, как показано ниже.[12] Аналогичный протокол был разработан для кинетического разрешения индолинов.[13]
Эпоксидирование и дигидроксилирование
В Эпоксидирование по методу Sharpless, разработан К. Барри Шарплесс в 1980 г.[14] был использован для кинетического разделения рацемической смеси аллиловых спиртов.[15][16] Хотя этот метод чрезвычайно эффективен при разделении ряда аллиловых спиртов, он имеет ряд недостатков. Время реакции может достигать 6 дней, и катализатор не подлежит переработке. Тем не менее, кинетическое разрешение асимметричного эпоксидирования по Шарплессу остается одним из наиболее эффективных синтетических кинетических разрешений на сегодняшний день. В качестве катализатора можно использовать ряд различных тартратов; типичная схема показана ниже с использованием диизопропиловый тартрат. Этот метод нашел широкое применение для ряда вторичных аллиловых спиртов.[17]

Асимметричное дигидроксилирование по Шарплесу также видел использование в качестве метода кинетического разрешения.[18][19] Однако этот метод не получил широкого распространения, поскольку одно и то же разрешение может быть достигнуто различными способами, которые являются более экономичными. Кроме того, Эпоксидирование Ши было показано, что влияет на кинетическое разрешение ограниченного набора олефинов.[20] Этот метод также не получил широкого распространения, но представляет механистический интерес.
Эпоксидные отверстия

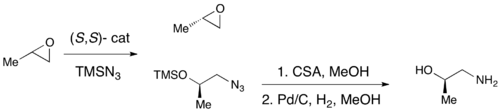
Хотя энантиоселективное эпоксидирование было успешно достигнуто с использованием эпоксидирования Шарплесса, Эпоксидирование Ши, и Эпоксидирование Якобсена, ни один из этих методов не позволяет обеспечить эффективный асимметричный синтез концевых эпоксидов, которые являются ключевыми хиральными строительными блоками. Из-за дешевизны большинства рацемических терминальных эпоксидов и их неспособности обычно подвергаться классическому разделению, эффективное кинетическое разделение терминальных эпоксидов могло бы служить очень важной синтетической методологией. В 1996 году Якобсен с соавторами разработали методологию кинетического разделения эпоксидов посредством нуклеофильного раскрытия кольца с атакой азид-анионом. Показан катализатор (R, R).[21]Катализатор может эффективно при загрузке всего 0,5 мол.% Энантиоселективно раскрывать эпоксид в концевом положении, давая энантиообогащенный исходный эпоксидный материал и 1,2-азидоспирты. Урожайность почти количественная, и ее показатели были превосходными (≥95% почти во всех случаях). Аминоспирты можно гидрогенизировать с получением 1,2-аминоспиртов, как показано ниже.

В 1997 году группа Якобсена опубликовала методологию, которая улучшила их более ранние работы, позволив использовать воду в качестве нуклеофила в эпоксидном отверстии. При использовании почти идентичного катализатора наблюдали ее более 98% как для восстановленного исходного эпоксида, так и для продукта 1,2-диола. В приведенном ниже примере гидролитическое кинетическое разрешение (HKR) было проведено в масштабе 58 грамм, в результате было получено 26 г (44%) энантиорированного эпоксида в> 99% ee и 38 г (50%) диола в 98% ее.[22]
Было исследовано множество других субстратов с выходом восстановленного эпоксида в диапазоне от 36 до 48% для> 99% ее. Гидролитическое кинетическое разрешение Якобсена можно использовать в тандеме с эпоксидированием Якобсена для получения энантиочистых эпоксидов из определенных олефинов, как показано ниже. Первое эпоксидирование дает слегка энантиообогащенный эпоксид, а последующее кинетическое разделение дает, по существу, единственный энантиомер. Преимущество этого подхода заключается в способности уменьшать количество гидролитического расщепления, необходимое для достижения высокой энантиоселективности, что позволяет достичь общих выходов примерно до 90% в пересчете на олефин.[23]
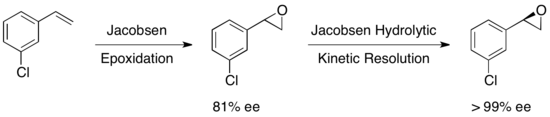
В конечном счете, кинетическое разрешение раскрытия эпоксида Якобсена обеспечивает высокую энантиомерную чистоту эпоксида и продукта в условиях отсутствия растворителей или с низким содержанием растворителей, и их можно использовать в больших масштабах. В частности, метод Якобсена для HKR чрезвычайно привлекателен, поскольку он может быть реализован в многотонном масштабе и использует воду в качестве нуклеофила, что приводит к чрезвычайно рентабельным промышленным процессам. Несмотря на впечатляющие достижения, HKR обычно применялся для разрешения простых терминальные эпоксиды с одним стереоцентром. Совсем недавно Д. А. Деваланкар и соавт. сообщили об элегантном протоколе, включающем два стереоцентрированных сокатализируемого HKR рацемических концевых эпоксидов, несущих соседние C – C связывающие заместители.[24]
Окисления

Рёдзи Ноёри и его коллеги разработали методологию кинетического разделения бензиловых и аллильных вторичных спиртов путем гидрогенизации с переносом. Комплекс рутения катализирует окисление более реактивного энантиомера из ацетон, давая непрореагировавший энантиочистый спирт, окисленный кетон и изопропанол. В примере, проиллюстрированном ниже, воздействие на 1-фенилэтанол (S, S) энантиомера катализатора в присутствии ацетона приводит к выходу 51% для 94% ее (R) -1-фенилэтанола вместе с 49% ацетофенона. и изопропанол как побочный продукт.[25]
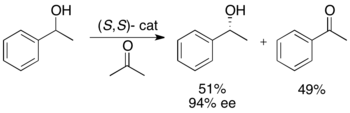
Эта методология, по сути, является противоположностью асимметричного переноса гидрирования кетонов, предложенного Нойори.[26] которые дают путем восстановления энантиообогащенные спирты. Это ограничивает привлекательность метода кинетического разрешения, поскольку существует аналогичный метод для получения тех же продуктов без потери половины материала. Таким образом, кинетическое разделение можно проводить только в том случае, когда рацемический спирт был по крайней мере вдвое дешевле кетона или был значительно более доступным.


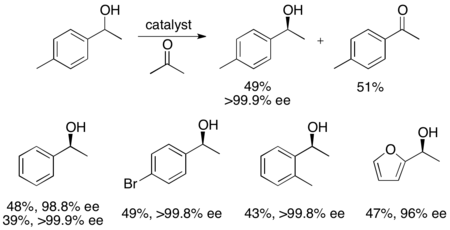
Кроме того, Уэмура и Хидаи разработали рутениевый катализатор для окисления бензиловых спиртов с кинетическим разрешением, в результате чего получают высокоэнантиообогащенные спирты с хорошими выходами.[27]Комплекс может, как катализатор Нойори, влиять на гидрогенизацию переноса между кетоном и изопропанолом с образованием энантиообогащенного спирта, а также влиять на кинетическое разрешение рацемического спирта, давая энантиочистый спирт (> 99% ее) и окисленный кетон с ацетоном в качестве побочного продукта. . Он очень эффективен при энантиоселективном восстановлении кетонов, давая большинство бензиловых спиртов с э.и.> 99% и может растворять ряд рацемических бензиловых спиртов с получением высоких выходов (до 49%) отдельных энантиомеров, как показано ниже. Этот метод имеет те же недостатки, что и кинетическое разрешение Нойори, а именно то, что к спиртам можно также получить доступ посредством энантиоселективного восстановления кетонов. Кроме того, сообщалось только об одном энантиомере катализатора.
Гидрирование

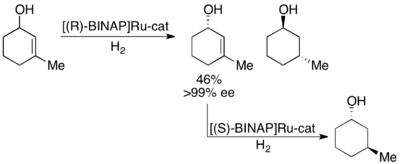
Нойори также продемонстрировал кинетическое разрешение аллиловых спиртов за счет асимметричного гидрирования олефина.[28]Используя комплекс Ru [BINAP], селективное гидрирование может дать высокие ее значения ненасыщенного спирта в дополнение к гидрированному спирту, как показано ниже. Таким образом, второе гидрирование оставшегося энантиообогащенного аллилового спирта даст энантиомерно чистые образцы обоих энантиомеров насыщенного спирта. Noyori разделил ряд аллиловых спиртов с выходом от хорошего до отличного и с ее выходом от хорошего до отличного (до> 99%).
Метатезис замыкания кольца

Ховейда и Шрок разработали катализатор для метатезис замыкающего кольца кинетическое разделение диенилаллиловых спиртов.[29] В молибден алкилиденовый катализатор селективно катализирует один энантиомер для осуществления метатезиса с замыканием цикла, в результате чего получают энантиочистый спирт и энантиочистое замкнутое кольцо, как показано ниже. Катализатор наиболее эффективен при разделении 1,6-диенов. Однако небольшие структурные изменения в субстрате, такие как увеличение расстояния между алкенами до 1,7, иногда могут потребовать использования другого катализатора, что снижает эффективность этого метода.

Ферментативные реакции
Ацилаты
Как и процедуры синтетического кинетического разрешения, кинетическое разрешение ферментативного ацилирования нашло самое широкое применение в синтетическом контексте. Особенно важным было использование ферментативного кинетического разрешения для эффективного и дешевого получения аминокислот. В коммерческом масштабе методология Degussa с использованием ацилаз позволяет разделять многочисленные природные и неприродные аминокислоты. Рацемические смеси можно приготовить с помощью синтеза Штрекера, и использование ацилазы почек свиньи (для субстратов с прямой цепью) или фермента из плесени Aspergillus oryzae (для субстратов с разветвленной боковой цепью) может эффективно давать энантиообогащенные аминокислоты с высоким (85- 90%) выходы. Непрореагировавший исходный материал может быть рацемизирован in situ, что обеспечивает динамическое кинетическое разрешение.[30]

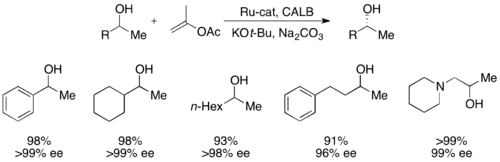
Кроме того, липазы широко используются для кинетического разрешения как в академических, так и в промышленных условиях.[31][32]Липазы использовались для разделения первичных спиртов, вторичных спиртов, ограниченного числа третичных спиртов, карбоновых кислот, диолов и даже хиральных алленов. Липаза из Pseudomonas cepacia (PSL) является наиболее широко используемым для разделения первичных спиртов и использовался с винилацетат в качестве ацилирующего агента для кинетического разделения первичных спиртов, показанных ниже.
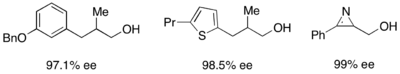
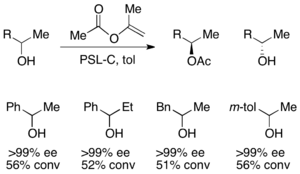
Для разделения вторичных спиртов, липаза pseudomonas cepecia (PSL-C) была эффективно использована для получения отличных ее значений (р) -энантиомер спирта.[33] Использование изопропенилацетата в качестве ацилирующего агента приводит к ацетону в качестве побочного продукта, который эффективно удаляется из реакции с использованием молекулярные сита.
Окисления и восстановления
пекарские дрожжи (BY) был использован для кинетического разделения α-стереогенных карбонильных соединений.[34][35] Фермент избирательно восстанавливает один энантиомер, давая высокоэнантиообогащенный спирт и кетон, как показано ниже.

Пекарские дрожжи также использовались для кинетического разделения вторичных бензиловых спиртов путем окисления.[36] Несмотря на то, что сообщалось об отличном э.и.э. регенерированного спирта, они обычно требуют конверсии> 60%, что приводит к снижению выхода. Пекарские дрожжи также использовались для кинетического разрешения путем восстановления β-кетоэфиров.[37] Однако, учитывая успешное разрешение Нойори тех же субстратов, подробно описанное далее в этой статье, это не нашло большого применения.
Динамическое кинетическое разрешение
Динамическое кинетическое разрешение (DKR) происходит, когда рацемат исходного материала способен легко эпимеризоваться, что приводит к по существу рацемической смеси исходного материала на всех этапах реакции. Тогда энантиомер с более низким барьером активации может теоретически образовываться с выходом до 100%. Это контрастирует со стандартным кинетическим разрешением, которое обязательно имеет максимальный выход 50%. По этой причине динамическое кинетическое разрешение имеет чрезвычайно практическое применение в органическом синтезе. Наблюдаемая динамика основана на Принцип Куртина-Хэммета. Барьер реакции любого энантиомера обязательно выше, чем барьер эпимеризации, в результате чего кинетическая яма содержит рацемат. Это эквивалентно записи для kр> kS,

Был опубликован ряд отличных обзоров, последний из которых - в 2008 году, в которых подробно описываются теория и практическое применение DKR.[38][39][40]
Асимметричное гидрирование Нойори
В Асимметричное гидрирование Нойори кетонов - отличный пример динамического кинетического разрешения в действии. Энантиомерные β-кетоэфиры могут подвергаться эпимеризация и выбор хирального катализатора, обычно в форме Ru [(R) -BINAP] X2, где X - галоген, приводит к тому, что один из энантиомеров реагирует предпочтительно быстрее. Относительная свободная энергия для типичной реакции показана ниже.[41][42] Как можно видеть, промежуточное соединение эпимеризации имеет более низкую свободную энергию, чем переходные состояния для гидрирования, что приводит к быстрой рацемизации и высоким выходам одного энантиомера продукта.
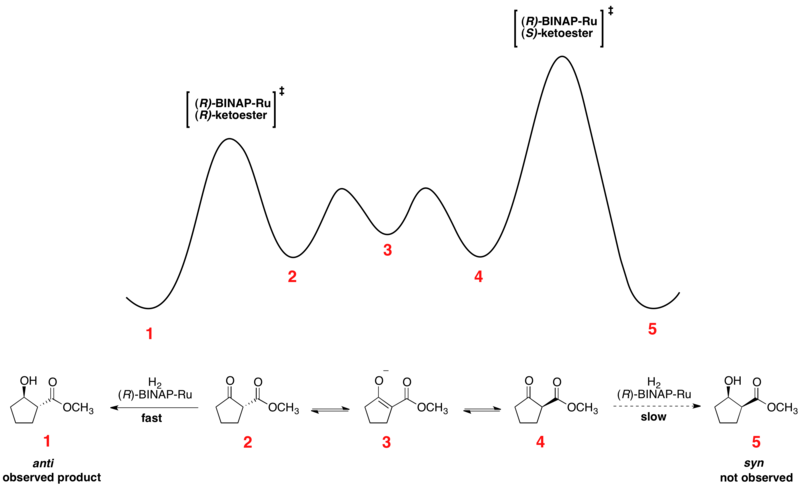
Энантиомеры взаимопревращаются за счет их общих энол, который представляет собой энергетический минимум, расположенный между энантиомерами. Показанная реакция дает 93% ee образца анти продукт, показанный выше. Выбор растворителя, по-видимому, имеет большое влияние на диастереоселективность, поскольку дихлорметан и метанол оба показывают эффективность для определенных субстратов. Нойори и другие также разработали новые катализаторы, которые улучшили как ее, так и диастереомерное соотношение (dr).

Жене и его коллеги разработали СИНФОС, аналог BINAP, который образует комплексы рутения, которые проводят высокоселективное асимметричное гидрирование.[43] Enantiopure Ru [SYNPHOS] Br2 было показано, что они селективно гидрируют рацемические α-амино-β-кетоэфиры до энантиочистых аминоспиртов, как показано ниже, с использованием (R) -SYNPHOS.[44] 1,2-син аминоспирты получали из бензоил защищенные аминосоединения, тогда как анти продукты были приготовлены из гидрохлорид соли амина.

Модификация ацилирования Fu

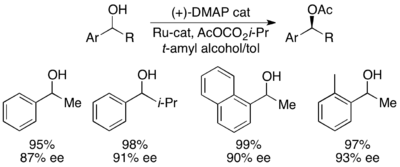
Недавно Грегори Фу и его коллеги сообщили о модификации своей более ранней работы по кинетическому разрешению для получения эффективного динамического кинетического разрешения.[45] Используя катализатор рацемизации рутения, показанный справа, и его планарный хиральный катализатор DMAP, Фу продемонстрировал динамическое кинетическое разрешение вторичных спиртов с выходом до 99% и 93% ее, как показано ниже. Продолжаются работы по дальнейшему развитию приложений широко используемого катализатора DMAP для динамического кинетического разрешения.
Ферментативное динамическое кинетическое разрешение
Сообщалось о ряде ферментативных динамических кинетических разрешений.[46] Яркий пример использования PSL эффективно решает рацемические ацилоины в присутствии триэтиламина и винилацетат в качестве ацилирующего агента.[47] Как показано ниже, продукт был выделен с выходом 75% и ee 97%. Без присутствия основания происходило регулярное кинетическое разрешение, что приводило к выходу 45% ацилированного продукта> 99% ee и 53% исходного материала с 92% ee.
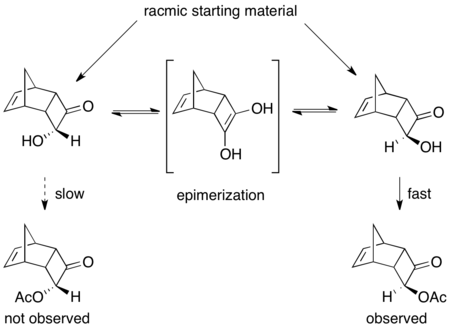
Другой превосходный, хотя и не очень урожайный пример - кинетическое разрешение (±) -8-амино-5,6,7,8-тетрагидрохинолина. При воздействии Candida antarctica липаза B (CALB) в толуол и ацетат этила в течение 3–24 часов происходит нормальное кинетическое разрешение, приводящее к выходу 45% из 97% исходного материала и 45% выходу из ацилированного аминового продукта> 97%. Однако, когда реакционной смеси дают перемешиваться в течение 40–48 часов, извлекается рацемический исходный материал и> 60% ацилированного продукта> 95%.[48]

Здесь непрореагировавший исходный материал рацемизируется. на месте через димерный енамин, что приводит к выходу более чем 50% энантиочистого ацилированного аминного продукта.
Хемоэнзиматическое динамическое кинетическое разрешение
Был опубликован ряд описанных процедур, в которых используется преимущество химического реагента / катализатора для проведения рацемизации исходного материала и фермента для селективной реакции с одним энантиомером, называемых химико-ферментативным динамическим кинетическим разрешением.[49] PSL-C использовали вместе с рутениевым катализатором (для рацемизации) для получения энантиочистых (> 95% ее) δ-гидроксилактонов.[50]

Совсем недавно Бэквалл разрешил вторичные спирты с выходами до 99% и ее до> 99% с использованием CALB и комплекса рацемизации рутения.[51]
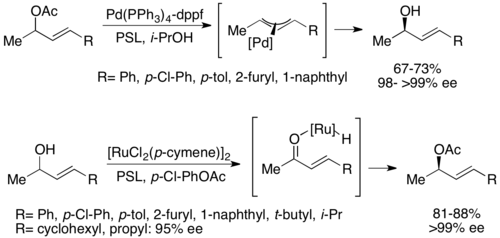
Второй тип хемоферментного динамического кинетического разрешения включает π-аллильный комплекс из аллильного ацетата с палладий. Здесь рацемизация происходит с потерей ацетата с образованием катионного комплекса с центром переходного металла, как показано ниже.[52] Было показано, что палладий облегчает эту реакцию, в то время как рутений влияет на аналогичную реакцию, также показанную ниже.[53]
Параллельное кинетическое разрешение
При параллельном кинетическом разрешении (PKR) рацемическая смесь реагирует с образованием двух неэнантиомерных продуктов, часто совершенно разными путями реакции. С PKR нет компромисса между конверсией и ее, так как образующиеся продукты не являются энантиомерами.[54][55] Одна стратегия PKR заключается в удалении менее реакционноспособного энантиомера (по отношению к желаемому хиральному катализатору) из реакционной смеси, подвергая его второму набору условий реакции, которые предпочтительно реагируют с ним, в идеале с примерно равной скоростью реакции. Таким образом, оба энантиомера потребляются разными путями с одинаковой скоростью. Эксперименты PKR могут быть стереодивергентными, региодергентными или структурно расходящимися.[56] Один из самых эффективных PKR, о котором сообщалось на сегодняшний день, был выполнен Ёсито Киши в 1998 г .; Сокращение CBS рацемического стероидного кетона приводит к стереоселективному восстановлению с образованием двух диастереомеров с ее> 99%, как показано ниже.[57]

PKR также достигается с использованием ферментных катализаторов. Использование грибка Мортиерелла изабеллина NRRL 1757, восстановление рацемических β-кетонитрилов дает два диастереомера, которые можно разделить и повторно окислить с получением высокоэнантиочистых β-кетонитрилов.[58]Однако в высшей степени синтетически полезные параллельные кинетические разрешения еще предстоит открыть. Был обнаружен ряд процедур, которые дают приемлемые ЭИ и выходы, но очень мало примеров, которые дают высокоселективное параллельное кинетическое разрешение, а не просто несколько селективные реакции. Например, параллельное кинетическое разделение 4-алкиналей Фу дает очень энантиообогащенный циклобутанон с низким выходом и слегка энантиообогащенный циклопентенон, как показано ниже.[59]

Теоретически параллельное кинетическое разрешение может дать наивысшие ЭИ продуктов, так как только один энантиомер дает каждый желаемый продукт. Например, для двух взаимодополняющих реакций обе с s = 49, 100% конверсия даст продукты с выходом 50% и ее 96%. Эти же значения потребуют s = 200 для простого кинетического разрешения. Таким образом, обещание PKR продолжает привлекать большое внимание. Сокращение Kishi CBS остается одним из немногих примеров выполнения этого обещания.
Смотрите также
- Хиральные вспомогательные средства
- Синтез хирального пула
- Хиральное разрешение
- Энантиоселективный синтез
Рекомендации
- ^ Fiaud, J.C .; Каган, Х. (1988). «Кинетическое разрешение». В Eliel, E.L .; Вилен, С. (ред.). Темы стереохимии. 18. Нью-Йорк: Джон Вили и сыновья, Inc., стр. 249–340.
- ^ Робинсон, D.E.J.E .; Бык, С. (2005). «Стратегии кинетического разрешения с использованием неферментативных катализаторов». Тетраэдр: асимметрия. 14 (11): 1407–1446. Дои:10.1016 / S0957-4166 (03) 00209-X.
- ^ Пастер, Л. (1858 г.). C. R. Acad. Sci. Париж. 46: 615–618. Отсутствует или пусто
| название =(помощь) - ^ Marckwald, W .; Маккензи, А. (1899). "Ueber eine Principiell neue Methode zur Spaltung racemischer Verbindungen in die activen Bestandtheile" (PDF). Бер. Dtsch. Chem. Ges. 32 (2): 2130–2136. Дои:10.1002 / cber.189903202130.
- ^ Roger, R .; Рид Дж. (1952). "Александр Маккензи: 1869-1951". Уведомления о некрологе членов Королевского общества. 8 (21): 206–228. Дои:10.1098 / rsbm.1952.0014.
- ^ а б Keith, J.M .; Larrow, J. F .; Якобсен, Э. Н. (2001). «Практические соображения в реакциях кинетического разрешения». Adv. Synth. Катал. 343: 5–26. Дои:10.1002 / 1615-4169 (20010129) 343: 1 <5 :: AID-ADSC5> 3.0.CO; 2-I.
- ^ Wurz, R.P .; Ли, E.C .; Рубль, J.C .; Фу, Г. (2007). «Синтез и разделение планарно-хиральных производных 4- (диметиламино) пиридина». Adv. Synth. Катал. 349 (14–15): 2345–2352. Дои:10.1002 / adsc.200700219.
- ^ Рубль, J.C .; Latham, H.A .; Фу, Г. (1997). «Эффективное кинетическое разрешение вторичных спиртов с планарно-хиральным аналогом 4- (диметиламино) пиридина. Использование Fe (C5Ph5) Группа в асимметричном катализе ». Варенье. Chem. Soc. 119 (6): 1492–1493. Дои:10.1021 / ja963835b.
- ^ Рубль, J.C .; Tweddell, J .; Фу, Г. (1998). «Кинетическое разрешение арилакилкарбинолов, катализируемых планарно-хиральным производным DMAP: новый эталон неферментативного ацилирования». J. Org. Chem. 63 (9): 2794–2795. Дои:10.1021 / jo980183w.
- ^ Тао, Б .; Рубль, J.C .; Hoic, D.A .; Фу, Г. (1999). «Неферментативное кинетическое разрешение пропаргиловых спиртов с помощью планарно-хирального производного DMAP: кристаллографическая характеристика ацилированного катализатора». Варенье. Chem. Soc. 121 (21): 2091–5092. Дои:10.1021 / ja9906958.
- ^ Bellemin-Laponnaz, S .; Tweddell, J .; Рубль, J.C .; Breitling, F.M .; Фу, Г. (2000). «Кинетическое разделение аллиловых спиртов с помощью неферментативного катализатора ацилирования; применение к синтезу природных продуктов». Chem. Commun. (12): 2091–5092. Дои:10.1039 / B002041I.
- ^ Arai, S .; Bellemin-Laponnaz, S .; Фу, Г. (2001). «Кинетическое разрешение аминов неферментативным катализатором ацилирования». Энгью. Chem. Int. Эд. 133 (1): 240–242. Дои:10.1002 / 1521-3757 (20010105) 113: 1 <240 :: AID-ANGE240> 3.0.CO; 2-E.
- ^ Arp, F.O .; Фу, Г. (2006). "Кинетическое разрешение инолинов неферментативным катализатором ацилирования". Варенье. Chem. Soc. 128 (44): 14264–14265. Дои:10.1021 / ja0657859. ЧВК 2569996. PMID 17076493.
- ^ Кацуки, Т .; Шарплесс, К.Б. (1980). «Первый практический метод асимметричного эпоксидирования». Варенье. Chem. Soc. 102 (18): 5974–5976. Дои:10.1021 / ja00538a077.
- ^ Martin, V .; Woodard, S .; Кацуки, Т .; Yamada, Y .; Ikeda, M .; Шарплесс, К.Б. (1981). «Кинетическое разделение рацемических аллиловых спиртов энантиоселективным эпоксидированием. Путь к веществам абсолютной энантиомерной чистоты?». Варенье. Chem. Soc. 103 (23): 6237–6240. Дои:10.1021 / ja00410a053.
- ^ Гао, Юнь; Klunder, J.M .; Hanson, R.M .; Masamune, H .; Ko, S.Y .; Шарплесс, К.Б. (1987). «Каталитическое асимметричное эпоксидирование и кинетическое разрешение: модифицированные процедуры, включая дериватизацию in situ». Варенье. Chem. Soc. 109 (19): 5765–5780. Дои:10.1021 / ja00253a032.
- ^ Kitano, Y .; Matsumoto, T .; Сато, Ф. (1988). «Высокоэффективное кинетическое разрешение γ- и β-триметилсилильных вторичных аллильных спиртов с помощью асимметричного эпоксидирования без резкости». Тетраэдр. 44 (13): 4073–4086. Дои:10.1016 / S0040-4020 (01) 86657-6.
- ^ VanNieuwenhze, M.S .; Шарплесс, К.Б. (1993). «Кинетическое разрешение рацемических олефинов посредством асимметричного дигидроксилирования». Варенье. Chem. Soc. 115 (17): 7864–7865. Дои:10.1021 / ja00070a037.
- ^ Кори, E.J .; Noe, M.C .; Гусман-Перес, А. (1995). «Кинетическое разрешение энантиоселективным дигидроксилированием вторичных аллильных 4-метоксибензоатных эфиров с использованием механически сконструированного алкалоидного катализатора из хинного дерева». Варенье. Chem. Soc. 117 (44): 10817–10824. Дои:10.1021 / ja00149a004.
- ^ Lorenz, J.C .; Frohn, M .; Чжоу, X .; Zhang, J.-R .; Tang, Y .; Burke, C .; Ши, Ю. (2005). "Исследования переходного состояния по диоксиран-опосредованному асимметричному эпоксидированию посредством кинетического разрешения и десимметризации". J. Org. Chem. 70 (8): 2904–2911. Дои:10.1021 / jo048217p. PMID 15822948.
- ^ Larrow, J.F .; Schaus, S.E .; Якобсен, Э. (1996). «Кинетическое разрешение концевых эпоксидов посредством высоко региоселективного и энантиоселективного раскрытия кольца с TMSN3. Эффективный каталитический путь к 1,2-аминоспиртам». Варенье. Chem. Soc. 118 (31): 7420–7421. Дои:10.1021 / ja961708 +.
- ^ Tokunaga, M .; Larrow, J.F .; Какиучи, Ф .; Якобсен, Э. (1997). «Асимметричный катализ с водой: эффективное кинетическое разрешение конечных эпоксидов с помощью каталитического гидролиза». Наука. 277 (5328): 936–938. Дои:10.1126 / science.277.5328.936. PMID 9252321.
- ^ Brandes, B.D .; Якобсен, Э. (1997). «Синтез энантиочистого оксида 3-хлорстирола посредством асимметричной последовательности эпоксидирования-гидролитического кинетического разрешения». Тет. Асим. 8 (23): 3927–3933. Дои:10.1016 / S0957-4166 (97) 00568-5.
- ^ Sudalai, A .; Карабал, П.У .; Деваланкар, Д.А. (2013). «Оптически чистые γ-бутиролактоны и сложные эпоксидные эфиры через два стереоцентрированных HKR 3-замещенных сложных эфиров эпокси: формальный синтез (-) - пароксетина, Ro 67-8867 и (+) - эльданолида». Орг. Biomol. Chem. 11 (8): 1280–1285. Дои:10.1039 / c3ob27321k. PMID 23334653.
- ^ Hashiguchi, S .; Fujii, A .; Haack, K.-J .; Matsumura, K .; Икария, Т .; Нойори, Р. (1997). «Кинетическое разрешение рацемических вторичных спиртов с помощью катализированного RuII переноса водорода». Энгью. Chem. Int. Эд. 36 (3): 288–290. Дои:10.1002 / anie.199702881.
- ^ Hashiguchi, S .; Fujii, A .; Takehara, J .; Икария, Т .; Нойори, Р. (1995). «Асимметричное переносное гидрирование ароматических кетонов, катализируемое хиральными комплексами рутения (II)». Варенье. Chem. Soc. 117 (28): 7562–7563. Дои:10.1021 / ja00133a037.
- ^ Nishibayashi, Y .; Takei, I .; Uemura, S .; Хидаи, М. (1999). «Чрезвычайно высокая энантиоселективная окислительно-восстановительная реакция кетонов и спиртов, катализируемых RuCl2 (PPh3) (оксазолинилферроценилфосфин)». Металлоорганические соединения. 18 (12): 2291–2293. Дои:10.1021 / om990210o.
- ^ Китамура, М .; Kasahara, I .; Manabe, K .; Noyori, R .; Такая, Х. (1988). «Кинетическое разделение рацемических аллиловых спиртов гидрированием, катализируемым BINAP-рутением (II)». J. Org. Chem. 53 (3): 708–710. Дои:10.1021 / jo00238a048.
- ^ Hoveyda, A.H .; Шрок, Р.Р. (2001). «Каталитический асимметричный метатезис олефинов». Chem. Евро. J. 7 (5): 945–950. Дои:10.1002 / 1521-3765 (20010302) 7: 5 <945 :: AID-CHEM945> 3.0.CO; 2-3. PMID 11303874.
- ^ Патент США 6656710, Bommarius & Verseck, «Процесс производства аминокислот с использованием рацемазы и ацилата», переданный Degussa AG
- ^ Ghanem, A .; Aboul-Enein, H.Y. (2005). «Применение липаз в кинетическом разрешении рацематов». Хиральность. 17 (1): 1–15. Дои:10.1002 / chir.20089. PMID 15515046.
- ^ «Хиральная технология: промышленный биокатализ со стандартными гидролитическими ферментами». Журнал по специальной химии. 27 (8): 38. 2007.
- ^ Ghanem, A .; Шуриг В. (2003). «Катализируемая липазой необратимая переэтерификация вторичных спиртов с использованием изопропенилацетата» (PDF). Monatshefte für Chemie. 134 (8): 1151–1157. Дои:10.1007 / s00706-003-0025-1.
- ^ Santaniello, E .; Ferraboschi, P .; Grisenti, P .; Manzocchi, A. (1992). «Биокаталитический подход к приготовлению энантиомерно чистых хиральных строительных блоков». Chem. Rev. 92 (5): 1071–1140. Дои:10.1021 / cr00013a016.
- ^ Ticozzi, C .; Занаротти, Антонио (1989). «Энантиоселективное микробное восстановление 5-ацетилизоксазолинов - новый метод стереохимического контроля за сокращением дрожжей». Liebigs Ann. Chem. 1989 (12): 1257–1259. Дои:10.1002 / jlac.198919890299.
- ^ Fantin, G .; Fogagnolo, M .; Медичи, А .; Pedrini, P .; Поли, С. (1993). «Кинетическое разделение 1-арил- и 1-гетероарилэтанолов окислением пекарскими дрожжами». Tetrahedron Lett. 34 (5): 883–884. Дои:10.1016 / 0040-4039 (93) 89039-S.
- ^ Brooks, D.W .; Wilson, M .; Уэбб М. (1987). «Различные ферментные реакции энантиомерной пары: одновременное двойное кинетическое разрешение кетоэфира пекарскими дрожжами». J. Org. Chem. 52 (11): 2244–2248. Дои:10.1021 / jo00387a026.
- ^ Пеллиссье, Х. (2008). «Последние разработки в области динамического кинетического разрешения». Тетраэдр. 64 (8): 1563–1601. Дои:10.1016 / j.tet.2007.10.080.
- ^ Пеллиссье, Х. (2003). «Динамическое кинетическое разрешение». Тетраэдр. 59 (42): 8291–8327. Дои:10.1016 / S0040-4020 (03) 01022-6.
- ^ Уорд, Р. (1995). «Динамическое кинетическое разрешение». Тетраэдр: асимметрия. 6 (7): 1475–1490. Дои:10.1016 / 0957-4166 (95) 00179-С.
- ^ Китамура, М .; Tokunaga, M .; Нойори, Р. (1993). «Количественное выражение динамического кинетического разрешения хирально лабильных энантиомеров: стереоселективное гидрирование 2-замещенных эфиров 3-оксокарбоновых кислот, катализируемое комплексами BINAP-рутений (II)». Варенье. Chem. Soc. 115 (1): 144–152. Дои:10.1021 / ja00054a020.
- ^ Noyori, R .; Икеда, Т .; Окума, Т .; Widhalm, M .; Китамура, М .; Takaya, H .; Akutagawa, S .; Sayo, N .; Сайто Т. (1989). «Стереоселективное гидрирование посредством динамического кинетического разрешения». Варенье. Chem. Soc. 111 (25): 9134–9135. Дои:10.1021 / ja00207a038.
- ^ de Paule, S.D .; Jeulin, S .; Ratovelomanana-Vidal, V .; Genêt, JP .; Чемпион, N .; Деллис, П. (2003). «Исследования синтеза и молекулярного моделирования SYNPHOS®, нового эффективного дифосфанового лиганда для катализируемого рутением асимметричного гидрирования». Евро. J. Org. Chem. 2003 (10): 1931–1941. Дои:10.1002 / ejoc.200200634.
- ^ Mordant, C .; Ratovelomanana-Vidal, V .; Dünkelmann, P .; Жене, Ж.-П. (2004). «Универсальный способ получения син- и анти-α-амино-β-гидроксиэфиров из β-кетоэфиров путем динамического кинетического разрешения с катализатором Ru-SYNPHOS®». Евро. J. Org. Chem. 2004 (14): 3017–3026. Дои:10.1002 / ejoc.200400078.
- ^ Lee, S.Y .; Мерфи, J.M .; Укай, А .; Фу, Г. (2012). «Неферментативное динамическое кинетическое разрешение вторичных спиртов посредством энантиоселективного ацилирования: синтетические и механические исследования». Варенье. Chem. Soc. 134 (36): 15149–15153. Дои:10.1021 / ja307425g. ЧВК 3447740. PMID 22934603.
- ^ Пеллиссье, Х. (2003). «Опосредованная липазой – триэтиламином динамическая переэтерификация трициклического ацилоина, имеющего скрытую мезоструктуру: новый путь к оптически чистому оксодициклопентадиену». Тетраэдр. 59 (42): 8291–9327. Дои:10.1016 / S0040-4020 (03) 01022-6.
- ^ Taniguchi, T .; Огасавара, К. (1997). «Опосредованная липазой – триэтиламином динамическая переэтерификация трициклического ацилоина, имеющего скрытую мезоструктуру: новый путь к оптически чистому оксодициклопентадиену». Химические коммуникации (15): 1399–1400. Дои:10.1039 / A702910A.
- ^ Crawford, J.B .; Skerlj, R.T .; Бриджер, Г.Дж. (2007). «Спонтанное ферментативно опосредованное динамическое кинетическое разрешение 8-амино-5,6,7,8-тетрагидрохинолина». J. Org. Chem. 72 (2): 669–671. Дои:10.1021 / jo062037t. PMID 17221995.
- ^ Pàmies, O .; Bäckvall, J.-E. (2004). «Хемоэнзиматическое динамическое кинетическое разрешение». Тенденции в биотехнологии. 22 (3): 130–135. Дои:10.1016 / j.tibtech.2004.01.005.
- ^ Pàmies, O .; Bäckvall, J.-E. (2002). «Ферментативное кинетическое разрешение и хемоэнзиматическое динамическое кинетическое разрешение δ-гидроксиэфиров. Эффективный путь к хиральным δ-лактонам». J. Org. Chem. 67 (4): 1261–1265. Дои:10.1021 / jo016096c. PMID 11846671.
- ^ Martín-Matute, B .; Един, М .; Bogár, K .; Kaynak, F.B .; Bäckvall, J.-E. (2005). «Комбинированный катализ рутения (II) и липазы для эффективного динамического кинетического разрешения вторичных спиртов. Понимание механизма рацемизации». Варенье. Chem. Soc. 127 (64): 8817–8825. Дои:10.1021 / ja051576x. PMID 15954789.
- ^ Choi, Y.K .; Suh, J.H .; Ли, Д .; Lim, I.T .; Jung, J.Y .; Ким, М.-Дж. (1999). «Динамическое кинетическое разрешение ациклических аллильных ацетатов с использованием липазы и палладия». J. Org. Chem. 64 (22): 8423–8424. Дои:10.1021 / jo990956w. PMID 11674772.
- ^ Ли, Д .; Ха, E.A .; Kim, M.-J .; Jung, H.M .; Koh, J.H .; Парк, Дж. (2000). «Динамическое кинетическое разрешение аллиловых спиртов, опосредованное катализаторами на основе рутения и липазы». Орг. Латыш. 2 (15): 2377–2379. Дои:10.1021 / ol006159y. PMID 10930288.
- ^ Имс, Дж. (2000). «Параллельные кинетические разрешения». Энгью. Chem. Int. Эд. 39 (5): 885–888. Дои:10.1002 / (SICI) 1521-3773 (20000303) 39: 5 <885 :: AID-ANIE885> 3.0.CO; 2-2.
- ^ Dehil, J.R .; Готор, В. (2002). «Параллельное кинетическое разделение рацемических смесей: новая стратегия получения энантиочистых соединений?». Chem. Soc. Rev. 31 (6): 365–370. Дои:10.1039 / B205280F. PMID 12491751.
- ^ Ведейс, Э .; Юре, М. (2005). «Эффективность неферментативного кинетического разрешения». Энгью. Chem. Int. Эд. 44 (5): 3974–4001. Дои:10.1002 / anie.200460842.
- ^ Куросу, М .; Киши, Ю. (1998). «Новый пример оптического разрешения рацемических кетонов, происходящих из синтеза батрахотоксина». J. Org. Chem. 63 (18): 6100–6101. Дои:10.1021 / jo981416m. PMID 11672234.
- ^ Dehil, J.R .; Готор, В. (2002). «Получение энантиочистых кетонов и спиртов, содержащих четвертичный стереоцентр, посредством параллельного кинетического разрешения β-кетонитрилов». J. Org. Chem. 67 (5): 1716–1718. Дои:10.1021 / jo011092t. PMID 11871913.
- ^ Tanaka, K .; Фу, Г. (2003). «Параллельное кинетическое разрешение 4-алкиналов, катализируемых Rh (I) / Tol-BINAP: синтез энантиообогащенных циклобутанонов и циклопентенонов». Варенье. Chem. Soc. 125 (27): 8078–8079. Дои:10.1021 / ja035489l. PMID 12837058.
дальнейшее чтение
- Динамическое кинетическое разрешение. Встреча группы MacMillan. Джейк Винер Связь
- Динамическое кинетическое разрешение: мощный подход к асимметричному синтезу. Заседание супергруппы Эрика Алексаняна 30 марта 2005 г. Связь
- Динамическое кинетическое разрешение: практическое применение в синтезе. Семинар Валери Келлер, 3-й курс, 1 ноября 2001 г. Связь
- Кинетическое разрешение. Литературный семинар группы Дэвида Эбнера Штольца. 4 июня 2003 г. связь
- Кинетические разрешения. Юго-западное представление UT. связь






![[S] = {гидроразрыв {(1 + ee) (1-c)} {2}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bedb0ada89fbba54020c618907425dc858a2591b)
![[R] = {гидроразрыв {(1-ee) (1-c)} {2}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1a61e8391de522b72a3580bd1214d5112057d741)

![{frac {d [S]} {dt}} = - k_ {S} [S] [B ^ {*}] подразумевает log [S] = - k_ {S} [B ^ {*}] t + log S_ {0}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0cb65f6ee0307b80ab311cb9d09726947bd97ac1)
![{displaystyle s = {k_ {R}} {k_ {S}}} = {frac {log [R] -log R_ {0}} {log [S] -log S_ {0}}} = {frac {log [(1-c) (1-ee)] + log {frac {1} {2}} - log R_ {0}} {log [(1-c) (1 + ee)] + log {frac {1} {2}} - журнал S_ {0}}} = {frac {log [(1-c) (1-ee)]} {log [(1-c) (1 + ee)]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/156b26edecc36af36374614253bb2842be3e550b)
![ee '' = {frac {[R '] - [S']} {[R '] + [S']}} = {frac {ee (1-c)} {c}} подразумевает ee = ee '' {гидроразрыв {c} {1-c}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0876f7366b97d07d9a002cb750fdb1a42ca25448)




![{displaystyle s = {frac {log [1-c (1 + ee '')]} {log [1-c (1-ee '')]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6d142162d7ab054c445d0ee122e6ed2b2880103a)
![{frac {d [S]} {dt}} = - k_ {S} [S] подразумевает S = {frac {1} {2}} e ^ {{- k_ {S} t}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8fcf79858e21ac5c20f56338e038c1a28e2b6e77)
![ee = {гидроразрыв {[S] - [R]} {[S] + [R]}} = {гидроразрыв {e ^ {{- k_ {S} t}}} - e ^ {{- k_ {R} t }}} {е ^ {{- k_ {S} t}} + e ^ {{- k_ {R} t}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/537dcb1d65d95eea71ade3ed04fb39937e993fb2)
![c = 1- {ig (} [S] - [R] {ig)} = 1- {frac {e ^ {{- k_ {S} t}} + e ^ {{- k_ {R} t}} } {2}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/002346d2f288670c618bfcddfabc48db5fe6a46b)

