Асимметричное дигидроксилирование по Шарплесу - Sharpless asymmetric dihydroxylation
| Асимметричное дигидроксилирование по Шарплесу | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Названный в честь | Карл Барри Шарплесс | ||||||||||
| Тип реакции | Реакция сложения | ||||||||||
| Реакция | |||||||||||
| |||||||||||
| Идентификаторы | |||||||||||
| Портал органической химии | дигидроксилирование без резкости | ||||||||||
| RSC ID онтологии | RXNO: 0000142 | ||||||||||
Асимметричное дигидроксилирование Шарплесса (также называемый Бишидроксилирование по методу Sharpless) это химическая реакция из алкен с четырехокись осмия в присутствии хиральный хинин лиганд сформировать вицинальный диол. Реакция применялась к алкенам практически любого замещения, часто реализуется высокая энантиоселективность. Реакции асимметричного дигидроксилирования также являются высокоселективными, обеспечивая продукты, полученные в результате реакции наиболее богатой электронами двойной связи в субстрате.[1][2][3]
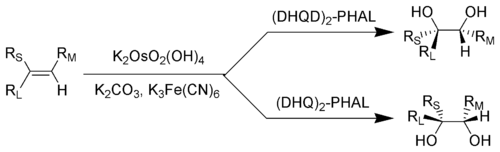
рL = Наибольший заместитель; рM = Заместитель среднего размера; рS = Наименьший заместитель
Обычно эту реакцию проводят с использованием каталитического количества четырехокиси осмия, которое после реакции регенерируется с реоксиданты такие как феррицианид калия[4][5] или N-метилморфолин N-окись.[6][7] Это резко снижает количество очень токсичный и необходим очень дорогой четырехокись осмия. Эти четыре реагента коммерчески доступны в виде предварительно смешанных ("AD-смесь "). Смесь, содержащая (DHQ)2-PHAL называется AD-mix-α, а смесь, содержащая (DHQD)2-PHAL называется AD-mix-β.[8]
Такие хиральные диолы важны для органический синтез. Введение хиральности в нехиральную реагенты через использование хирального катализаторы это важная концепция в органический синтез. Эта реакция была разработана главным образом К. Барри Шарплесс на основе уже известного рацемического Дигидроксилирование Апджона, за что ему была присуждена акция 2001 г. Нобелевская премия по химии.
Фон
Дигидроксилирование алкена четырехокись осмия это старый и чрезвычайно полезный метод функционализации олефинов. Однако, поскольку осмий (VIII) реагенты подобно четырехокись осмия (OsO4) являются дорогостоящими и чрезвычайно токсичными, возникла потребность в разработке каталитических вариантов этой реакции. Некоторые стехиометрические концевые окислители, которые использовались в этих каталитических реакциях, включают хлорат калия, пероксид водорода (Гидроксилирование Миласа ), N-Метилморфолин N-окись (НМО, Дигидроксилирование Апджона ), терт-бутилгидропероксид (тBHP), и феррицианид калия (K3Fe (CN)6). К. Барри Шарплесс первым разработал генеральную, надежную энантиоселективный дигидроксилирование алкена, называемое асимметричным дигидроксилированием Шарплесса (САД). Низкий уровень OsO4 сочетаются со стехиометрическим феррицианидным окислителем в присутствии хиральных азотистых лигандов для создания асимметричной среды вокруг окислителя.
Механизм реакции
Механизм реакции дигидроксилирования Шарплесса начинается с образования комплекса тетроксид осмия - лиганд (2). [3 + 2] -циклоприсоединение к алкену (3) дает циклический промежуточный 4.[9][10] Базовый гидролиз высвобождает диол (5) и восстановленный осмат (6). Метансульфонамид (CH3ТАК2NH2) был идентифицирован как катализатор для ускорения этого этапа каталитического цикла и, если его часто используют в качестве добавки, позволяющей субстратам, не являющимся концевыми алкенами, эффективно реагировать при 0 ° C.[8] Наконец, стехиометрический окислитель регенерирует комплекс тетроксид осмия - лиганд (2).
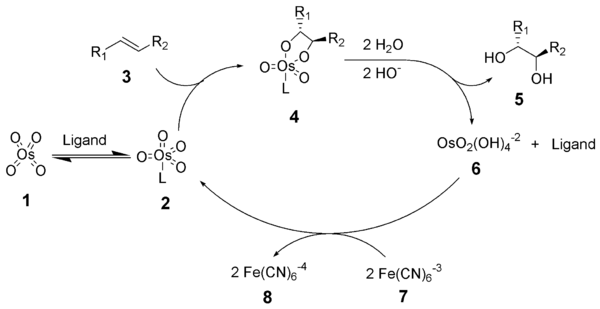
Механизм асимметричного дигидроксилирования Шарплесса был тщательно изучен, и был идентифицирован потенциальный вторичный каталитический цикл (см. Ниже).[11][12] Если промежуточное соединение сложного эфира осмилата окисляется до его диссоциации, то образуется комплекс осмий (VIII) -диол, который затем может дигидроксилировать другой алкен.[13] Дигидроксилирование, возникающее в результате этого вторичного пути, обычно страдает более низкой энантиоселективностью, чем те, которые возникают в результате первичного пути. Схема, показывающая этот вторичный каталитический путь, показана ниже. Этот вторичный путь можно подавить, используя более высокую молярную концентрацию лиганда.

[2 + 2] против [3 + 2] дебаты
В своем первоначальном отчете Шарплесс предположил, что реакция прошла через [2 + 2] циклоприсоединение ОсО4 на алкен с получением промежуточного соединения осмаоксетана (см. ниже).[14] Этот промежуточный продукт затем подвергнется 1,1- миграционная вставка с образованием сложного эфира осмилата, который после гидролиза дает соответствующий диол. В 1989 г. Э. Дж. Кори опубликовал несколько иной вариант этой реакции и предположил, что реакция, скорее всего, протекает через [3 + 2] циклоприсоединение OsO.4 с алкеном для прямого образования сложного эфира осмилата.[15] Предложение Кори было основано на предыдущем вычислительном исследовании, проведенном Йоргенсеном и Хоффманом, в котором было определено, что путь реакции [3 + 2] является путем с меньшей энергией. Вдобавок Кори пришел к выводу, что стерическое отталкивание в октаэдрическом промежуточном звене будет неблагоприятным для пути [2 + 2].

В следующие десять лет Кори и Шарплесс опубликовали множество публикаций, каждая из которых поддерживала свою версию механизма. Хотя эти исследования не смогли провести различие между двумя предложенными путями циклизации, они успешно пролили свет на механизм другими способами. Например, Шарплесс представил доказательства того, что реакция протекает по ступенчатому механизму.[16] Кроме того, как Шарплесс, так и Кори показали, что активный катализатор обладает U-образным хиральным связывающим карманом.[17][18][19] Кори также показал, что катализатор подчиняется кинетике Михаэлиса-Ментен и действует как ферментный карман с предварительным равновесием.[20] В февральском выпуске журнала Американского химического общества за 1997 г. Шарплесс опубликовал результаты исследования (анализ Хаммета), которые, как он утверждал, подтверждали [2 + 2] циклизацию над [3 + 2].[21] Однако в октябрьском выпуске того же года Шарплесс также опубликовал результаты другого исследования, проведенного в сотрудничестве с Кеном Хоуком и Синглтоном, которое предоставило убедительные доказательства механизма [3 + 2].[10] Таким образом, Шарплес был вынужден уступить десятилетним дебатам.
Структура катализатора

Кристаллографические данные показали, что активный катализатор содержит пентакоординированные частицы осмия, удерживаемые в U-образном связующем кармане. Азотистый лиганд содержит OsO4 в хиральной среде приближение одной стороны олефина к стерически затруднено, а другая - нет.[20]
Каталитические системы
Для САД были разработаны многочисленные каталитические системы и модификации. Ниже приводится краткий обзор различных компонентов каталитической системы:
- Каталитический окислитель: это всегда OsO.4Однако некоторые добавки могут координироваться с осмием (VIII) и изменять его электронные свойства. OsO4 часто генерируется на месте из K2OsO2(ОЙ)4 (разновидность Os (VI)) из соображений безопасности.
- Хиральный вспомогательный компонент: обычно это какой-то алкалоид хинного дерева.
- Стехиометрический оксидант:
- Пероксиды были одними из первых стехиометрических окислителей, которые использовались в этом каталитическом цикле; увидеть Гидроксилирование Миласа. К недостаткам пероксидов относятся проблемы с хемоселективностью.[13]
- N-оксиды триалкиламмония, такие как NMO, как в Реакция Апджона - и N-оксид триметиламина.[13]
- Феррицианид калия (K3Fe (CN)6) является наиболее часто используемым стехиометрическим окислителем для реакции и является окислителем, который входит в коммерчески доступные препараты AD-mix.
- Добавка:
- Лимонная кислота: тетроксид осмия является электрофильным окислителем и поэтому медленно реагирует с электронодефицитными олефинами. Было обнаружено, что скорость окисления электронодефицитных олефинов может быть увеличена путем поддержания pH реакции слабокислой.[13] С другой стороны, высокий pH может увеличить скорость окисления внутренних олефинов, а также увеличить энантиомерный избыток (e.e.) для окисления концевых олефинов.[13]
Региоселективность
В общем, асимметричное дигидроксилирование по Шарплесу способствует окислению более богатого электронами алкена (схема 1).[22]
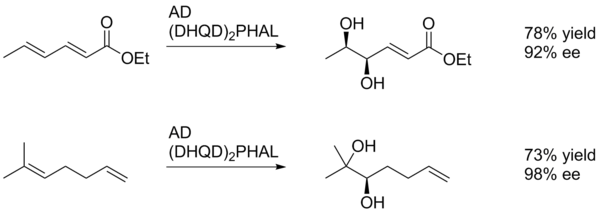
В этом примере SAD дает диол алкена, ближайшего к (электроноакцепторной) пара-метоксибензоильной группе, хотя и с низким выходом. Вероятно, это связано со способностью арильного кольца благоприятно взаимодействовать с активным центром катализатора посредством π-стопки. Таким образом, арильный заместитель может действовать как направляющая группа.[23]

Стереоселективность
Диастереоселективность SAD устанавливается в первую очередь выбором лиганда (т.е. AD-mix-α по сравнению с AD-mix-β), однако такие факторы, как ранее существовавшая хиральность в субстрате или соседние функциональные группы, также могут играть роль. В примере, показанном ниже, пара-метоксибензоильный заместитель служит главным образом источником стерической массы, позволяющей катализатору различать две грани алкена.[23]

Часто бывает трудно получить высокую диастереоселективность цис-алкенов, когда обе стороны олефина имеют сходные стерические среды.
дальнейшее чтение
- Jacobsen, E. N .; Марко, I .; Mungall, W. S .; Schroeder, G .; Шарплесс, К. (1988). «Асимметричное дигидроксилирование с помощью лиганд-ускоренного катализа». Варенье. Chem. Soc. 110 (6): 1968–1970. Дои:10.1021 / ja00214a053.
Смотрите также
- Асимметричное каталитическое окисление
- Гидроксилирование Миласа
- Дигидроксилирование Апджона
- Аминогидроксилирование по Шарплесу
использованная литература
- ^ Noe, Mark C .; Letavic, Michael A .; Сноу, Шери Л. (15 декабря 2005 г.). «Асимметричное дигидроксилирование алкенов». Орг. Реагировать. 66 (109): 109–625. Дои:10.1002 / 0471264180.or066.02. ISBN 0471264180.
- ^ Kolb, H.C .; Van Nieuwenhze, M. S .; Шарплесс, К. (1994). «Каталитическое асимметричное дигидроксилирование». Chem. Ред. 94 (8): 2483–2547. Дои:10.1021 / cr00032a009.
- ^ Гонсалес, Хавьер; Ауригемма, Кристина; Трусдейл, Ларри (2004). "Синтез (+) - (1S,2р) - и (-) - (1р,2S)-транс-2-фенилциклогексанол с помощью асимметричного дигидроксилирования Шарплесса (AD) ». Органический синтез. 79: 93. Дои:10.15227 / orgsyn.079.0093.
- ^ Минато, М .; Ямамото, К .; Цудзи, Дж. (1990). «Тетраоксид осмия катализирует вицинальное гидроксилирование высших олефинов с использованием иона гексацианоферрата (III) в качестве сооксиданта». J. Org. Chem. 55 (2): 766–768. Дои:10.1021 / jo00289a066.
- ^ Oi, R .; Шарплесс, К. (1996). "3-[(1S) -1,2-дигидроксиэтил] -1,5-дигидро-3ЧАС-2,4-бензодиоксепин ». Органический синтез. 73: 1. Дои:10.15227 / orgsyn.073.0001.; Коллективный объем, 9, п. 251
- ^ VanRheenen, V .; Kelly, R.C .; Ча, Д. Ю. (1976). "Улучшенный каталитический OsO4 окисление олефинов до СНГ-1,2-гликоли с использованием оксидов третичных аминов в качестве окислителя ». Tetrahedron Lett. 17 (23): 1973–1976. Дои:10.1016 / s0040-4039 (00) 78093-2.
- ^ McKee, B.H .; Gilheany, D. G .; Шарплесс, К. (1992). "(р,р) -1,2-Дифенил-1,2-этандиол (Стилбендиол) ». Органический синтез. 70: 47. Дои:10.15227 / orgsyn.070.0047.; Коллективный объем, 9, п. 383
- ^ а б Шарплесс, К.; Амберг, Вилли; Bennani, Youssef L .; и другие. (1992). «Асимметричное дигидроксилирование, катализируемое осмием: новый класс лигандов и улучшение процесса». J. Org. Chem. 57 (10): 2768–2771. Дои:10.1021 / jo00036a003.
- ^ Кори, Э.Дж.; Noe, M.C .; Гроган, М. Дж. (1996). «Экспериментальное испытание путей [3 + 2] - и [2 + 2] -циклоприсоединения для дигидроксилирования олефинов, катализируемого бис-хинным алкалоидом-OsO4, с помощью кинетических изотопных эффектов». Tetrahedron Lett. 37 (28): 4899–4902. Дои:10.1016/0040-4039(96)01005-2.
- ^ а б DelMonte, A.J .; Haller, J .; Хоук, К.; Шарплесс, К.; Синглтон, Д. А .; Strassner, T .; Томас, А.А. (1997). «Экспериментальные и теоретические кинетические эффекты изотопов для асимметричного дигидроксилирования. Доказательства, подтверждающие ограничение скорости» (3 + 2) «Циклоприсоединение». Варенье. Chem. Soc. 119 (41): 9907–9908. Дои:10.1021 / ja971650e.
- ^ Огино, Ю .; Chen, H .; Kwong, H.-L .; Шарплесс, К. Б. (1991). «О времени гидролиза / повторного окисления в катализируемом осмием асимметричном дигидроксилировании олефинов с использованием феррицианида калия в качестве реоксиданта». Tetrahedron Lett. 3 (2): 3965–3968. Дои:10.1016/0040-4039(91)80601-2.
- ^ Wai, J. S. M .; Марко, I .; Svendsen, J. N .; Finn, M. G .; Jacobsen, E. N .; Шарплесс, К. Барри (1989). «Механическое понимание приводит к значительно усовершенствованному процессу асимметричного дигидроксилирования, катализируемого осмием». Варенье. Chem. Soc. 111 (3): 1123. Дои:10.1021 / ja00185a050.
- ^ а б c d е Сандермайер, У., Доблер, К., Беллер, М. Последние разработки в области дигидроксилирования олефинов, катализируемого осмием. Современные методы окисления. 2004 WILEY-VCH Verlag GmbH & Co. KGaA, Вайнхайм. ISBN 3-527-30642-0
- ^ Hentges, Стивен Дж .; Шарплесс, К. Барри (июнь 1980 г.). «Асимметричная индукция в реакции четырехокиси осмия с олефинами». Варенье. Chem. Soc. 102 (12): 4263. Дои:10.1021 / ja00532a050.
- ^ Кори, Э. Дж .; DaSilva Jardine, Пол; Верджил, Скотт; Юэнь, По Вай; Коннелл, Ричард Д. (декабрь 1989 г.). «Энантиоселективное вицинальное гидроксилирование концевых и E-1,2-дизамещенных олефинов с помощью хирального комплекса тетроксида осмия. Эффективная система управления и рациональная механистическая модель». Варенье. Chem. Soc. 111 (26): 9243. Дои:10.1021 / ja00208a025.
- ^ Thomas, G .; Шарплесс, К. Б. ACIEE 1993, 32, 1329
- ^ Кори, Э. Дж .; Ноэ, Марк К. (декабрь 1993 г.). «Жесткий и высокоэнантиоселективный катализатор дигидроксилирования олефинов с использованием тетраоксида осмия проясняет происхождение энантиоспецифичности». Варенье. Chem. Soc. 26 (115): 12579. Дои:10.1021 / ja00079a045.
- ^ Kolb, H.C .; Андерсон, П.Г .; Шарплесс, К. Б. (февраль 1994 г.). «К пониманию высокой энантиоселективности асимметричного дигидроксилирования (AD), катализируемого осмием. 1. Кинетика». Варенье. Chem. Soc. 116 (1278): 1278. Дои:10.1021 / ja00083a014.
- ^ Кори, Э. Дж .; Noe, Mark C .; Саршар, Сепер (1994). «Рентгеновские кристаллографические исследования предоставляют дополнительные доказательства того, что ферментоподобный связывающий карман имеет решающее значение для энантиоселективного дигидроксилирования олефинов комплексами OsO4-бис-хинный алкалоид». Буквы Тетраэдра. 35 (18): 2861. Дои:10.1016 / s0040-4039 (00) 76644-5.
- ^ а б Кори, Э. Дж .; Ноэ, М.С. (17 января 1996 г.). «Кинетические исследования предоставляют дополнительные доказательства того, что ферментоподобный связывающий карман имеет решающее значение для высокой энантиоселективности в асимметричном дигидроксилировании олефинов, катализируемом бис-хинными алкалоидами». Варенье. Chem. Soc. 118 (2): 319. Дои:10.1021 / ja952567z.
- ^ Шарплесс, К. Б .; Гипсер, Андреас; Хо Пуй Тонг; Кольб, Хартмут С .; Кондо, Теруюки; Квонг, Хой-Лун; McGrath, Dominic V .; Рубин, А. Эрик; Норрби, Пер-Ола; Гейбл, Кевин П .; Шарплесс, К. Барри (1997). «К пониманию высокой энантиоселективности асимметричного дигидроксилирования, катализируемого осмием. 4. Электронные эффекты в ускоренном амином осмилировании». Варенье. Chem. Soc. 119 (8): 1840. Дои:10.1021 / ja961464t.
- ^ Xu, D .; Crispino, G.A .; Шарплесс, К. Б. (сентябрь 1992 г.). «Селективное асимметричное дигидроксилирование (АД) диенов». Варенье. Chem. Soc. 114 (19): 7570–7571. Дои:10.1021 / ja00045a043.
- ^ а б Кори, Э. Дж .; Гусман-Перес, Ангел; Ноэ, Марк К. (ноябрь 1995 г.). «Применение механистической модели приводит к распространению асимметричного дигидроксилирования Шарплесса на аллильные 4-метоксибензоаты и конформационно родственные производные амина и гомоаллилового спирта». Варенье. Chem. Soc. 117 (44): 10805–10816. Дои:10.1021 / ja00149a003.
