Кобальтоцен - Cobaltocene
| |||
| Имена | |||
|---|---|---|---|
| Имена ИЮПАК Кобальтоцен Бис(η5-циклопентадиенил) кобальт | |||
| Другие имена Cp2Co | |||
| Идентификаторы | |||
3D модель (JSmol ) | |||
| ЧЭБИ | |||
| ChemSpider | |||
| ECHA InfoCard | 100.013.692 | ||
| Номер ЕС |
| ||
PubChem CID | |||
| Номер RTECS |
| ||
| UNII | |||
| |||
| |||
| Характеристики | |||
| [Co (η5-C5ЧАС5)2] | |||
| Молярная масса | 189,12 г / моль | ||
| Внешность | Темно-фиолетовое твердое вещество | ||
| Температура плавления | 171–173 ° С (340–343 ° F, 444–446 К) | ||
| Нерастворимый | |||
| Структура | |||
| бутерброд | |||
| нуль | |||
| Термохимия | |||
Стандартный моляр энтропия (S | 236 Дж К−1 моль−1 | ||
Станд. Энтальпия формирование (ΔжЧАС⦵298) | +237 кДж / моль (неточно) | ||
Станд. Энтальпия горение (ΔcЧАС⦵298) | −5839 кДж / моль | ||
| Опасности | |||
| Паспорт безопасности | Внешний SDS | ||
| Пиктограммы GHS |   [1] [1] | ||
| Сигнальное слово GHS | Опасность[1] | ||
| H228, H317, H351[1] | |||
| P210, P261, P280, P363, P405, P501[1] | |||
| NFPA 704 (огненный алмаз) | |||
| Родственные соединения | |||
Связанный металлоцены | Ферроцен Никелоцен Родоцен | ||
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Кобальтоцен, известный также как бис (циклопентадиенил) кобальт (II) или даже «бис Cp кобальт», является кобальтовое соединение с формулой Co (C5ЧАС5)2. Это темно-пурпурное твердое вещество, которое легко возгоняется при температуре немного выше комнатной. Кобальтоцен был открыт вскоре после ферроцен, первый металлоцен. Из-за легкости, с которой он реагирует с кислородом, с этим соединением необходимо обращаться и хранить, используя безвоздушные методы.
Синтез

Кобальтоцен получают по реакции циклопентадиенид натрия (NaC5ЧАС5) с безводным хлорид кобальта (II) в THF решение. Хлорид натрия генерируется совместно, а металлоорганический продукт обычно очищается вакуумная сублимация.[2]
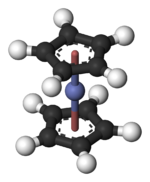
Структура и склеивание
In Co (C5ЧАС5)2 центр Co "зажат" между двумя циклопентадиенил (Cp) кольца. Длина связи Co – C составляет около 2,1 Å, что немного больше, чем длина связи Fe – C в ферроцене.[3]
Co (C5ЧАС5)2 принадлежит к группе металлоорганических соединений, называемых металлоцены или сэндвич-смеси.[4] Кобальтоцен имеет 19 валентных электронов, что на один больше, чем обычно в комплексах органических переходных металлов, таких как его очень стабильный относительный ферроцен. (Видеть 18-электронное правило.) Этот дополнительный электрон занимает орбиталь, которая разрывает связи по отношению к связям Co – C. Следовательно, расстояния Co – C немного длиннее, чем связи Fe – C в ферроцене. Многие химические реакции Co (C5ЧАС5)2 характеризуются его тенденцией терять этот «лишний» электрон с образованием 18-электронного катиона, известного как кобальтоцений:
В остальном близкий родственник кобальтоцена, родоцен не существует как мономер, но спонтанно димеризуется путем образования связи C – C между кольцами Cp.
Реакции
Редокс-свойства
Co (C5ЧАС5)2 является обычным одноэлектронным восстановителем в лаборатории.[5] Фактически обратимость Co (C5ЧАС5)2 редокс пара настолько хорошо себя ведет, что Co (C5ЧАС5)2 может использоваться в циклическая вольтамперометрия как внутренний стандарт. Его перметилированный аналог декаметилкобальтоцен (Co (C5Мне5)2) является особенно мощным восстанавливающим агентом из-за индуктивной передачи электронной плотности от 10 метильных групп, побуждая кобальт отдавать свой «лишний» электрон еще в большей степени. Эти два соединения являются редкими примерами восстановителей, растворяющихся в неполярных органических растворителях. В потенциалы восстановления из этих соединений следует, используя ферроцен-ферроцений пара как ссылка:
| Половина реакции | E0 (V) |
|---|---|
| Fe (C 5ЧАС 5)+ 2 + е− ⇌ Fe (C5ЧАС5)2 | 0,00 (по определению) |
| Fe (C 5Мне 5)+ 2 + е− ⇌ Fe (C5Мне5)2 | −0.59 |
| Co (C 5ЧАС 5)+ 2 + е− ⇌ Co (C5ЧАС5)2 | −1.33 |
| Co (C 5Мне 5)+ 2 + е− ⇌ Co (C5Мне5)2 | −1.94 |
Данные показывают, что декаметильные соединения восстанавливают примерно на 600 мВ больше, чем исходные металлоцены. Однако этот эффект заместителя затмевается влиянием металла: переход с Fe на Co делает восстановление более благоприятным более чем на 1,3 вольт.
Карбонилирование
Лечение Co (C5ЧАС5)2 с монооксид углерода дает производную кобальта (I) Co (C5ЧАС5) (CO)2, одновременно с потерей одного лиганда Cp. Это преобразование проводится при температуре около 130 ° C при давлении CO 500 фунтов на квадратный дюйм.[2][6]
Смотрите также
Рекомендации
- ^ а б c d «Бис (циклопентадиенил) кобальт (II)». Американские элементы. Получено 2018-08-24.
- ^ а б Кинг, Р. Б. (1965). Металлоорганические синтезы. 1. Нью-Йорк, Нью-Йорк: Academic Press.
- ^ Антипин, М.Ю .; Boese, R .; Augart, N .; Шмид, Г. (1993). «Повторное определение кристаллической структуры кобальтоцена при 100 К и 297 К: Сравнение с ферроценом и никелоценом». Struct. Chem. 4 (2): 91–101. Дои:10.1007 / BF00677370.
- ^ Elschenbroich, C .; Зальцер, А. (1992). Металлоорганические соединения: краткое введение (2-е изд.). Вайнхайм: Wiley-VCH. ISBN 978-3-527-28165-7.
- ^ Коннелли, Н.Г .; Гейгер, В. Э. (1996). «Химические окислительно-восстановительные агенты для металлоорганической химии». Chem. Ред. 96 (2): 877–910. Дои:10.1021 / cr940053x. PMID 11848774.
- ^ King, R. B .; Стоун, Ф. Г. А. (1967). «Циклопентадиенильные карбонилы металлов и некоторые производные». Неорганические синтезы. 7: 99–115. Дои:10.1002 / 9780470132388.ch31. ISBN 9780470132388.