Пентасульфид фосфора - Phosphorus pentasulfide
 | |
 | |
| Имена | |
|---|---|
| Другие имена сульфид фосфора фосфид серы персульфид фосфора пентасульфид дифосфора декасульфид тетрафосфора декасульфид фосфора | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ChemSpider | |
| ECHA InfoCard | 100.013.858 |
| Номер ЕС |
|
PubChem CID | |
| Номер RTECS |
|
| UNII | |
| |
| |
| Характеристики | |
| п2S5 или димер P4S10 | |
| Молярная масса | 222,27 г моль |
| Внешность | твердое вещество от зеленовато-серого до желтого[1] |
| Запах | тухлые яйца[1] |
| Плотность | 2,09 г / см3 |
| Температура плавления | 288 ° С (550 ° F, 561 К) |
| Точка кипения | 514 ° С (957 ° F, 787 К) |
| гидролизует | |
| Растворимость в других растворителях | 0,222 г / 100г CS2 (при 17 ° C) Не растворим в C6ЧАС6 Нерастворим в горячем ксилоле Нерастворим в горячем анизол. |
| Давление газа | 1 мм рт. Ст. (300 ° C)[1] |
| Структура | |
| триклинический, AP28 | |
| П-1, №2 | |
| Тd | |
| Опасности | |
| Смертельная доза или концентрация (LD, LC): | |
LD50 (средняя доза ) | 389 мг / кг (перорально, крыса)[2] |
| NIOSH (Пределы воздействия на здоровье в США): | |
PEL (Допустимо) | TWA 1 мг / м3[1] |
REL (Рекомендуемые) | TWA 1 мг / м3 СТ 3 мг / м3[1] |
IDLH (Непосредственная опасность) | 250 мг / м3[1] |
| Родственные соединения | |
Родственные соединения | п4S3 |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Пентасульфид фосфора это неорганическое соединение с формулой п2S5 или димер P4S10. Это желтое твердое вещество - одно из двух сульфиды фосфора коммерческой ценности. Образцы часто выглядят зеленовато-серыми из-за примесей. Он растворим в сероуглероде, но реагирует со многими другими растворителями, такими как спирты, ДМСО и ДМФ.[3]
Структура и синтез
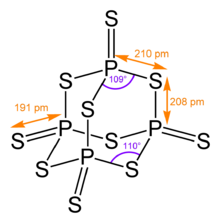
Его четырехгранный молекулярная структура аналогична структуре адамантан и практически идентична структуре пятиокись фосфора.[4]
Пентасульфид фосфора получают по реакции жидкого белый фосфор (П4) с сера выше 300 ° C. Первый синтез P4S10 к Берцелиус в 1843 г. [5][6] было этим методом. В качестве альтернативы P4S10 может быть образован реакцией элементарной серы или пирит, FeS2, с феррофосфор, сырая форма Fe2P (побочный продукт п4 производство из фосфоритная руда ):
- 4 Fe2P + 18 S → P4S10 + 8 FeS
- 4 Fe2P + 18 FeS2 + тепло → P4S10 + 26 FeS
Приложения
Примерно 150 000 тонн P4S10 выпускаются ежегодно. Компаунд в основном преобразуется в другие производные для использования в качестве смазочных присадок, таких как дитиофосфаты цинка. Он широко используется в производстве дитиофосфат натрия для применения в качестве флотационного агента при концентрации минералов молибденита. Он также используется в производстве пестицидов, таких как Паратион и Малатион.[7] Это также компонент какого-то аморфного твердого тела. электролиты (например. Ли2S-P2S5) для некоторых типов литиевые батареи.
Пентасульфид фосфора - это двойное использование материал для производства ранних инсектицидов, таких как Амитон, а также для производства родственных VX нервно-паралитические вещества.
Реактивность
За счет гидролиза атмосферной влагой P4S10 развивается ЧАС2S, поэтому P4S10 ассоциируется с запахом тухлого яйца. Помимо H2S, гидролиз из P4S10 в конечном итоге дает фосфорная кислота:
- п4S10 + 16 часов2O → 4 H3PO4 + 10 часов2S
Другое легкое нуклеофилы реагировать с P4S10, включая спирты и амины. Ароматические соединения, такие как анизол, ферроцен и 1-метоксинафталин реагировать на форму 1,3,2,4-дитиадифосфетан 2,4-дисульфиды Такие как Реактив Лавессона.
п4S10 используется как тионирование реагент. Реакции этого типа требуют кипячения растворителей, таких как бензол, диоксан, или же ацетонитрил с P4S10 распадаясь на P2S5. Некоторые кетоны, сложные эфиры и имиды превращаются в соответствующие тиокарбонилы. Амиды дайте тиоамид. С 1,4-дикетонами реагент образует тиофены. Он также используется для дезоксигенирования сульфоксидов. Использование P4S10 был вытеснен Реактив Лавессона п4S10с.[8]
п2S5 реагирует с пиридин образовать комплекс P2S5(пиридин)2.[9]
Рекомендации
- ^ а б c d е ж Карманный справочник NIOSH по химической опасности. "#0510". Национальный институт охраны труда и здоровья (NIOSH).
- ^ «Пентасульфид фосфора». Немедленно опасные для жизни и здоровья концентрации (IDLH). Национальный институт охраны труда и здоровья (NIOSH).
- ^ Скотт Д. Эдмондсон, Мусуми Санниграхи "Сульфид фосфора (V)" Энциклопедия реагентов для органического синтеза 2004 г. John Wiley & Sons. Дои:10.1002 / 047084289X.rp166s.pub2
- ^ Корбридж, Д. Е. С. (1995). Фосфор: краткое описание его химии, биохимии и технологии (5-е изд.). Амстердам: Эльзевир. ISBN 0-444-89307-5.
- ^ Берцелиус Дж. (1843 г.). "Ueber die Verbindungen des Phosphors mit Schwefel". Annalen der Chemie und Pharmacie. 46 (2): 129–154. Дои:10.1002 / jlac.18430460202.
- ^ Берцелиус Дж. (1843 г.). "Ueber die Verbindungen des Phosphors mit Schwefel". Annalen der Chemie und Pharmacie. 46 (3): 251–281. Дои:10.1002 / jlac.18430460303. (продолжение с. 154 того же тома)
- ^ Bettermann, G .; Krause, W .; Riess, G .; Хофманн, Т. (2002). «Соединения фосфора неорганические». Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a19_527. ISBN 3527306730.
- ^ Озтюрк, Т .; Ertas, E .; Мерт, О. (2010). "Реагент Берцелиуса, декасульфид фосфора (P4S10), в органическом синтезе ». Химические обзоры. 110 (6): 3419–3478. Дои:10.1021 / cr900243d. PMID 20429553.
- ^ Бергман, Ян; Петтерссон, Биргитта; Хасимбегович, Ведран; Свенссон, Пер Х. (2011). «Тионаты с использованием комплекса P4S10-пиридин в растворителях, таких как ацетонитрил и диметилсульфон». Журнал органической химии. 76 (6): 1546–1553. Дои:10.1021 / jo101865y. PMID 21341727.
