Паратион - Parathion - Wikipedia
 | |
 | |
| Имена | |
|---|---|
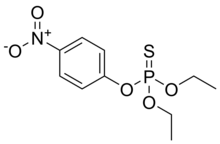
| Название ИЮПАК О,О-Диэтил О- (4-нитрофенил) фосфоротиоат | |
| Другие имена E605 | |
| Идентификаторы | |
3D модель (JSmol ) | |
| 2059093 | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| ChemSpider | |
| ECHA InfoCard | 100.000.247 |
| Номер ЕС |
|
| КЕГГ | |
PubChem CID | |
| Номер RTECS |
|
| UNII | |
| Номер ООН | 3018 2783 |
| |
| |
| Характеристики | |
| C10ЧАС14NО5пS | |
| Молярная масса | 291.26 г · моль−1 |
| Внешность | Белые кристаллы (чистая форма) |
| Температура плавления | 6 ° С (43 ° F, 279 К) |
| 24 мг / л | |
| Растворимость в других растворителях | высокая растворимость |
| Опасности | |
| Паспорт безопасности | [1] |
| Пиктограммы GHS |    |
| Сигнальное слово GHS | Предупреждение |
| H300, H311, H330, H372, H400, H410 | |
| P260, P264, P270, P271, P273, P280, P284, P301 + 310, P302 + 352, P304 + 340, P310, P312, P314, P320, P321, P322, P330, P361, P363, P391, P403 + 233, P405, P501 | |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | 120 ° С (248 ° F, 393 К) |
| Смертельная доза или концентрация (LD, LC): | |
LD50 (средняя доза ) | 5 мг / кг (мышь, перорально) 10 мг / кг (кролик, перорально) 3 мг / кг (собака, перорально) 0,93 мг / кг (кошка, перорально) 5 мг / кг (лошадь, перорально) 8 мг / кг (морская свинка, перорально) 2 мг / кг (крыса, перорально)[3] |
LC50 (средняя концентрация ) | 84 мг / м3 (крыса, 4 часа)[3] |
LCLo (самый низкий опубликованный ) | 50 мг / м3 (кролик, 2 ч.) 14 мг / м3 (морская свинка, 2 часа) 15 мг / м3 (мышь)[3] |
| NIOSH (Пределы воздействия на здоровье в США): | |
PEL (Допустимо) | нет (метилпаратион),[1] TWA 0,1 мг / м3 [кожа] (этилпаратион)[2] |
REL (Рекомендуемые) | TWA 0,2 мг / м3 [кожа] (метилпаратион)[1] TWA 0,05 мг / м3 [кожа] (этилпаратион)[2] |
IDLH (Непосредственная опасность) | Н.Д. (метилпаратион)[1] 10 мг / м3 (этилпаратион)[2] |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Паратион, также называемый паратион-этил или же диэтилпаратион и локально[требуется разъяснение ] известный как "Фолидол", является органофосфат инсектицид и акарицид. Первоначально он был разработан IG Farben в 1940-е гг. Он очень токсичен для организмов, не являющихся мишенями, включая людей, поэтому его использование запрещено или ограничено в большинстве стран. Базовая структура разделяется паратион метил.[5]
История

Паратион был разработан Герхард Шрадер для немецкого треста IG Farben в 1940-е гг. После Вторая Мировая Война и крах IG Farben из-за судебных процессов по военным преступлениям, западные союзники захватили патент, а паратион продавался по всему миру разными компаниями и под разными торговыми марками. Самым распространенным немецким брендом был E605 (запрещен в Германии после 2002 г.); это не была пищевая добавка "Номер E "как сегодня используется в ЕС." E "означает Entwicklungsnummer (По-немецки «номер разработки»). Это необратимый ингибитор ацетилхолинэстеразы.
Позже проблемы безопасности привели к разработке паратион метил, который несколько менее токсичен.
Обработка свойств
В чистом виде паратион представляет собой белое кристаллическое твердое вещество. Обычно это коричневый цвет. жидкость пахнет гниением яйца или же чеснок. Инсектицид несколько стабилен, но темнеет под воздействием солнечного света.
Промышленный синтез
Паратион синтезируется из диэтилдитиофосфорная кислота (C2ЧАС5O)2PS2H - пользователем хлорирование с образованием диэтилтиофосфорилхлорида ((C2ЧАС5O)2P (S) Cl), а затем хлорид обрабатывают 4-нитрофенолят натрия (в натрий соль из 4-нитрофенол ).[6]
- 2 (С2ЧАС5O)2P (S) SH + 3 Cl2 → 2 (С2ЧАС5O)2П (S) Cl + S2Cl2 + 2 HCl
- (C2ЧАС5O)2P (S) Cl + NaOC6ЧАС4НЕТ2 → (C2ЧАС5O)2P (S) OC6ЧАС4НЕТ2 + NaCl
Приложения
В качестве пестицида паратион обычно применяется путем распыления. Часто применяется к хлопок, рис и фрукты деревья. Обычные концентрации готовых к употреблению растворов составляют от 0,05 до 0,1%. Химическое вещество запрещено использовать на многих пищевых культурах.
Инсектицидное действие
Паратион действует на фермент ацетилхолинэстераза косвенно. После того, как насекомое (или человек) проглотит паратион, оксидаза заменяет серу с двойной связью на кислород, чтобы дать параоксон.[7]
- (C2ЧАС5O)2P (S) OC6ЧАС4НЕТ2 + 1/2 O2 → (C2ЧАС5O)2P (O) OC6ЧАС4НЕТ2 + S
Сложный фосфатный эфир более активен в организмах, чем сложный фосфоротиолатный эфир, поскольку атомы фосфора становятся гораздо более электроположительными.[7]
Деградация
Разложение паратиона приводит к образованию более растворимых в воде продуктов. Гидролиз, который дезактивирует молекулу, происходит на ариловый эфир связь, приводящая к диэтилтиофосфат и 4-нитрофенол.[7]
- (C2ЧАС5O)2P (S) OC6ЧАС4НЕТ2 + H2O → HOC6ЧАС4НЕТ2 + (C2ЧАС5O)2P (S) ОН
Деградация протекает иначе при анаэробный условия: нитрогруппа паратиона восстанавливается до амин.
- (C2ЧАС5O)2P (S) OC6ЧАС4НЕТ2 + 6 H → (С2ЧАС5O)2P (S) OC6ЧАС4NH2 + 2 часа2О
Безопасность
Паратион - это ингибитор холинэстеразы. Обычно это нарушает нервная система подавляя ацетилхолинэстераза. Он всасывается через кожу, слизистые оболочки и перорально. Абсорбированный паратион быстро метаболизируется до параоксона, как описано в Инсектицидное действие. Воздействие параоксона может привести к головные боли, судороги, плохое зрение, рвота, боль в животе, сильная понос, бессознательное состояние, тремор, одышка, и наконец отек легких а также остановка дыхания. Известно, что симптомы отравления сохраняются в течение длительного периода, иногда месяцев. Самый распространенный и очень специфический антидот - это атропин в дозах до 100 мг в сутки. Поскольку атропин также может быть токсичным, рекомендуется использовать для лечения часто повторяющиеся небольшие дозы. Если отравление человека обнаружено на ранней стадии и лечение проводится незамедлительно (атропин и искусственное дыхание), летальные исходы редки. Недостаток кислорода приведет к церебральная гипоксия и необратимое повреждение мозга. Периферическая невропатия включая паралич замечен как поздно последствия после выздоровления от острой интоксикации. Паратион и родственные фосфорорганические пестициды ежегодно используются при сотнях тысяч отравлений, особенно при самоубийствах.[8] Он известен как Schwiegermuttergift (свекровь яд) в Германии. По этой причине большинство составов содержат предупреждающий синий краситель.
Паратион использовался как химическая война агентом, в первую очередь элементом Британская полиция Южной Африки (СПДСБ) прилагается к Селус Скауты вовремя Родезийская война Буша. Они использовали его для отравления одежды, которая затем поставлялась антиправительственным партизанам. Когда вражеские солдаты надевали одежду, они были отравлены путем впитывания через кожу.[9][10][11]
На основе исследований на животных паратион считается Агентство по охране окружающей среды США быть возможным человеком канцероген.[12] Исследования показывают, что паратион токсичен для плода, но не вызывает врожденных дефектов.[13]
Классифицируется Программа ООН по окружающей среде (ЮНЕП) в качестве стойкий органический загрязнитель[нужна цитата ] и по Всемирная организация здоровья (ВОЗ) как Класс токсичности Ia (чрезвычайно опасно).[нужна цитата ]
Паратион токсичен для пчелы, рыбы, птицы, и другие формы дикой природы.[13]
Защита от отравления
Чтобы обеспечить конечному пользователю минимальный стандарт защиты, обычно используются подходящие защитные перчатки, одежда и респиратор с картриджами для органических паров. Промышленная безопасность Во время производственного процесса требуется специальная вентиляция и постоянное измерение загрязнения воздуха, чтобы не превышать уровни PEL, а также особое внимание к личной гигиене. Частый анализ активности ацетилхолинэстеразы в сыворотке крови рабочих также полезен с точки зрения безопасности труда, поскольку действие паратиона является кумулятивным. Кроме того, атропин использовался в качестве специфического антидота.
Смотрите также
Рекомендации
- ^ а б c Карманный справочник NIOSH по химической опасности. "#0427". Национальный институт охраны труда и здоровья (NIOSH).
- ^ а б c Карманный справочник NIOSH по химической опасности. "#0479". Национальный институт охраны труда и здоровья (NIOSH).
- ^ а б c «Паратион». Немедленно опасные для жизни и здоровья концентрации (IDLH). Национальный институт охраны труда и здоровья (NIOSH).
- ^ «Архивная копия». Архивировано из оригинал на 2015-02-17. Получено 2015-03-13.CS1 maint: заархивированная копия как заголовок (связь)
- ^ «Паратион». www.fao.org. Получено 2020-04-17.
- ^ Плата, D. C .; Gard, D. R .; Ян, К. (2005). «Соединения фосфора». Энциклопедия химической технологии Кирка-Отмера. Нью-Йорк: Джон Вили и сыновья. Дои:10.1002 / 0471238961.16081519060505.a01.pub2. ISBN 978-0471238966.
- ^ а б c Меткалф, Р. Л. (2002). «Борьба с насекомыми». Энциклопедия промышленной химии Ульмана. Нью-Йорк: Wiley-VCH Verlag GmbH & Co. KGaA. Дои:10.1002 / 14356007.a14_263. ISBN 978-3527306732.
- ^ Литчфилд, М. «Оценки острых отравлений пестицидами у сельскохозяйственных рабочих в менее развитых странах» Toxicology Reviews 2005, том 24, стр. 271-8. PMID 16499408
- ^ https://openaccess.leidenuniv.nl/bitstream/handle/1887/68698/Poison%20in%20Rhodesia%2C%20Colm%20Wittenberg.pdf?sequence=1
- ^ "Грязная война: Родезия и химико-биологическая война 1975-1980 (Книжное обозрение)". ПРИЗМА | Национальный университет обороны.
- ^ Кросс, Гленн (2017). Грязная война: Родезия и химико-биологическая война, 1975–1980 гг.. Солихалл, Великобритания: Helion & Company. ISBN 978-1-911512-12-7.
- ^ «Паратион». Интегрированная система информации о рисках. Агентство по охране окружающей среды США. 26 января 2007 г.
- ^ а б «Профили информации о пестицидах - паратион». Расширенная сеть токсикологии. Государственный университет Орегона. Сентябрь 1993 г.
внешняя ссылка
- Паратион в базе данных о свойствах пестицидов (PPDB)
- ATSDR - Отчет Группы экспертов по метилпаратиону НАС. Департамент здравоохранения и социальных служб (всеобщее достояние)
- CDC - Карманный справочник NIOSH по химической опасности НАС. Департамент здравоохранения и социальных служб (всеобщее достояние)
- Этилпаратион: Международная карта химической безопасности 0006
- Метилпаратион: Международная карта химической безопасности 0626

