Перегруппировка Ферье - Ferrier rearrangement
В Перегруппировка Ферье является органическая реакция это включает нуклеофильное замещение реакция в сочетании с аллильный сдвиг в гликаль (2,3-ненасыщенный гликозид ). Это было обнаружено углевод химик Роберт Дж. Феррье.[1][2]

Механизм
На первом этапе делокализованный ион аллилоксокарбения (2) формируется, как правило, с помощью Кислота Льюиса подобно хлорид индия (III) или же трифторид бора. Этот ион реагирует на месте со спиртом, давая смесь α (3) и β (4) аномеры 2-гликозида, с двойной связью, смещенной в положение 3,4.[3]
Примеры
| Кислота Льюиса | Алкоголь | Условия | Полученные результаты |
|---|---|---|---|
| InCl3 | метанол | в дихлорметан | α: β = 7: 1[4] |
| диоксан | воды | обогрев | 75% доходность[5] |
| SnCl4 | метанол | в дихлорметане, –78 ° C, 10 мин. | Выход 83%, α: β = 86:14.[6] |
| BF3 ·O (C2ЧАС5)2 | изопропанол | в дихлорметане, RT, 24 часа | 95% доходность[7][8] |
| ZnCl2 | этиловый спирт | в толуол, RT, 30–60 мин. | Выход 65–95%, α: β = 89:11[9][10] |
| BF3· O (C2ЧАС5)2 | бензиловый спирт | в дихлорметане, от –20 ° C до RT, 1 час | 98% доходность[11] |
Модификации
Образование С-гликозидов
Заменив спирт на силан, Могут образовываться C-гликозиды. С триэтилсилан (R '= H) реакция дает 2,3-ненасыщенный дезоксисахар.[3]

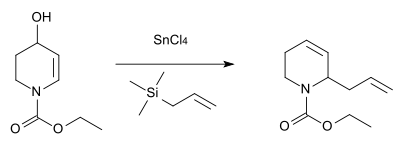
Аналог азота
Аналогичная реакция с азот как гетероатом был описан в 1984 г. для синтеза антибиотик вещество стрептазолин.[12]
Рекомендации
- ^ Феррье, Роберт Дж. (1979). «Ненасыщенные углеводы. Часть 21. Замыкание карбоксильного кольца производного гекс-5-энопиранозида». J. Chem. Soc. Perkin Trans. 1: 1455–1458. Дои:10.1039 / P19790001455.
- ^ Феррье, Роберт Дж .; Зубков, О.А. (2003). «Превращение гликалов в 2,3-ненасыщенные гликозильные производные». Орг. Реагировать. 62: 569–736. Дои:10.1002 / 0471264180.or062.04. ISBN 0-471-26418-0.
- ^ а б Константинович, Станимир; и другие. (2001). «Перегруппировка Феррие как ключевой этап в синтезе C7 – C16-алкил 2,3-дидезоксиглюкозидов из глюкозы и C7 – C16-алканолов» (PDF). J.Serb.Chem.Soc. 66 (8): 499–505. Дои:10.2298 / JSC0108499K.
- ^ Бога, С.Б .; Баласубраманян, К. К. (2004). «Катализируемая трихлоридом индия перегруппировка Феррие - простой синтез 2,3-ненасыщенных гликозидов». Аркивок: 87–102. (открытый доступ публикация)
- ^ Берт. Фрейзер-Рид; Бруно. Радатус (1970). «4,6-Ди-О-ацетил-альдегидо-2,3-дидезокси-D-эритро-транс-гекс-2-еноза. Вероятная причина« аль »в триацетилглюкале Эмиля Фишера». Варенье. Chem. Soc. 92 (17): 5288–5290. Дои:10.1021 / ja00720a087.
- ^ Элеутерио Альварес; Мария Т. Диас; Рикардо Перес; Хосе Л. Равело; Алисия Регейро; Хосе А. Вера; Дасил Зурита; Хулио Д. Мартин (1994). «Простые конструкции для создания сложных трансфузионных каркасов полиэфирных токсинов. Линейная стратегия, основанная на энтропийно предпочтительном увеличении оксиранового кольца в эпоксициклоалкенах с последующей циклизацией углерод-углеродной или углерод-кислородной связи». J. Org. Chem. 59 (10): 2848. Дои:10.1021 / jo00089a034.
- ^ Ferrier, R.J .; Прасад, Н. (1969). «Ненасыщенные углеводы. Часть IX. Синтез 2,3-дидезокси-α-D-эритро-гекс-2-енопиранозидов из три-O-ацетил-D-глюкаля». Журнал химического общества C: Органический (4): 570–575. Дои:10.1039 / J39690000570.
- ^ Ferrier, R.J .; Прасад, Н. (1969). «Ненасыщенные углеводы. Часть X. Эпоксидирование и гидроксилирование 2,3-дидезокси-α-D-гекс-2-енопиранозидов. Четыре метил-4,6-ди-O-ацетил-2,3-ангидро-α-D- гексопиранозиды ». Журнал химического общества C: Органический (4): 575–580. Дои:10.1039 / J39690000575.
- ^ Келли, Дэвид Р .; Пиктон, Марк Р. (2000). «Каталитические процессы трициклизации, опосредованные радикалами олова. Часть 1. Исследования моноциклизации». Журнал химического общества, Perkin Transactions 1 (10): 1559. Дои:10.1039 / b000661k.
- ^ Келли, Дэвид Р .; Пиктон, Марк Р. (2000). «Каталитические процессы трициклизации, опосредованные радикалом олова. Часть 2». Журнал химического общества, Perkin Transactions 1 (10): 1571. Дои:10.1039 / b000662i.
- ^ Донохо, Тимоти Дж .; Blades, Кевин; Хелливелл, Мадлен (1999). «Синтез аминосахаров с использованием реакции направленного дигидроксилирования». Химические коммуникации (17): 1733–1734. Дои:10.1039 / a904991f.
- ^ Козиковский А.П., Парк Пхен-Ук (1984). «Синтез 2-замещенных .DELTA.3-пиперидинов: азотный аналог перегруппировки Феррие. Подход к стрептазолину». J. Org. Chem. 49 (9): 1674–1676. Дои:10.1021 / jo00183a044.CS1 maint: несколько имен: список авторов (связь)
