Гран сюжет - Gran plot
А Гран сюжет (также известный как Гран титрование или Метод Гран) является обычным средством стандартизации титровать или же титрант оценивая эквивалентный объем или же конечная точка в сильном кислота -сильный основание титрование или в потенциометрическое титрование. Такие графики также использовались для калибровки стеклянных электродов, для оценки содержания карбонатов в водных растворах и для оценки Kа значения (константы кислотной диссоциации ) слабых кислот и оснований по данным титрования.
Графики Gran используют линейные аппроксимации априори нелинейные зависимости между измеряемой величиной, pH или же электродвижущий потенциал (ЭДС) и объем титранта. Другие типы измерений концентрации, например спектрофотометрические. абсорбция или ЯМР химические сдвиги, в принципе можно рассматривать аналогичным образом. Эти приближения действительны только вблизи конечной точки, но не в ней, и поэтому метод отличается от оценок конечной точки посредством первого и второго подходов.производная графики, которые требуют данных в конечной точке. Графики Gran изначально были разработаны для графических определений в докомпьютерное время, при этом график x-y на бумаге будет вручную экстраполироваться для оценки пересечения с x. Графическое отображение и визуальная оценка конечной точки заменены более точными. наименьших квадратов анализирует с момента появления современных компьютеров и программных пакетов, особенно программ электронных таблиц со встроенной функцией наименьших квадратов.
Основа расчетов
Сюжет Гран основан на Уравнение Нернста который можно записать как
куда E - измеренный электродный потенциал, E0 - стандартный электродный потенциал, s - наклон, в идеале равный RT / nF, а {H+} - активность иона водорода. Выражение перестраивается на
в зависимости от того, калиброван ли электрод в милливольтах или pH. Для удобства концентрация [H+], используется вместо деятельности. При титровании сильной кислоты сильной щелочью аналитическая концентрация иона водорода получается из начальной концентрации кислоты, Cя и количество щелочи, добавляемой во время титрования.
где vя - начальный объем раствора, cОЙ - концентрация щелочи в бюретке, v - объем титра. Приравнивая два выражения для [H+] и упрощая, получаем следующее выражение
Сюжет против v будет прямая линия. Если E0 и s известны из калибровки электродов, где линия, пересекающая ось x, указывает объем в точке эквивалентности, . В качестве альтернативы этот график можно использовать для калибровки электродов, найдя значения E0 и s которые дают лучшую прямую линию.
Титрование сильной кислоты сильным основанием
Для титрования сильной кислоты и сильного основания, контролируемого по pH, у нас есть любой я'-я точка титрования
куда Kш это вода автопротолиз постоянный.
При титровании кислоты начального объема и концентрация с базой концентрации , то в любом я'Точка титрования с объемом титранта ,
На Точка эквивалентности, то эквивалентный объем .
Таким образом,
- сюжет будет линейная область перед эквивалентность, с наклоном
- и сюжет будет линейная область после эквивалентность, с наклоном
- на обоих участках будет как перехват
Объем эквивалентности используется для вычисления любого из или же неизвестно.
PH-метр обычно калибруется с помощью буферных растворов при известных значениях pH перед началом титрования. В ионная сила может поддерживаться постоянным путем разумного выбора кислоты и основания. Например, HCl, титрованный NaOH примерно такой же концентрации, заменит H+ с ионом (Na+) того же заряда при той же концентрации, чтобы ионная сила оставалась достаточно постоянной. В противном случае можно использовать относительно высокую концентрацию фонового электролита или коэффициент активности можно вычислить.[1]
Титрование сильного основания сильной кислотой
Зеркальные графики получаются при титровании основания кислотой, причем знаки наклонов меняются на противоположные.

Рисунок 1. Примеры графиков Гран с использованием данных Батлера (1998). Обратите внимание, что закрашенные кружки указывают точки данных, включенные в вычисления методом наименьших квадратов, чтобы получить аппроксимированные пунктирные линии.
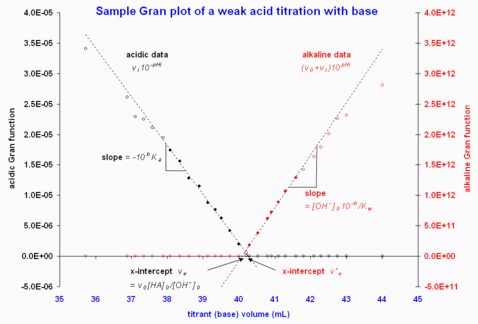
Фигура 2. Примеры графиков Gran с использованием данных из "он-лайн источник". Получено 2008-02-18. Показана только область, близкая к эквивалентности, поскольку данные, далекие от эквивалентности, сильно отклоняются от линейности. Обратите внимание, что закрашенные кружки обозначают точки данных, включенные в вычисления методом наименьших квадратов, чтобы получить аппроксимированные пунктирные линии.
Следовательно,
- сюжет будет линейная область перед эквивалентность с наклоном
- и сюжет будет линейная область после эквивалентность с наклоном
- на обоих участках будет как x-перехват
На рис. 1 представлены образцы графиков Gran при титровании сильным основанием и сильной кислотой.
Концентрации и константы диссоциации слабых кислот.
Метод может быть использован для оценки констант диссоциации слабых кислот, а также их концентраций (Gran, 1952). С кислотой, представленной HA, где
- ,
у нас есть в любом я'-я точка титрования объема кислоты в концентрации по базе концентрации . В линейных областях, отличных от эквивалентности,
- и
являются допустимыми приближениями, откуда
- , или же
- или, потому что ,
- .
Сюжет против будет наклон над линейной кислотной областью и экстраполированным отрезком x , откуда либо или же можно вычислить.[1] Щелочная область обрабатывается так же, как и титрование сильной кислоты. На рис. 2 приведен пример; в этом примере два отсекаемых по оси x отличаются примерно на 0,2 мл, но это небольшое расхождение, учитывая большой эквивалентный объем (ошибка 0,5%).
Аналогичные уравнения можно записать для титрования слабого основания сильной кислотой (Gran, 1952; Harris, 1998).
Карбонатное содержание
Мартелл и Мотекайтис (1992) используют наиболее линейные области и используют разницу в объемах эквивалентности между графиками на кислотной и основной сторонах во время кислотно-основного титрования для оценки побочного CO2 содержание в базовом растворе. Это проиллюстрировано на типовых графиках Гран на Фигуре 1. В этой ситуации дополнительная кислота, использованная для нейтрализации карбоната путем двойного протонирования, в объеме титрования . В противоположном случае титрования кислоты основанием содержание карбоната рассчитывается аналогичным образом из , куда объем эквивалентности стороны основания (от Martell и Motekaitis).
Когда общий CO2 содержание является значительным, так как в природных водах и щелочных стоках на кривых pH-объема можно увидеть два или три перегиба из-за буферизации более высокими концентрациями бикарбоната и карбоната. Как обсуждали Штум и Морган (1981), при анализе таких вод можно использовать до шести графиков Гран из одного титрования для оценки нескольких конечных точек и измерения общей щелочности и содержания карбонатов и / или бикарбонатов.
Потенциометрический мониторинг H+
Чтобы использовать потенциометрические (ЭДС) измерения в мониторинге концентрация вместо показаний можно тривиально установить и примените те же уравнения, что и выше, где поправка смещения , и это коррекция наклона (1 / 59,2 единиц pH / мВ при 25 ° C), так что заменяет .
Таким образом, как и раньше для титрования сильной кислоты сильным основанием,
- сюжет против. перед эквивалентностью будет иметь линейную область с наклоном
- и сюжет против. будет иметь линейную область после эквивалентности с наклоном
- на обоих участках будет в качестве точки пересечения, и, как и раньше, эквивалентный объем на кислотной стороне может использоваться для стандартизации той концентрации, которая неизвестна, а разница между эквивалентными объемами на кислотной стороне и на стороне основания может использоваться для оценки карбонатное содержание
Аналогичные графики можно построить, используя данные титрования основания кислотой.
Калибровка электрода
Обратите внимание, что приведенный выше анализ требует предварительного знания и .
Если pH-электрод плохо откалиброван, можно рассчитать поправку смещения. на месте со стороны кислого склона Гран:
- Для титрования кислоты основанием крутизна кислотной стороны () может служить для вычисления используя известное значение или используя значение, данное эквивалентным объемом. затем можно рассчитать по наклону со стороны основания.
- Для титрования основания кислотой, как показано на образцах, наклон кислотной стороны () аналогично используется для вычисления и откос со стороны основания () используется для вычисления используя известное значение или используя значение, данное эквивалентным объемом кислотной стороны.
В образце данных, показанном на Рисунке 1, эта поправка смещения не была незначительной при -0,054 единиц pH.
Значение однако может отклоняться от своего теоретического значения и может быть оценено только путем надлежащей калибровки электрода. Калибровка электрода часто выполняется с использованием буферов с известным pH или путем титрования сильной кислоты сильным основанием. В этом случае может поддерживаться постоянная ионная сила и известен во всех точках титрования, если оба и известны (и должны иметь прямое отношение к первичные стандарты ). Например, Мартелл и Мотекайтис (1992) рассчитали значение pH, ожидаемое в начале титрования, предварительно оттитровав растворы кислоты и основания относительно первичных стандартов, а затем соответствующим образом скорректировали показания электрода pH, но это не дает поправки на наклон, если нужен один.
Основываясь на более ранней работе Макбрайда (1969), Ганс и О'Салливан (2000) описывают итерационный подход для достижения обоих и ценности в отношении , от титрования сильной кислоты сильным основанием:
- сначала оценивается по кислотным данным согласно Россотти и Россотти (1965), и изначально принимается за теоретическое значение;
- построены модифицированные графики функции Гран с использованием против. на кислой стороне эквивалентности и против. на щелочной стороне, а эквивалентные объемы и вычисляются оттуда, как и раньше;
- как и раньше, разница в объемах эквивалентности используется для вычисления карбонатное содержание но также для расчета «эффективной базовой концентрации» для щелочной стороны эквивалентности;
- приблизительный значения рассчитываются на кислотной стороне как а на щелочной стороне как ;
- первоначальное определение переписывается как , а данные нанесены на , используя те значения, соответствующие значениям pH в диапазонах 2,5-4,5 и 10,7-11,5 (линейный диапазон отклика для стеклянного электрода, который позволяет избежать изменения потенциалов перехода и / или щелочной ошибки при экстремальных значениях pH, а также позволяет избежать неопределенностей измерения вблизи точки эквивалентности а также ошибки вычислений из-за пренебрежения на кислотной стороне и пренебрежение карбонат / бикарбонатным равновесием на щелочной стороне); линейная обработка методом наименьших квадратов обеспечивает как наклон и как перехватить;
- шаги 2 и 3 повторяются с новым и значения для большей точности в эквивалентных объемах и CO2 содержание.
В принципе, процедура может быть модифицирована для титрования основания кислотой. Компьютерная программа под названием GLEE (для GLass Electrode Evaluation) реализует этот подход при титровании кислоты основанием для калибровки электродов. Эта программа дополнительно может вычислить (с помощью отдельного нелинейного метода наименьших квадратов) «поправку» для базовой концентрации. Преимущество этого метода калибровки электродов заключается в том, что его можно проводить в той же среде постоянного ионная сила который впоследствии может быть использован для определение констант равновесия.
Обратите внимание, что обычные функции Гран обеспечат требуемые объемы эквивалентности и, как изначально задано теоретическое значение, первоначальная оценка для на этапе 1 может быть получен из наклона регулярной кислотной функции Gran, как подробно описано ранее. Также обратите внимание, что эта процедура вычисляет CO2 содержание и действительно может быть объединено с полной стандартизацией базы, используя определение вычислить . Наконец, применимый диапазон pH может быть расширен путем решения квадратичной за .
Потенциометрический мониторинг других видов

Рисунок 3. Образцы графиков Gran с использованием данных титрования Cl− автор: Ag+ контролируется потенциометрически. Потенциалы были переведены в [Ag+] значения для построения графика. Обратите внимание, что закрашенные кружки указывают точки данных, включенные в вычисления методом наименьших квадратов, чтобы получить аппроксимированные пунктирные линии.
Потенциометрические данные также используются для мониторинга других видов, кроме . При наблюдении за любыми видами с помощью потенциометрии можно применить тот же формализм с . Таким образом, титрование раствора другого вида по видам аналогичен рН-контролируемому титрованию основания кислотой, откуда либо или же построенный против будет x-перехват . При обратном титровании к , объем эквивалентности будет . Значение наклонов будет зависеть от взаимодействия между двумя видами, будь то соединение в растворе или выпадение вместе (Gran, 1952). Обычно интерес представляет только точка эквивалентности. Однако наклон до эквивалентности в принципе можно использовать для оценки произведение растворимости так же, как может быть определен путем кислотно-основного титрования, хотя могут иметь место и другие взаимодействия ионных пар.[2]
Для иллюстрации рассмотрим титрование Cl− автор: Ag+ под контролем потенциометрически:
Следовательно,
- сюжет будет линейная область перед эквивалентность, с наклоном
- и сюжет будет линейная область после эквивалентность, с наклоном
- на обоих графиках пересечение по оси x равно
На рис. 3 приведены примерные графики данных потенциометрического титрования.
Неидеальное поведение
При любом титровании без буферных компонентов графики как до эквивалентности, так и за пределами эквивалентности должны идеально пересекать ось x в одной и той же точке. Неидеальное поведение может быть результатом ошибок измерения (например плохо откалиброванный электрод, недостаточное время уравновешивания перед записью показаний электрода, дрейф ионной силы), ошибки отбора проб (например низкая плотность данных в линейных областях) или неполная химическая модель (например наличие титруемых примесей, таких как карбонат в основе или неполное осаждение при потенциометрическом титровании разбавленных растворов, для которых Гран и другие. (1981) предлагают альтернативные подходы). Буффл и другие. (1972) обсуждают ряд источников ошибок.
Поскольку или же члены в функциях Грана только асимптотически стремятся и никогда не достигают оси x, кривизна, приближающаяся к точке эквивалентности, должна ожидаться во всех случаях. Однако практикующие специалисты расходятся во мнениях относительно того, какие данные отображать на графике, использовать ли данные только с одной стороны эквивалентности или с обеих сторон, и выбирать ли данные, наиболее близкие к эквивалентности, или наиболее линейные части:[3][4] использование данных, ближайших к точке эквивалентности, позволит двум точкам пересечения по оси x быть более совпадающими друг с другом и лучше совпадать с оценками по производным графикам, в то время как использование данных кислотной стороны в кислотно-основном титровании, по-видимому, минимизирует помехи от титруемого (буфер ) примеси, такие как бикарбонат / карбонат в основе (см. Карбонатное содержание ) и эффект дрейфующей ионной силы. На демонстрационных графиках, показанных на рисунках, наиболее линейные области (данные, представленные закрашенными кружками) были выбраны для вычислений наклонов и пересечений методом наименьших квадратов. Выбор данных всегда субъективен.
Рекомендации
- Баффл, Дж., Партхасарати, Н. и Монье, Д. (1972): Ошибки в методе сложения Гран. Часть I. Теоретический расчет статистических ошибок; Анальный. Чим. Acta 59, 427-438; Баффл, Дж. (1972): Анальный. Чим. Acta 59, 439.
- Батлер, Дж. Н. (1991): равновесие двуокиси углерода и их применение; CRC Press: Бока-Ратон, Флорида.
- Батлер, Дж. Н. (1998): Ионное равновесие: расчеты растворимости и pH; Wiley-Interscience. Глава. 3.
- Ганс, П., О'Салливан, Б. (2000): GLEE, новая компьютерная программа для калибровки стеклянных электродов; Таланта, 51, 33–37.
- Гран, Г. (1950): Определение точки эквивалентности при потенциометрическом титровании, Acta Chemica Scandinavica, 4, 559-577.
- Гран, Г. (1952): Определение точки эквивалентности при потенциометрическом титровании - Часть II, Аналитик, 77, 661-671.
- Гран, Г., Йоханссон, А. и Йоханссон, С. (1981): Автоматическое титрование путем пошагового добавления равных объемов титранта. Часть VII. Потенциометрическое титрование осадков, Аналитик, 106, 1109-1118.
- Харрис, Д. К. Количественный химический анализ, 5-е изд .; W.H. Freeman & Co., Нью. Йорк, Нью-Йорк, 1998.
- Мартелл, А. Э. и Мотекайтис, Р. Дж .: Определение и использование констант стабильности, Wiley-VCH, 1992.
- Макбрайд, В. А. Э. (1969): Аналитик, 94, 337.
- Россотти, Ф. Дж. К. и Россотти, Х. (1965): J. Chem. Эд., 42, 375
- Скуг, Д. А., Уэст, Д. М., Холлер, Ф. Дж. И Крауч, С. Р. (2003): Основы аналитической химии: Введение, 8-е изд., Брукс и Коул, гл. 37.
- Штумм В. и Морган Дж. Дж. (1981): водная химия, 2-е изд .; John Wiley & Sons, Нью-Йорк.
Примечания
- ^ а б Если ионная сила непостоянна, можно исправить это выражение с учетом изменения коэффициента активности. См. Harris (1998) или этот «он-лайн документ» (PDF). Получено 2008-02-17.
- ^ Бабушка и другие. (1981) дают более подробную трактовку, которая учитывает другие сложные виды при титровании Cl− автор: Ag+ (Ag2Cl+ и AgCl2−, в частности) и при других титрованиях с осаждением, чтобы вычислить эквивалентные объемы разбавленных растворов, когда осаждение не завершено.
- ^ «Он-лайн документ» (PDF). Архивировано из оригинал (PDF) 17 декабря 2008 г.. Получено 2008-02-17.) и В. Вольбах из Университета Депол («Он-лайн документ» (PDF). Получено 2008-02-17.) рекомендуют использовать последние 10-20% объемные данные перед точкой эквивалентности, и последняя учитывает, что Gran на стороне основания строится на основе титрований кислоты основанием (т.е. после точки эквивалентности) может использоваться для оценки СО2 содержание в базе. Точно так же W. E. Brewer и J. L. Ferry из Университета Южной Каролины рекомендуют использовать эти данные с точностью до 10% перед установлением эквивалентности («Он-лайн документ» (PDF). Получено 2008-02-17.). К. Кувата из Macalester College рекомендует студентам выбрать тот регион данных, который дает наиболее прямую линию перед эквивалентностью («Он-лайн документ» (PDF). Получено 2008-02-17.). Д.Л. Зеллмер из Калифорнийского государственного университета во Фресно просит студентов нанести на график данные с обеих сторон эквивалентности, используя данные, наиболее далекие от эквивалентности, и оценить ошибки, чтобы определить, существенно ли различаются две оценки объемов эквивалентности (pH данные: «Он-лайн документ». Получено 2008-02-17.; потенциометрическое титрование хлорид-иона ионом серебра: «Он-лайн документ». Получено 2008-02-17.).
- ^ Батлер (1991) обсуждает вопрос выбора данных, а также исследует влияние титруемых примесей, таких как борат и фосфат.


![{ displaystyle [H ^ {+}] = 10 ^ { frac {E-E ^ {0}} {s}} или [H ^ {+}] = 10 ^ {- pH}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/54cc2b0dad52a2a38d4eae5d61668859a598aff0)
![{ displaystyle [H ^ {+}] = { frac {C_ {i} v_ {i} -c_ {OH} v} {v_ {i} + v}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4fa60de2bc0b02925c56225af1ad7af24904981e)



![{ displaystyle K_ {w ^ {}} = [H ^ {+}] _ {i} [OH ^ {-}] _ {i}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1db0b94c20344944dea92ee4878afb135017aaef)

![{ displaystyle [H ^ {+}] _ {0 ^ {}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1ad86c50bb5c87cbc6ce8e6140089390b1797c64)
![{ displaystyle [ОН ^ {-}] _ {0 ^ {}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/349ebe8d364545dc81a278f8396263ae21b7c12b)

![{ displaystyle { frac {v_ {0} [H ^ {+}] _ {0} -v_ {i} [OH ^ {-}] _ {0}} {v_ {0} + v_ {i}} } { begin {cases} приблизительно [H ^ {+}] _ {i} { text {или}} 10 ^ {- pH_ {i}} & { text {when}} v_ {0 ^ {} } [H ^ {+}] _ {0}> v_ {i} [OH ^ {-}] _ {0} { text {(кислотная область)}} = 0 & { text {when}} v_ {0 ^ {}} [H ^ {+}] _ {0} = v_ {i} [OH ^ {-}] _ {0} { text {(точка эквивалентности)}} приблизительно - [OH ^ {-}] _ {i} { text {или}} - K_ {w} 10 ^ {pH_ {i}} & { text {when}} v_ {0 ^ {}} [H ^ {+} ] _ {0} <v_ {i} [OH ^ {-}] _ {0} { text {(щелочная область)}} end {cases}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/dc9534301f6128c37f6a45e275d7beadb97a34bb)


![{ displaystyle - [ОН ^ {-}] _ {0 ^ {}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/30990190f192ab893969327d787e617348fe2441)

![{ displaystyle [OH ^ {-}] _ {0} / K_ {w ^ {}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/af930d58632586406096e06ab513b848df232ae7)
![{ displaystyle v_ {e} = v_ {0} [H ^ {+}] _ {0} / [OH ^ {-}] _ {0 ^ {}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f5699e3929db80c1d0387b0fa7ec845a08cc88c9)
![{ displaystyle { frac {v_ {0} [OH ^ {-}] _ {0} -v_ {i} [H ^ {+}] _ {0}} {v_ {0} + v_ {i}} } { begin {cases} приблизительно [OH ^ {-}] _ {i} { text {или}} K_ {w} 10 ^ {pH_ {i}} & { text {when}} v_ {0 ^ {}} [OH ^ {-}] _ {0}> v_ {i} [H ^ {+}] _ {0} { text {(щелочная область)}} = 0 & { text {когда }} v_ {0 ^ {}} [OH ^ {-}] _ {0} = v_ {i} [H ^ {+}] _ {0} { text {(точка эквивалентности)}} приблизительно - [H ^ {+}] _ {i} { text {or}} - 10 ^ {- pH_ {i}} & { text {when}} v_ {0 ^ {}} [OH ^ {-} ] _ {0} <v_ {i} [H ^ {+}] _ {0} { text {(кислая область)}} end {cases}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/34d2024e286f5db906831a2e8c22a87571c2eb0a)
![{ displaystyle - [H ^ {+}] _ {0} / K_ {w ^ {}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6fddfd232316e598f2b66875c068bc44460cdd77)
![{ displaystyle v_ {e} = v_ {0} [OH ^ {-}] _ {0 ^ {}} / [H ^ {+}] _ {0}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c6704c0ce6a65dc0dd1076e376c07a25074b0c56)
![{ displaystyle K_ {a} = { frac {[H ^ {+}] _ {i} [A ^ {-}] _ {i}} {[HA] _ {i}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cdf8a34c0247b6b88619d4d2668221637a258b99)

![{ displaystyle [HA] _ {0}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1756ca0b12a2f09e9ace6fefaf7667454ed186d2)
![{ displaystyle [ОН ^ {-}] _ {0}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/528d40dd3e1f5de41850626c0b99d0a7f538f8ae)
![{ displaystyle [HA] _ {i} приблизительно { frac {v_ {0} [HA] _ {0} -v_ {i} [OH ^ {-}] _ {0}} {v_ {0} + v_ {i}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/19224a237e91bfe16ce79a2973ddb89dbba5f4c2)
![{ displaystyle [A ^ {-}] _ {i} приблизительно { frac {v_ {i} [OH ^ {-}] _ {0}} {v_ {0} + v_ {i}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f8ac0f9648acacf896ef1e36fb107d1eb9f6c4c2)
![{ displaystyle K_ {a} приблизительно { frac {10 ^ {- pH_ {i}} v_ {i} [OH ^ {-}] _ {0}} {v_ {0} [HA] _ {0} -v_ {i} [ОН ^ {-}] _ {0}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d9bc507e795dfea831b4012a9dcf742c91beed1c)
![{ displaystyle K_ {a} (v_ {0} { frac {[HA] _ {0}} {[OH ^ {-}] _ {0}}} - v_ {i}) приблизительно 10 ^ {- pH_ {i}} v_ {i}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/77dc2909198804c04da9d24a259197c9d439d359)
![{ displaystyle v_ {e} = v_ {0} { frac {[HA] _ {0}} {[OH ^ {-}] _ {0}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a195a786d0c9400c36d1e1eaff9ddebfd7cb8c9e)




![{ displaystyle [HA] _ {0 ^ {}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/01055bdd1d78a237b8c0bf09dd10fc8457520cdb)
![{ displaystyle (v_ {e} -v_ {e} ^ { prime}) [H ^ {+}] _ {0 ^ {}} = 2v_ {0} [CO_ {2}] _ {0}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cd551caef6ac3c109713851f5b6345c2fcaffeb2)
![{ displaystyle (v_ {e} ^ { prime} -v_ {e}) [OH ^ {-}] _ {0 ^ {}} = 2v_ {e} ^ { prime} [CO_ {2}] _ {0}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cb1956588a4c55722d610e836490ea8ea159e414)




![{ displaystyle -log_ {10} [H ^ {+}] _ {i} = b_ {0} -b_ {1} E_ {i ^ {}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/70741e6ba1b626302187955e8b1d32ce102eba20)






![{ displaystyle -10 ^ {b_ {0}} [ОН ^ {-}] _ {0 ^ {}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d8a85a80049e3f6c5297bbf42f8deccbce01821c)

![{ displaystyle 10 ^ {- b_ {0}} [OH ^ {-}] _ {0} / K_ {w ^ {}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/86b814278e54ca0355316067e831e769e5519e08)
![{ displaystyle - [OH ^ {-}] _ {0 ^ {}} 10 ^ {b_ {0}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c089bb758310a6f737e29853a0b075e980378b32)

![{ displaystyle [H ^ {+}] _ {0 ^ {}} 10 ^ {b_ {0}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fd321617413b9314c1a63743dfc2fdcf7b11eea1)
![{ displaystyle - [H ^ {+}] _ {0 ^ {}} 10 ^ {- b_ {0}} / K_ {w}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0ead3ce9876a94a8bd46d7cfe73e707bc2e7707a)
![{ displaystyle [H ^ {+ _ {}}] _ {я}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/becbf5d2e21654200c46fa31d0f2c3145403f992)
![{ displaystyle [H _ {} ^ {+}] _ {0}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/39338d2723e07adaecc434ec8d7e86fa6499f239)
![{ displaystyle [ОН _ {} ^ {-}] _ {0}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/650afe4f973213f6c9c51c2c92009f87a08a4372)


![{ displaystyle v_ {e} [OH ^ {-}] _ {0 ^ {}} / v_ {e} ^ { prime}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b5a35c98ffe984a3ac4995bf249effd05b1fed3e)
![{ displaystyle [H ^ {+}] _ {я ^ {}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bcac7a06f0f699d71340713329cd33e33c623abb)
![{ displaystyle (v_ {0 ^ {}} [H ^ {+}] _ {0} -v_ {i} [OH ^ {-}] _ {0}) / (v_ {0} + v_ {i} )}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4dc107a833fc669533394df6901c516255bd6e46)
![{ displaystyle (v_ {e} [H ^ {+}] _ {0} -v_ {i} v_ {e} [OH ^ {-}] _ {0} / v_ {e} ^ { prime}) / (v_ {0} + v_ {i})}](https://wikimedia.org/api/rest_v1/media/math/render/svg/721aaf6302494a767750d0c7c4f176e14345f69e)
![{ displaystyle E_ {я ^ {}} = b_ {0} / b_ {1} + (1 / b_ {1}) log_ {10} [H ^ {+}] _ {i}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/81d60b752e3a97207ac1564c74b77021bb2b8748)
![{ displaystyle log_ {10} [H ^ {+}] _ {я ^ {}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/aa262e87a4d416162b2e3ce1d9c18980afb6f1f8)
![{ displaystyle [ОН ^ {-}] _ {я ^ {}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b550c62051cba4fe4c8b63f03fe0412520b5a78c)


![{ displaystyle (v_ {0 {^ {}}} [H ^ {+}] _ {0} -v_ {i} [OH ^ {-}] _ {0}) / (v_ {0} + v_ { i}) = [H ^ {+}] _ {i} -K_ {w} / [H ^ {+}] _ {i}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0bb66cda334f6082deb14053a64f5dd26e3375ae)

![{ displaystyle -log_ {10} [S ^ {1}] _ {i} = b_ {0} -b_ {1} E_ {i ^ {}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bdcdb2dbf4bb1e3adae9a8d420ee793d276f39b7)

![{ displaystyle v_ {0} [S ^ {0}] _ {0} / [S ^ {1}] _ {0 ^ {}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c7cb445111bc6469dc5c85492d9997f48d3ca1c9)
![{ displaystyle v_ {0} [S ^ {1}] _ {0} / [S ^ {0}] _ {0 ^ {}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8795d1a16a8e7bad358482bacee448b6cfd1f5c0)

![{ displaystyle { frac {v_ {0} [Cl ^ {-}] _ {0} -v_ {i} [Ag ^ {+}] _ {0}} {v_ {0} + v_ {i}} } { begin {cases} приблизительно [Cl ^ {-}] _ {i} { text {или}} K_ {sp} 10 ^ {- b_ {1} E_ {i} + b_ {0}} & { text {when}} v_ {0 ^ {}} [Cl ^ {-}] _ {0}> v_ {i} [Ag ^ {+}] _ {0} { text {(до эквивалентности)} } = 0 & { text {когда}} v_ {0 ^ {}} [Cl ^ {-}] _ {0} = v_ {i} [Ag ^ {+}] _ {0} { text { (точка эквивалентности)}} приблизительно - [Ag ^ {+}] _ {i} { text {или}} - 10 ^ {b_ {1} E_ {i} -b_ {0}} & { текст {когда}} v_ {0 ^ {}} [Cl ^ {-}] _ {0} <v_ {i} [Ag ^ {+}] _ {0} { text {(после эквивалентности)}} конец {case}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/911677d9d43bd0d8faee7d987a44dde0c690a06e)

![{ displaystyle - [Ag ^ {+}] _ {0} 10 ^ {- b_ {0}} / K_ {sp ^ {}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9b9c5abe2ea483461e18a92ca2d2da8f1f748219)

![{ displaystyle [Ag ^ {+}] _ {0 ^ {}} 10 ^ {b_ {0}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7b562cbcbc203994c58df2cd1d371fe06f3ed78b)
![{ displaystyle v_ {e} = v_ {0} [Cl ^ {-}] _ {0 ^ {}} / [Ag ^ {+}] _ {0}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ed8e4ff242b2d73b7c008d9ea7cee66599fa54a3)

