Гетеросинаптическая пластичность - Heterosynaptic plasticity
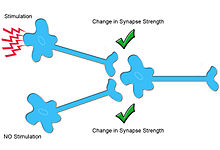
Синаптическая пластичность относится к способности химического синапса претерпевать изменения в силе.[1] Синаптическая пластичность обычно зависит от входа (т. Е. гомосинаптическая пластичность ), что означает, что активность конкретного нейрона изменяет эффективность синаптической связи между этим нейроном и его целью. Однако в случае гетеросинаптическая пластичность, активность конкретного нейрона приводит к неспецифическим изменениям силы синаптических связей от других неактивированных нейронов.[2][3] Ряд различных форм гетеросинаптической пластичности был обнаружен во множестве областей мозга и организмов. Эти разные формы гетеросинаптической пластичности способствуют множеству нейронных процессов, включая ассоциативное обучение, развитие нейронных цепей и гомеостаз синаптического входа.[4]
Гомеостатическая роль
Гетеросинаптическая пластичность может играть важную роль гомеостатический роль в нейрональной пластичности путем нормализации или ограничения общего изменения синаптического входа во время продолжающегося Хеббийская пластичность.[5] Считается, что геббовская пластичность, повсеместная форма гомосинаптической ассоциативной пластичности, лежит в основе обучения и памяти. Более того, пластичность Хебба вызвана и усиливается корреляциями в нейронных цепях, что создает петлю положительной обратной связи и делает нейронные цепи нестабильными. Чтобы избежать этой нестабильности, необходимо ограничить пластичность Хебба,[6] например, сохранением общего количества синаптического входа. Считается, что эту роль выполняют разнообразные гомеостатические механизмы.
Однако для эффективной стабилизации пластичности Хебба, которая может быть вызвана за считанные секунды или минуты, гомеостатическая пластичность должна реагировать быстро.[7] Этому требованию, однако, не удовлетворяют большинство форм гомеостатической пластичности, которые обычно действуют в течение часов, дней или дольше.[8][9]Это ограничение не относится к гетеросинаптической пластичности.[10][11][12]
Для достижения гомеостатического эффекта гетеросинаптическая пластичность, выполняющая гомеостатическую роль, должна вызывать неспецифические пути синаптических изменений в направлении, противоположном Хеббовской пластичности. Другими словами, когда гомосинаптические долгосрочное потенцирование индуцируется в данном синапсе, другие нестимулированные синапсы должны быть подавлены.[2] Наоборот, гомосинаптический длительная депрессия может вызвать потенцирование других синапсов таким образом, чтобы средний синаптический вес был приблизительно сохранен. Масштаб этих изменений может быть глобальным или разделенным на дендриты.
Модуляторная пластичность, зависящая от входа

Одним из хорошо изученных примеров гетеросинаптической пластичности является пластичность, зависящая от модулирующих входов. Модуляторные нейроны выполняют нейромодуляция, который является выпуском нейромодуляторов. Нейромодуляторы отличаются от классических нейротрансмиттеров. Как правило, нейромодуляторы непосредственно не генерируют электрические ответы в нейронах-мишенях. Скорее, высвобождение нейромодуляторов часто изменяет эффективность нейротрансмиссии в близлежащих химических синапсах. Кроме того, воздействие нейромодуляторов часто бывает довольно продолжительным по сравнению с классическими нейротрансмиттерами.[1]
Ряд нейротрансмиттеров могут действовать как нейромодуляторы, особенно биогенные амины, такие как дофамин и серотонин.[4] Эти нейромодуляторы используют Рецепторы, сопряженные с G-белком которые опосредуют более медленные модулирующие эффекты и не гиперполяризуют и не деполяризуют клетки. Благодаря этим качествам GPCR может инициировать длительные изменения гетеросинаптической силы.[1]
Использование этих нейромодуляторов является примером гетеросинаптической пластичности. Освобождается нейроном, называемым интернейрон, нейромодуляторы могут влиять на эффективность взаимодействия другого нейрона с постсинаптической клеткой. Таким образом, поскольку интернейрон специфически не активирует постсинаптический нейрон (косвенно влияет на силу его синаптической пластичности), этот механизм модулирующей пластичности, зависимой от входа, является гетеросинаптическим.[4] Чтобы лучше понять этот процесс и его огромное разнообразие, мы рассмотрим ключевые функции нейромодулятора серотонина в Аплизия калифорнийская и дофамин дополнительно проиллюстрированы.
Аплизия калифорнийская

Классический пример, демонстрирующий пластичность, зависящую от модуляционных входов, включает морского моллюска, Аплизия калифорнийская. Исследования конца 1960-х годов предоставили первые доказательства пластичности химических синапсов Аплизия. Эти исследования показали, что несколько типов модуляторных интернейронов возбуждаются в цепи сенсорных и моторных нейронов Аплизия. В Аплизия, стимуляция терминалов сенсорных нейронов сифона приводила к усилению EPSP в модуляторном интернейроне. Модуляторные интернейроны высвобождают серотонин, который запускает синаптическую пластичность мотонейронов.[1] Более того, когда ядовитый раздражитель применялся либо к голове, либо к хвосту и в сочетании с легким прикосновением к сифону, он вызывал сильную двигательную реакцию, называемую рефлекс отдергивания жабр. Доказательства долговременных изменений пластичности были обнаружены несколько дней спустя, когда только легкое прикосновение к сифону вызвало такую же сильную реакцию из-за явления, называемого сенсибилизация. Эти исследования показывают доказательства гетеросинаптического усиления между сенсорными и моторными нейронами в Аплизия схема двигателя.[1][4]
Дофаминергические синапсы
Гетеросинаптическая пластичность не ограничивается только серотонином. Дофамин также было показано, что он действует нейромодулирующим образом. Подобно рецепторам серотонина в Аплизия, Рецепторы дофамина - это рецепторы, связанные с G-белком, которые активируют производство цАМФ. Однако этот процесс важен для хранения воспоминаний в млекопитающие в то время как серотонин встречается у беспозвоночных.[4] В дофаминергическом и ГАМКергическом терминалах нейромодулятор дофамин высвобождается через гетеросинаптическую пластичность. Обычно эта пластичность приводит к длительная депрессия, LTD, опосредованная рецепторами дофамина D1 класса.[13] Активация этих рецепторов необходима для создания LTD и изменения ее величины.[14] Дальнейшие исследования роли дофамина в нейромодуляции также продолжаются. В экспериментах, проведенных в Университете Питтсбурга, рассматривались параллельные проекты дофаминергического и ГАМКергического терминалов из вентральная тегментальная область к прилежащее ядро core (NAcCo) у крыс. В рамках этих параллельных прогнозов ученые обнаружили, что высвобождение дофамина гетеросинаптически запускает LTD в этих синапсах. Таким образом, дофамин является не только нейромодулятором, но также может независимо запускать синаптическую пластичность нейронов.[13] Следовательно, гетеросинаптическая передача сигналов дофамина у млекопитающих может быть лучше всего представлена биологическими функциями дофамина по опосредованию, а также независимому запуску изменений синаптической пластичности.[13]
Изменения пластичности в процессе развития
На ранних этапах развития синаптические связи не зависят от входа, скорее всего, из-за Ca2+ перетекание (т. е. Ca2+ не ограничивается специально активированными дендритами). Этот спилловер представляет собой другой механизм гетеросинаптического изменения пластичности. Позднее сети уточняются за счет специфической для входа пластичности, что позволяет исключить связи, которые специально не стимулируются.[15] По мере созревания нейронных цепей вполне вероятно, что концентрация Ca2+ связывающих белков увеличивается, что предотвращает Ca2+ от распространения на другие сайты. Повышение локализованного Ca2+ приводят к вставке AMPAR в мембрану. Это увеличение плотности AMPA в постсинаптической мембране позволяет NMDAR функционировать, позволяя большему количеству Ca2+ войти в камеру.[16] Субъединицы NMDAR также изменяются по мере созревания нейронов, увеличивая свойство проводимости рецептора.[15][17] Эти механизмы облегчают Ca2+ ограничение местоположения и, следовательно, специфичность по мере развития организма.
Синаптическое масштабирование
Нейронная сеть, которая претерпевает пластические изменения между синапсами, должна запускать механизмы нормализации, чтобы бороться с безудержной потенциацией или депрессией. Один механизм гарантирует, что средняя частота возбуждения этих нейронов поддерживается на разумном уровне через синаптическое масштабирование. В этом процессе уровни ввода изменяются в ячейках для поддержания средней скорости стрельбы. Например, тормозящие синапсы усиливаются или возбуждающие синапсы ослабляются, чтобы нормализовать нейронную сеть и позволить отдельным нейронам регулировать скорость их возбуждения.[1]Другой механизм - это перераспределение синаптического веса в клетке. Этот механизм сохраняет общий синаптический вес в клетке за счет конкуренции между синапсами. Таким образом, нормализация отдельного нейрона после пластичности.[10] Во время развития клетки могут быть очищены, когда одни синапсы сохраняются, а другие отбрасываются, чтобы нормализовать общий синаптический вес. Таким образом, гомеостаз сохраняется в клетках, которые подвергаются пластичности, и нормальная работа обучающих сетей также сохраняется, что позволяет усваивать новую информацию.[10]
Рекомендации
- ^ а б c d е ж Первес, Д., Августин, Дж. Дж., Фицпатрик, Д., Холл, У. К., Ламантия, А.С., Уайт, Л. (2012). Синаптическая пластичность. В неврологии (5-е изд.) (Стр. 163-182). Сандерленд, Массачусетс: Sinauer Associates.
- ^ а б Линч, Г.С., Данвидди, Т., и Грибкофф, В. (1977). Гетеросинаптическая депрессия: постсинаптический коррелят долгосрочной потенциации. Nature 266, 737–739.
- ^ Абрахам, У.С., и Годдард, Г.В. (1983). Асимметричные отношения между гомосинаптической долгосрочной потенциацией и гетеросинаптической долгосрочной депрессией. Nature 305, 717–719.
- ^ а б c d е Бейли, К.Х., Джустетто, М., Хуанг, Ю.Ю., Хокинс, Р.Д., Кандел, Э.Р. (2000) Является ли гетеросинаптическая модуляция необходимой для стабилизации пластичности и памяти Хебба. Nature Reviews Neuroscience, 1: 1, 11-20.
- ^ Ройер, С., и Паре, Д. (2003). Сохранение общего синаптического веса за счет сбалансированной синаптической депрессии и потенциации. Nature 422, 518–522.
- ^ Миллер, К.Д., и Маккей, Д.Дж. (1994). Роль ограничений в обучении на языке Hebbian. Neural Comput 6, 100–126.
- ^ Зенке, Ф., Хеннекен, Г., и Герстнер, В. (2013). Синаптическая пластичность в нейронных сетях требует гомеостаза с помощью высокоскоростного детектора. PLoS Comput Biol 9, e1003330.
- ^ Турриджиано Г.Г., Нельсон С.Б. (2004). Гомеостатическая пластичность в развивающейся нервной системе. Nat Rev Neurosci 5, 97–107.
- ^ Зенке Ф., Герстнер В. и Гангули С. (2017). Временной парадокс обучения Хебба и гомеостатической пластичности. Текущее мнение в нейробиологии 43, 166–176.
- ^ а б c Чистякова М., Волгушев М. (2009) Гетеросинаптическая пластичность неокортекса. Experimental Brain Research, 199, 377-390.
- ^ Чен, Ж.-Й., Лонджерс, П., Ли, К., Чистякова, М., Волгушев, М., Баженов, М. (2013). Гетеросинаптическая пластичность предотвращает убегающую синаптическую динамику. J. Neurosci 33, 15915–15929.
- ^ Чистякова М., Бэннон Н.М., Чен Ж.-Й., Баженов М., Волгушев М. (2015). Гомеостатическая роль гетеросинаптической пластичности: модели и эксперименты. Front Comput Neurosci 9, 89.
- ^ а б c Исикава, М., Отака, М., Хуанг, Ю. Х., Нойман, П. А., Винтерс, Б. Д., Грейс, А. А., Шлютер, О. М., и Донг, Ю. (2013). Дофамин вызывает гетеросинаптическую пластичность. Журнал неврологии, 33 (16), 6759-6765.
- ^ Саджикумар, С., Фрей, Дж. У. (2004). Поздняя ассоциативность, синаптическое тегирование и роль дофамина во время LTP и LTD. Нейробиология обучения и памяти, 82 (1), 12-25.
- ^ а б Санес, Д.Х., Рех, Т.А., Харрис, В.А. (2012). Формирование и функция синапсов, уточнение синаптических связей. В развитии нервной системы (3-е изд.) (Стр. 234-274). Бостон, Массачусетс: Elsevier Inc.
- ^ Хигли, М.Дж., Сабатини, Б.Л. (Февраль 2012 г.) Передача сигналов кальция в дендритных шипах. Перспективы Колд-Спринг-Харбор в биологии. Извлекаются из http://cshperspectives.cshlp.org/. DOI: 10.1101 / cshperspect.a005686.
- ^ Тао, Х.В., Чжан, Л.И., Энгерт, Ф., Пу, М. (август 2001 г.). Появление специфичности входа LTP во время развития ретинотектальных связей in vivo. Нейрон: 31, 569-580.
