Структура Кеггина - Keggin structure



Структура Кеггина самая известная структурная форма для гетерополикислоты. Это структурная форма анионов α-Кеггина, которые имеют общую формулу [XM12О40]п−, где X - гетероатом (чаще всего P5+, Si4+, или B3+), M - атом слагаемого (наиболее распространены молибден и вольфрам ), а O представляет кислород.[1] Структура самоорганизуется в кислом водном растворе и является наиболее стабильной структурой полиоксометаллата. катализаторы.
История
Первый анион α-Кеггина, фосфомолибдат аммония ((NH4)3[PMo12О40]), впервые сообщил Берцелиус в 1826 г. В 1892 г. Бломстранд предложил структуру фосфорномолибденовая кислота и другие поликислоты в виде цепной или кольцевой конфигурации. Альфред Вернер, с использованием координационные соединения идеи Копо, попытались объяснить структуру кремневольфрамовая кислота. Он предположил центральную группу [SiO4]4− ion, заключенный в четыре [RW2О6]+, где R - униположительный ион. [RW2О6]+ связаны с центральной группой первичными валентности. Еще два R2W2О7 группы были связаны с центральной группой вторичными валентностями. Это предложение учитывает характеристики большинства поликислот, но не всех.
В 1928 г. Линус Полинг предложили структуру анионов α-Кеггина, состоящую из четырехгранный центральный ион, [XO4]п−8, в клетке двенадцатью WO6 октаэдры. В этой предлагаемой структуре три кислорода на каждом из октаэдры общие электроны с тремя соседними октаэдрами. В результате 18 атомов кислорода использовались как мостиковые атомы между атомами металла. Остальные атомы кислорода, связанные с протон. Эта структура объясняет многие наблюдаемые характеристики, такие как основность щелочной металл соли и гидратированная форма некоторых солей. Однако структура не могла объяснить структуру обезвоженный кислоты.
Джеймс Фаргер Кеггин с использованием дифракция рентгеновских лучей экспериментально определил структуру анионов α-Кеггина в 1934 году. Структура Кеггина учитывает как гидратированные, так и дегидратированные анионы α-Кеггина без необходимости значительных структурных изменений. Структура Кеггина является широко принятой структурой для анионов α-Кеггина.[2]
Структура и физические свойства
 =
= +
+
В структуре есть полная тетраэдрическая симметрия и состоит из одного гетероатом окруженный четырьмя атомами кислорода, чтобы сформировать тетраэдр. Гетероатом расположен по центру и заключен в клетку на 12 восьмигранный МО6-единицы, связанные друг с другом соседними атомами кислорода. Всего имеется 24 мостиковых атома кислорода, которые связывают 12 дополнительных атомов. Металлические центры в 12 октаэдрах расположены на сфере почти равноудаленный друг от друга, в четырех M3О13 единиц, придавая всей структуре общую тетраэдрическую симметрию. В длина облигации между атомами варьируется в зависимости от гетероатома (X) и атомов присоединения (M). Для 12-фосфорновольфрамовой кислоты Кеггин определил длину связи между гетероатомом и каждым из четырех центральных атомов кислорода равной 1,5.Å. Длина связи от центрального кислорода к атомам присоединений составляет 2,43 Å. Длина связи между атомами присоединения и каждым мостиковым кислородом составляет 1,9 Å. Остальные 12 атомов кислорода, каждый из которых связан двойной связью с атомом присоединения, имеют длину связи 1,70 Å. Поэтому октаэдры искажаются.[3][4] Эта структура позволяет молекуле гидратироваться и дегидратироваться без значительных структурных изменений, и молекула термически стабильна в твердом состоянии для использования в парофазных реакциях при высоких температурах (400-500 ° C).[5]
Изомерия
Включая оригинальную структуру Кеггина, есть 5 изомеры, обозначаемые префиксами α-, β-, γ-, δ- и ε-. Исходная структура Кеггина обозначается α-. Эти изомеры иногда называют изомерами Бейкера, Бейкера-Фиггиса или вращательными изомерами,[6] Они связаны с различными вращательными ориентациями Mo3О13 единиц, что снижает симметрию всей конструкции.
Лакунарные структуры Кеггина
Период, термин лакунарный применяется к ионам, у которых отсутствует фрагмент, иногда называемым дефектными структурами. Примеры: (XM11О39)п− и (XM9О34)п− образованный удалением из структуры Кеггина достаточного количества атомов Mo и O для удаления 1 или 3 соседних МО6 октаэдры. Структура Доусона, X2M18О62п−, состоит из двух лакунарных фрагментов Кеггина с 3 недостающими октаэдрами.
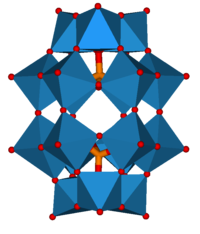
Катионы группы 13 со структурой Кеггина
Катион кластера (Al13О4(ОЙ)24(ЧАС2O)12)7+ имеет структуру Кеггина с тетраэдрическим атомом Al в центре кластера, координированным с 4 атомами кислорода. Формулу можно выразить как (AlO4Al12(ОЙ)24(ЧАС2O)12)7+.[7] Этот ион обычно называют ионом Al13. Известен аналог Ga13.[8] было охарактеризовано необычное ионное соединение с катионом Al13 и полиоксоанионом Кеггина.[9]
Железный ион Кеггина
Из-за схожего химического состава алюминия и железа долгое время считалось, что аналогичный поликатион железа должен быть изолирован от воды. Более того, в 2007 году была определена структура ферригидрита, которая состоит из ионов Кеггина железа.[10] Это еще больше захватило воображение ученых и их стремление выделить железный ион Кеггина. В 2015 г. ион Кеггина железа был выделен из воды, но в виде полианиона с зарядом −17; и требовалась защита химии.[11] Вода, связанная с железом, очень кислая; поэтому сложно захватить промежуточную форму иона Кеггина без объемных и непротонных лигандов вместо воды, которая содержится в ионе Кеггина алюминия. Однако более важным в этом синтезе был висмут (Bi3+) противоионы, которые обеспечивают высокий положительный заряд для стабилизации высокого отрицательного заряда гептадекавалентного полианиона.
Химические свойства
Стабильность структуры Кеггина позволяет металлам в анионе легко растворяться. уменьшенный. В зависимости от растворитель, кислотность раствора и заряда на анионе α-Кеггина, он может быть обратимо уменьшен за одно- или многоэлектронные шаги.[12] Например, силиковольфраматный анион может быть восстановлен до 20-го состояния.[13] Некоторые анионы, такие как кремневольфрамовая кислота, достаточно сильны в качестве кислоты, как серная кислота и может использоваться вместо него в качестве кислотного катализатора.
Подготовка
Как правило, анионы α-Кеггина синтезируются в кислых растворах. Например, 12-Фосфорновольфрамовая кислота образуется путем конденсации фосфат-иона с ионами вольфрамата. Образующаяся гетерополикислота имеет структуру Кеггина.[5]
- PO3−
4 + 12 WO2−
4 + 27 часов+ → H3PW12О40 + 12 часов2О
Использует
Анионы α-Кеггина использовались в качестве катализатора в следующих реакциях: гидратация, полимеризация и окисление реакция как катализаторы.[5] Японские химические компании коммерциализировали использование соединений для гидратации пропен, окисление метакролеин, увлажнение изобутен, увлажнение п-бутен, и полимеризация из THF.[14][15]
Поставщики
12-Фосфорновольфрамовая кислота, соединение J.F. Keggin, используемое для определения структуры, можно приобрести коммерчески. Другие соединения, содержащие анион α-Кеггина, такие как кремневольфрамовая кислота и фосфорномолибденовая кислота также коммерчески доступны на Aldrich Chemicals, Fisher Chemicals, Альфа Эзар, VWR Chemical, Американские элементы, так далее.
использованная литература
- ^ Housecroft, C.E .; Шарп, А. Г. (2004). Неорганическая химия (2-е изд.). Прентис Холл. С. 660–662. ISBN 978-0-13-039913-7.
- ^ Дж. К. Байлар-младший Химия координационных соединений, Reinhold Publishing Corporation, 1956, стр. 472-482.
- ^ Дж. Ф. Кеггин. Proc. Рой. Soc., А, 144, 75-100 (1934)
- ^ Г. Коричневый; М.Р. Ноэ-Спирлет; W.R. Bursing; Х.А. Леви. Acta. Cryst. B33, 1038-1046 (1977)
- ^ а б c Ю. Идзуми; К. Урабе; М. Онака. Цеолит, глина и гетерополикислота в органических реакциях, Kodansha Ltd., Tokoyo 1992, стр. 100-105.
- ^ Новый фундаментальный тип неорганических комплексов: гибрид гетерополии и обычных координационных комплексов. Возможности геометрических изомеризм в производных 11-, 12-, 17- и 18-гетерополии. LCW Baker, Журнал JS Figgis Американского химического общества 92 (12), 3794-3797 (1970)
- ^ Гринвуд, Норман Н.; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн. ISBN 978-0-08-037941-8.
- ^ Обнаружение новых полимерных частиц, образующихся в результате гидролиза растворов солей галлия (III) С. М. Брэдли, Р. А. Кидд и Р. Ямдагни J. Chem. Soc., Dalton Trans., 1990, 413 - 417, Дои:10.1039 / DT9900000413
- ^ Новые ионные кристаллы противоположно заряженных кластерных ионов и их характеристика Чон Хо Сон и Ён-Ук Квон Инорг. Chem., 42 (13), 4153-4159, (2003) Дои:10.1021 / ic0340377
- ^ Ф. М. Мишель, Л. Эм, С. М. Антао и др. Наука, 316, 1726-1729 (2007)
- ^ О. Садеги, Л. Н. Захаров, М. Найман, Водное образование и манипулирование железо-оксо ионом Кеггина Наука; 2015; 347 (6228), стр. 1359–1362; Дои:10.1126 / science.aaa4620
- ^ Т. Окухара; Н. Мизуно; М. Мисоно. Достижения в Cayalysis, Том 41: Каталитическая химия гетерополисоединений. Academic Press Inc., 1996, стр. 191-193.
- ^ M.T. Папа. Концепции неорганической химии 8: гетерополия и изополия оксометаллатов. Springer-Verlag, Heidelberg, 1983, стр. 101-107.
- ^ M.T. Папа; А. Мюллер. Полиоксометаллаты: от твердых платоновых тел до антиретровирусной активности. Kluwer Academic Publications, Нидерланды, 1994, стр. 262-265.
- ^ T.J. Бартон; L.M. Bull; W.G. Klemperer; Д.А. Лой; Б. Макинэнси; М. Мисоно; и т.п. Chem. Mater. 11, 2633—2656 (1999)
