MTRR (ген) - MTRR (gene)
Метионинсинтаза редуктаза также известен как MSR является фермент что у людей кодируется MTRR ген.[5][6]
Функция
Метионин является важным аминокислота необходим для синтеза белка и одноуглеродный метаболизм. Его синтез катализируется ферментом метионинсинтаза. Метионинсинтаза со временем становится неактивной из-за окисления ее кобаламин кофактор. Редуктаза метионинсинтазы восстанавливает функциональную метионинсинтазу посредством восстановительного метилирования. Он является членом семейства ферредоксин-НАДФ (+) редуктазы (FNR) электронных трансфераз.[6]
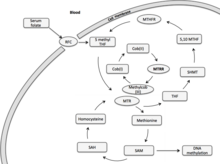
Редуктаза метионинсинтазы (MTRR) в первую очередь участвует в восстановительном метилировании гомоцистеина до метионина, используя метилкоб (I) аламин в качестве промежуточного метильного носителя.[7] Метионин - незаменимая аминокислота у млекопитающих, необходимая для синтеза белка и метаболизма одного углерода. В активированной форме S-аденозилметионин действует как донор метила в реакциях биологического трансметилирования и как донор пропиламина в синтезе полиаминов.[7] Основным продуктом деметилирования метионина является гомоцистеин. Реметилирование гомоцистеина происходит через кобаламин-зависимый фермент, метионинсинтазу (MTR).[7] Цикл фолиевой кислоты связан с метаболизмом гомоцистеина через MTR.[8] Циркулирующий фолат крови (5-метилтетрагидрофолат, 5-MTHF) отдает метильные группы MTR для использования в метилировании клеток. Метилкобальтовая связь промежуточного метильного носителя, метилкоба (III) аламина, гетеролитически расщепляется с образованием кобаламина в его высокореакционной степени окисления как cob (I) alamin. Связанный с ферментом кофактор аламин cob (I) фермента MTR действует как метильный носитель между 5-MTHF и гомоцистеином.[7] Cob (I) alamin окисляется до cob (II) alamin примерно раз в 100 циклов переноса метила, что делает комплекс cob (I) аламин-MTR-фермент неактивным.[9] Реактивация этого ферментного комплекса происходит посредством восстановительного реметилирования с помощью MTRR с использованием S-аденозилметионина в качестве донора метила. Реактивация MTR также может быть NADPH-зависимой с участием двух окислительно-восстановительных белков, растворимого цитохрома b5 и редуктазы 1. Однако этот путь отвечает за второстепенную роль в реактивации, в то время как MTRR остается основным участником этой восстановительной реактивации.
Биологические процессы, на которые влияет MTRR, включают: метаболический процесс серы и аминокислот, метилирование ДНК, метаболический процесс метионина, процесс биосинтеза метионина, метилирование, цикл S-аденозилметионина, катаболический процесс гомоцистеина, метаболический процесс фолиевой кислоты, окислительно-восстановительный процесс и отрицательное регулирование цистатионина бета. -синтазная активность.[7][8]
Ген MTRR
Редуктаза метионинсинтазы (MTRR) в первую очередь участвует в восстановительной регенерации аламина cob (I) (витамин B12).[10] Cob (I) alamin - кофактор, который поддерживает активацию фермента метионинсинтазы (MTR). Метионинсинтаза, связывая метаболизм фолиевой кислоты и метионина. Метильные группы фолиевой кислоты используются для метилирования клеток и ДНК, влияя на эпигенетическое наследование.[10][7][11]
Псевдонимы
- Редуктаза 5-Метилтетрагидрофолат-Гомоцистеин Метилтрансфераза
- MSR
- [Метионинсинтаза] - Метилтрансфераза кобаламина (Cob (II) Alamin Reduction)
- Метионинсинтаза редуктаза, митохондрии
- EC 1.16.1.8
- CblE
Картография
Ген был картирован на хромосоме 5 человека. Пары специфичных для генов праймеров привели к амплификации продукта с помощью ПЦР, соответствующего по размеру панели гибридного картирования, содержащей только хромосому 5 в качестве генетического материала человека.[5] Последовательность ДНК продукта соответствовала заранее установленным генным маркерам, специфичным для этой хромосомы. Точное цитогенное положение гена определяли путем сопоставления с искусственной хромосомной конструкцией, содержащей ген, посредством флуоресцентной гибридизации in situ.[5] Точное расположение гена MTRR было сопоставлено с 5p15.3-p15.2.[5]
Структура
Ген MTRR связан с семейством электронных трансфераз, известным как семейство ферредоксин-НАДФ (+) редуктазы (FNR). Обнаруженный у 15 приматов и более чем в 16 тканях человека, MTRR имеет длину 34 т.п.н.[12] Ген состоит из 15 экзонов и включает многочисленные цитологические изоформы митохондриальной мРНК. Множественные сайты связывания кофакторов помогают поддерживать активность MTR за счет восстановительного реметилирования. Все связывающие домены включают селективные и нековалентные взаимодействия, за исключением домена флаводоксин_1.[12]
Сайты связывания кофакторов
Флаводоксин-1 домен
Флавопротеины - это повсеместные биокатализаторы, связывающие специфические окислительно-восстановительные группы простетических клеток. Домен связан с белками переноса электронов и используется в системах переноса электронов.[12] Кофактор флавин-мононуклеотид (FMN) нековалентно связан с доменом, который функционально взаимозаменяем с железо-серными белками, регулирующими перенос электронов, или ферредоксинами.[12]
FAD
Флавинадениндинуклеотид в окисленной форме, FAD, является кофактором ферментов флавопротеин оксидоредуктазы. Флавопротеинпиридиннуклеотид-цитохромредуктазы, в том числе FAD, катализируют обмен восстанавливающими эквивалентами (H + или электронами). Исходные доноры электронов и конечные акцепторы электронов включают в себя одноэлектронные носители и два электронных носителя никотинамиддинуклеотида соответственно.[12]
НАД
Эволюционно консервативный домен белка, соответствующий активности оксидоредуктазы. Связывание NAD катализирует окислительно-восстановительные реакции для изменения степени окисления ионов металлов, используя NADP + в качестве акцептора электронов.[12]
Активность метионинсинтазы редуктазы
Участвует в восстановительном реметилировании cob (II) alamin с использованием S-аденозилгомоцистеина в качестве донора метила. Катализирует реакцию:
[метионинсинтаза] - cob (II) аламин + NADPH + H + + S-аденозилметионин → [метионинсинтаза] -метилкоб (I) аламин + S-аденозилгомоцистеин + NADP +.[12]
Аквакобаламин редуктаза (НАДФН) активность
Принадлежит к семейству оксидоредуктаз, окисляющих ионы металлов с НАДФ +, действующим как акцептор электронов. Использует ФАД в качестве кофактора при катализе следующей реакции:
2коб (II) аламин + НАДФ + 2аквакоб (III) аламин + НАДФН + Н +.[12]
Флавин аденин динуклеотид
Взаимодействует с кофактором или простетической группой, FAD флавопротеинов и содержит флавиновую составляющую в форме FAD или FMN (флавинмононуклеотид). Этот домен нековалентно связывает окисленный FAD или его восстановленную форму, гидрохинон (FADH2).[12]
FMN
Флавинмононуклеотидсвязывающий домен взаимодействует с коферментом ферментов флавопротеин оксидоредуктазы, FMN.[12]
НАДФ
Никотинамидадениндинуклеотидфосфат представляет собой кофермент, участвующий в окислительно-восстановительных и биосинтетических реакциях. Домен связывает НАДФ в его окисленной или восстановленной форме как НАДФ + или НАДФН соответственно.[12]
ADPH
Включает нековалентное и селективное взаимодействие с восстановленной формой НАДФ, НАДФН.[12]
НАДФН-гемопротеинредуктазная активность
Домен связан с семейством оксидоредуктаз и действует на NADH или NADPH, используя гемовый белок в качестве акцептора электронов. Требуется FAD и FMN в качестве кофакторов для катализа реакции:
НАДФ + Н + + n окисленный гемопротеин = НАДФ + + n восстановленный гемопротеин.[12]
Связывание с белками
Связывающий домен участвует во взаимодействии с белками или белковыми комплексами.[12]
Полиморфизмы
Патогенные мутации
- (MTRR): c.66A> G - Полиморфизм, приводящий к превращению изолейцина в метионин в кодоне 22. Эта мутация обнаруживается внутри связывающего домена FMN и влияет на него.[13]
- (MTRR): c.524C> T - Замена серина на лейцин в кодоне 175. Доброкачественная мутация, связанная с нарушением внутриклеточного метаболизма кобаламина.[14]
- (MTRR): c.1049A> G - Замена лизина на аргинин в кодоне 350.[15]
- (MTRR): c.1349C> G - Замена пролина на аргинин в кодоне 450. Распространенность, связанная с аномальными нарушениями внутриклеточного метаболизма кобаламина.[16]
- (MTRR): c.903 + 469T> C - Глубокая интронная вставка между экзонами 6 и 7 (r.903_904ins140). Изменение треонина на цистеин, приводящее к активации энхансера сплайсинга экзонов в интроне 6.[17]
- (MTRR): c.1361C> T - Редкий полиморфизм, включающий замену серина на лейцин в кодоне 454. Известная как иберийская мутация, распространенная при гомоцистинурии мегалобластной анемии из-за нарушения метаболизма кобаламина. В основном три различных галогенотипа (GTACG, GCACA, GCACG) от дезаминирования метилцитозина в разных хромосомах.[18]
- (MTRR): c.1459G> A - Включает глицин в замену аргинина в кодоне 487. Консервативен в MTRR и обнаружен в связывающем домене FAD. Патогенность, связанная с врожденными генетическими заболеваниями.[19]
- (MTRR): c.1573C> T - Замена аргинина на кодон преждевременной терминации в кодоне 525.[20]
- (MTRR): c.1622_1623dupTA - Приводит к образованию кодона преждевременной терминации. Патогенность связана с гомоцистинурией типа CblE.[21]
- (MTRR): r.1462_1557del96 - Связан со сплайсингом 11 экзона из-за делеции 7 пар оснований. Большая делеция этого мутантного аллеля приводит к отсутствию c-конца в связывающем домене FAD. Патогенность связана с гомоцистинурией типа CblE.[21]
- (MTRR): c.1953-6_1953-2del5 - Новая мутация, связанная с гомоцистинурией типа CblE. Нестабильная мРНК, возникающая из этого мутанта, приводит к отсутствию мРНК, необходимой для трансляции, что вызывает патогенность.[21]
Мутации, участвующие в образовании кодонов преждевременной терминации, при трансляции приводят к усеченным мутированным белкам.[21] Мутанты демонстрируют отсутствие связывающих доменов FAD / NADPH и нестабильной мРНК из-за нонсенс-опосредованного распада (NMD). NMD отсутствует в полиморфизмах (MTRR): c.1573C> T или (MTRR): c.1622_1623dupTA.[21] Вариант (MTRR): c.903 + 469T> C также связан с образованием кодонов преждевременной терминации.[21]
Другие мутации
- (MTRR): c.1911G> A ¬– Доброкачественная синонимичная мутация (от аланина к аланину) в кодоне 637. Связана с нарушениями метаболизма кобаламина.[22]
Клиническое значение
Эта секция нужно больше медицинские справки для проверка или слишком сильно полагается на основные источники. (Октябрь 2017 г.) |
Однонуклеотидные полиморфизмы (SNP) в гене MTRR ухудшают активность MTR, что приводит к повышенным уровням гомоцистеина из-за нарушения метилирования до метионина. Повышенный уровень гомоцистеина связан с врожденными дефектами, а также с осложнениями беременности, сердечно-сосудистыми заболеваниями, раком и т. Д.[23] мегалобластная анемия, болезнь Альцгеймера и когнитивная дисфункция у пожилых людей.[24] Наличие мутантного варианта (66A> G) связано со значительно более низкими, до 4-кратными, уровнями кобаламина и фолиевой кислоты в плазме у пациентов с трансплантатом сердца.[23] Последующее снижение доступности S-аденозилметионина приводит к гипометилированию ДНК. Низкий уровень фолиевой кислоты ограничивает метаболизм одного углерода и метаболизм гомоцистеина, поскольку витамин B12 взаимодействует с фолатом в этом пути.[24] Кроме того, эта мутация связана с повышенным риском диабета 2 типа.[25]
Рак
Специфические SNP связаны с повышенным риском рака легких и при этой этиологии влияют на потребление фолиевой кислоты с пищей. Мутация (MTRR): c.66A> G связана со значительным увеличением риска рака легких. При совместной экспрессии с полиморфизмом (MTR): 2756A> G риск рака легких дополнительно увеличивается в зависимости от дозы.[24] Корреляция между этим полиморфизмом и повышенным риском рака легких присутствует при низком потреблении фолиевой кислоты и высоком уровне витамина B12, что предполагает независимый от B12 механизм действия.[24] Эта мутация также связана с повышенным риском колоректального рака,[26][27][28][29] острый лимфобластный лейкоз,[30] Рак мочевого пузыря,[31] цервикальная интраэпителиальная неоплазия, неходжкинская лимфома[32] и плоскоклеточный рак пищевода.[33]
CblE тип гомоцистинурии
Для реметилирования гомоцистеина в метионин с помощью MTR требуется производное кобаламина, метилкобаламин. Метаболизм кобаламина инициируется эндоцитозом кобаламина, связанного с белком плазмы крови транскобаламином (II). При расщеплении этого комплекса образуется свободный кобаламин, перемещающийся из лизосомы в цитоплазму. Превращение может происходить в 5’-дезоксиаденозилкобаламин (AdoCbl), активирующий митохрондриальный фермент метилмалонли-кофермент А-мутазу, или в метилкобаламин (MeCbl).[34] Ошибка метаболизма кобаламина, приводящая к снижению MeCbl и сохранению AdoCbl, характерна для гомоцистинурии типа CblE.[34] Это дополнение редко встречается при аутосомно-рецессивном наследовании. Унаследованный функциональный дефицит метионинсинтазы соответствует дефекту в восстанавливающей системе, необходимой для активации фермента MTR. Симптомы этого состояния включают задержку развития, мегалобластную анемию, гомоцистинурию, гипометионинемию, церебральную атрофию и гипергомоцистеинемию.[34] Однако гипометионинемия остается непостоянным симптомом. Снижение MeCbl наряду с нормальным поглощением кобаламина указывает на снижение внутриклеточного биосинтеза метионина. Возникающие в основном в детском возрасте, 15 патогенных мутаций могут быть связаны с гомоцистинурией типа CblE.[35] Кроме того, с этим дефектом связаны сосудистые аномалии.[36] Нарушение восстановления окисленного атома кобальта в активном центре MTR связано с этим состоянием, при котором активность фермента может быть скорректирована восстановителями.[35] Редкие полиморфизмы, связанные с этим заболеванием, включают (MTRR): c.1459G> A, (MTRR): c.1623-1624insTA и (MTRR): c.903 + 469T> C.[35] Эти мутации, за исключением (MTRR): c.1459G> A, приводят к сдвигу рамки считывания с образованием кодонов преждевременной терминации.[35] Поскольку последующие продукты далеки от нормальных, возникает мутантная мРНК и инициируется нонсенс-опосредованный распад (FMN).[35] Большая вставка 903_904ins140, соответствующая 903 + 469T> C, наиболее распространена при патологии CblE. Активация усиленного сплайсера в интроне 6 является неполной, производя небольшие количества нормальной сплайсированной мРНК MTRR.[35] Пренатальная диагностика этого состояния возможна с использованием [14C] метилтетрагидрофолата.[35] Анализ мутаций в нативных ворсинах хориона и [14C] формиат в аминокислотах в этих ворсинах или культивируемых амниоцитах указывает на дефект CblE.[35] Кроме того, макроцитарная анемия является типичным признаком дефекта CblE и может быть исправлена введением ОН-кобаламина или добавками фолиевой кислоты.[35]
Ишемическая болезнь сердца
Гомоцистеин, аминокислота на основе серы, является основным продуктом деметилирования метионина. Повышенный уровень гомоцистеина является независимым фактором риска сердечно-сосудистых заболеваний и обратно коррелирует с потребляемыми уровнями витаминов B12 / B6 и фолиевой кислоты.[37] Метилирование гомоцистеина до метионина катализируется MTR, что приводит к соответствующим внутриклеточным уровням метионина и тетрагидрофолата наряду с уровнями нетоксичного гомоцистеина. Фенотип GG способствует развитию преждевременной ишемической болезни сердца (ИБС) независимо от гипергомоцистеинемии.[37] Гипергомоцистеинемия связана с церебральной, коронарной и периферической атеросклеротической патологией, поскольку она способствует дисфункции эндотелиальных клеток, адгезии тромбоцитов и пролиферации гладкомышечных клеток сосудов.[36] Повреждение ДНК и уровни гомоцистеина пропорциональны тяжести ИБС. Частота микронуклеусов в лимфоцитах человека, зависящая от уровней гомоцистеина, увеличивает количество активных форм кислорода и включение урацила в метилирование ДНК, способствуя генетическим изменениям и точечным мутациям.[36] Полиморфизм (MTRR): c.66A> G, содержащий хромосому, склонен к фрагментации. Эта хромосомная потеря или глобальное гипометилирование ДНК приводит к недостаточной конденсации перицентромерного гетерохроматина, образованию микроядер и повышенному риску анеуплоидии.[36] Совместная экспрессия этой мутации и полиморфизма 677T в метионинтетрагидрофолатредуктазе (MTHFR) Метилентетрагидрофолатредуктаза действуют, чтобы увеличить степень повреждения ДНК.[36]
Гипометилирование из-за нарушения метилирования усиливает гены, чувствительные к атеросклерозу, в то время как гены, защищающие от атеросклероза, снижают его.[36] Эта аномалия присутствует во время атеросклеротической патологии, увеличивая транскрипционную активность фактора роста тромбоцитов (PDGF) и способствуя пролиферации гладкомышечных клеток.[36]
Дефекты нервной трубки
Расщелина позвоночника
MTRR требует витамина B12 для поддержания реакции метилсинтазы, в то время как фолат необходим для нормального синтеза предшественников нуклеотидов. Они обеспечивают нормальный синтез ДНК и реакции метилирования клеток.[7] Таким образом, хроническая недостаточность фолиевой кислоты или метила связана с аномальным метилированием ДНК. Полиморфизм 66A> G активируется при дефектах нервной трубки и увеличивает риск расщепления позвоночника в два раза.[38] Гомозиготность по этой мутации - установленный фактор риска у матери для расщелины позвоночника, особенно при низком уровне внутриклеточного витамина B12.[39] в кровообращении или околоплодных водах.[13] Витамин B12 отражается в метилмалоновой кислоте плазмы (MMA), повышение которой указывает на нарушение усвоения или метаболизма B12.[7] Повышенный MMA в сочетании с мутацией MTRR соответствует 5-кратному увеличению spina bifida.[7] Механизм действия этого полиморфизма - через мать, следовательно, нет никакой преимущественной передачи этой мутации от родителя к ребенку. Аномальное связывание MTRR с комплексом MTR-cob (I) аламин-фермент снижает скорость метилирования гомоцистеина. Последующее снижение уровня метионина и S-аденозилметионина отрицательно влияет на метилирование ДНК, генов и белков, все из которых участвуют в закрытии нервной трубки.[7] Повышенная пролиферация во время нейруляции снижает доступность нуклеотидов ДНК. Поскольку они не могут быть заменены из-за нарушения метилирования ДНК и образования нуклеотидов, последующее нарушение нейруляции приводит к образованию дефектов нервной трубки.[11] Совместная экспрессия этой мутации с полиморфизмом 677C> T MTHFR увеличивает риск расщелины позвоночника по сравнению с независимой действующей мутацией 66A> G.[7]
Синдром Дауна
Трисомия 21 или Синдром Дауна является наиболее распространенной хромосомной аномалией человека, возникающей в результате аномальной хромосомной сегрегации в мейозе.[10][11][40] Состояние может возникать во время анафазы в мейозе (I), обозначающем созревание ооцитов перед овуляцией, и / или во время анафазы в мейозе (II), обозначающем оплодотворение.[11] На метаболический эффект на этих этапах влияет низкий уровень витамина B12.[41] На метилирование гомоцистеина до метионина влияет, в первую очередь, полиморфизм (MTRR): c.66A> G. Хроническое повышение уровня гомоцистеина увеличивает уровни s-аденозил-L-гомоцистеина, следовательно, ингибирует активность метилтрансферазы и способствует гипометилированию ДНК.[10][42] Матери, гомозиготные по этой мутации (фенотип GG), подвергаются большему риску рождения ребенка с синдромом Дауна по сравнению с гетерозиготами (фенотип GA).[41] Географически ирландские популяции с большей вероятностью будут гомогенными, в то время как североамериканские популяции обычно гетерогенны, что приводит к большей распространенности полиморфизма в первой группе.[11][41] Гомозиготный мутантный аллель способствует гипометилированию ДНК и мейотическому нерасхождению, увеличивая риск синдрома Дауна.[43] Этот полиморфизм коррелирует с 2,5-кратным увеличением риска независимо и 4-кратным увеличением риска при совместной экспрессии с мутацией 677C> T MTHFR.[11] Комбинация с генетическим полиморфизмом MTR2756A> G дополнительно повышает риск синдрома Дауна.[11][42][44]
Смотрите также
использованная литература
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000124275 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000034617 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ а б c d Леклерк Д., Уилсон А., Дюма Р., Гафуик С., Сонг Д., Уоткинс Д., Хенг Х. Х., Ромменс Дж. М., Шерер С.В., Розенблатт Д.С., Гравий РА (март 1998 г.). «Клонирование и картирование кДНК для метионинсинтазы редуктазы, флавопротеина, дефектного у пациентов с гомоцистинурией». Труды Национальной академии наук Соединенных Штатов Америки. 95 (6): 3059–64. Дои:10.1073 / pnas.95.6.3059. ЧВК 19694. PMID 9501215.
- ^ а б "Ген Entrez: MTRR 5-метилтетрагидрофолат-гомоцистеинметилтрансфераза редуктаза".
- ^ а б c d е ж г час я j k ван дер Линден И.Дж., ден Хейер М., Афман Л.А., Геллекинк Х., Вермейлен С.Х., Клуйтманс Л.А., Блом Х.Дж. (декабрь 2006 г.). «Полиморфизм метионинсинтазы редуктазы 66A> G является фактором риска развития расщелины позвоночника у матери». Журнал молекулярной медицины. 84 (12): 1047–54. Дои:10.1007 / s00109-006-0093-x. PMID 17024475. S2CID 24500664.
- ^ а б Чжан Т., Лу Дж., Чжун Р., Ву Дж, Цзоу Л., Сунь И, Лю X, Лю Л., Мяо X, Сюн Дж. (2013). «Генетические варианты фолатного пути и риск дефектов нервной трубки: метаанализ опубликованной литературы». PLOS ONE. 8 (4): e59570. Дои:10.1371 / journal.pone.0059570. ЧВК 3617174. PMID 23593147.
- ^ Вон Дж. Д., Бейли Л. Б., Шелнутт К. П., Данвуди К. М., Маневал Д. Р., Дэвис С. Р., Куинливан Е. П., Грегори Дж. Ф., Териак Д. В., Кауэлл Г.П. (ноябрь 2004 г.). «Полиморфизм метионинсинтазы редуктазы 66A-> G связан с повышенной концентрацией гомоцистеина в плазме при сочетании с гомозиготным вариантом метилентетрагидрофолатредуктазы 677C-> T». Журнал питания. 134 (11): 2985–90. Дои:10.1093 / jn / 134.11.2985. PMID 15514263.
- ^ а б c d Ван СС, Цяо Ф.Й., Фэн Л., Лв Дж.Дж. (февраль 2008 г.). «Полиморфизмы генов, участвующих в метаболизме фолиевой кислоты, как факторы риска материнского синдрома Дауна в Китае». Журнал науки B Чжэцзянского университета. 9 (2): 93–9. Дои:10.1631 / jzus.B0710599. ЧВК 2225490. PMID 18257130.
- ^ а б c d е ж г Hobbs CA, Sherman SL, Yi P, Hopkins SE, Torfs CP, Hine RJ, Pogribna M, Rozen R, James SJ (сентябрь 2000 г.). «Полиморфизм генов, участвующих в метаболизме фолиевой кислоты, как фактор риска развития синдрома Дауна у матери». Американский журнал генетики человека. 67 (3): 623–30. Дои:10.1086/303055. ЧВК 1287522. PMID 10930360.
- ^ а б c d е ж г час я j k л м п «MTRR - редуктаза метионинсинтазы - Homo sapiens (человек) - ген и белок MTRR». Получено 2017-09-16.
- ^ а б Уилсон А., Платт Р., Ву К., Леклерк Д., Кристенсен Б., Ян Х., Гравел Р. А., Розен Р. (август 1999 г.). «Распространенный вариант редуктазы метионинсинтазы в сочетании с низким содержанием кобаламина (витамина B12) увеличивает риск расщелины позвоночника». Молекулярная генетика и метаболизм. 67 (4): 317–23. Дои:10.1006 / мг.1999.2879. PMID 10444342.
- ^ Хасан FM, Хаттаб А.А., Або Эль Фото WM, Зидан Р.С. (сентябрь 2017 г.). «Полиморфизмы A66G и C524T гена редуктазы метионинсинтазы связаны с развитием бледных врожденных пороков сердца у детей Египта». Ген. 629: 59–63. Дои:10.1016 / j.gene.2017.07.081. PMID 28778621.
- ^ G ">"NM_002454.2 (MTRR): c.1049A> G (p.Lys350Arg) И не указано - ClinVar - NCBI". Получено 2017-09-16.
- ^ G ">«NM_002454.2 (MTRR): c.1349C> G (p.Pro450Arg) И нарушения внутриклеточного метаболизма кобаламина - ClinVar - NCBI». Получено 2017-09-16.
- ^ Хомолова К., Завадакова П., Доктор Т.К., Шредер Л.Д., Козич В., Андресен Б.С. (апрель 2010 г.). «Глубокая интронная мутация c.903 + 469T> C в гене MTRR создает энхансер экзонного сплайсинга, связывающий SF2 / ASF, что приводит к активации псевдоэксона и вызывает гомоцистинурию типа cblE». Человеческая мутация. 31 (4): 437–44. Дои:10.1002 / humu.21206. ЧВК 3429857. PMID 20120036.
- ^ Т ">"NM_002454.2 (MTRR): c.1361C> T (p.Ser454Leu) Simple - Отчет об изменениях - ClinVar - NCBI". Получено 2017-09-16.
- ^ A ">«NM_002454.2 (MTRR): c.1459G> A (p.Gly487Arg) AND Врожденные генетические заболевания - ClinVar - NCBI». Получено 2017-09-16.
- ^ Т ">"NM_002454.2 (MTRR): c.1573C> T (p.Arg525Ter) И не предоставляется - ClinVar - NCBI". Получено 2017-09-16.
- ^ а б c d е ж Завадакова П., Фаулер Б., Суормала Т., Новотна З., Мюллер П., Хеннерманн Дж. Б., Земан Дж., Виласека М. А., Вилариньо Л., Гутче С., Вилиховски Е., Хорнефф Г., Козич В. (2005). «cblE-тип гомоцистинурии из-за недостаточности метионинсинтаза-редуктазы: функциональная коррекция экспрессией минигена». Человеческая мутация. 25 (3): 239–47. Дои:10.1002 / humu.20131. PMID 15714522. S2CID 17183484.
- ^ A ">"NM_002454.2 (MTRR): c.1911G> A (p.Ala637 =) Simple - Variation Report - ClinVar - NCBI". Получено 2017-09-16.
- ^ а б Ван П., Ли С., Ван М., Хе Дж, Си С. (2017). «Связь полиморфизма MTRR A66G с предрасположенностью к раку: данные 85 исследований». Журнал рака. 8 (2): 266–277. Дои:10.7150 / jca.17379. ЧВК 5327376. PMID 28243331.
- ^ а б c d Shi Q, Zhang Z, Li G, Pillow PC, Hernandez LM, Spitz MR, Wei Q (август 2005 г.). «Полиморфизмы метионинсинтазы и метионинсинтазы редуктазы и риск рака легких: анализ случай-контроль». Фармакогенетика и геномика. 15 (8): 547–55. Дои:10.1097 / 01.fpc.0000170916.96650.70. PMID 16006998. S2CID 25879819.
- ^ Чжи X, Ян Б., Фан С, Ли И, Хэ М, Ван Д., Ван И, Вэй Дж, Чжэн Ц., Сунь Дж. (Декабрь 2016 г.). «Аддитивное взаимодействие полиморфизмов MTHFR C677T и MTRR A66G с избыточным весом / ожирением и риском диабета 2 типа». Международный журнал экологических исследований и общественного здравоохранения. 13 (12): 1243. Дои:10.3390 / ijerph13121243. ЧВК 5201384. PMID 27983710.
- ^ Мацуо К., Хамадзима Н., Хираи Т., Като Т., Иноуэ М., Такезаки Т., Тадзима К. (2002). «Полиморфизм гена A66G редуктазы метионинсинтазы связан с риском колоректального рака». Азиатско-Тихоокеанский журнал профилактики рака. 3 (4): 353–359. PMID 12716294.
- ^ Sharp L, Little J (март 2004 г.). "Полиморфизмы генов, участвующих в метаболизме фолиевой кислоты и колоректальной неоплазии: обзор HuGE". Американский журнал эпидемиологии. 159 (5): 423–43. Дои:10.1093 / aje / kwh066. PMID 14977639.
- ^ Веттергрен Й, Один Э, Карлссон Г, Густавссон Б (2010). «Полиморфизмы MTHFR, MTR и MTRR в отношении гиперметилирования p16INK4A в слизистой оболочке пациентов с колоректальным раком». Молекулярная медицина. 16 (9–10): 425–32. Дои:10.2119 / молмед.2009.00156. ЧВК 2935958. PMID 20549016.
- ^ Ле Маршан Л., Донлон Т., Ханкин Дж. Х., Колонель Л. Н., Вилкенс Л. Р., Сейфрид А. (2002). «Потребление витамина B, метаболические гены и риск колоректального рака (США)». Причины рака и борьба с ними. 13 (3): 239–48. Дои:10.1023 / А: 1015057614870. PMID 12020105. S2CID 6326507.
- ^ Джеммати Д., Онгаро А., Скаполи Г.Л., Делла Порта М., Тоньяццо С., Серино М.Л., Ди Бона Е., Родегьеро Ф., Гилли Дж., Ревербери Р., Карузо А., Паселло М., Пеллати А., Де Маттей М. (май 2004 г.). «Общие полиморфизмы генов в метаболическом пути фолиевой кислоты и метилирования и риск острого лимфобластного лейкоза и неходжкинской лимфомы у взрослых». Эпидемиология, биомаркеры и профилактика рака. 13 (5): 787–94. PMID 15159311.
- ^ Lin J, Spitz MR, Wang Y, Schabath MB, Gorlov IP, Hernandez LM, Pillow PC, Grossman HB, Wu X (сентябрь 2004 г.). «Полиморфизм генов метаболизма фолиевой кислоты и предрасположенность к раку мочевого пузыря: исследование случай-контроль». Канцерогенез. 25 (9): 1639–47. Дои:10.1093 / carcin / bgh175. PMID 15117811.
- ^ Скибола С.Ф., Форрест М.С., Коппеде Ф., Агана Л., Хаббард А., Смит М.Т., Браччи П.М., Холли Е.А. (октябрь 2004 г.). «Полиморфизмы и гаплотипы в генах, метаболизирующих фолат, и риск неходжкинской лимфомы». Кровь. 104 (7): 2155–62. Дои:10.1182 / кровь-2004-02-0557. PMID 15198953.
- ^ Стольценберг-Соломон Р.З., Цяо Ю.Л., Абнет С.К., Ратнасингхе Д.Л., Доуси С.М., Донг З.В., Тейлор П.Р., Марк С.Д. (ноябрь 2003 г.). «Риск рака кардии пищевода и желудка и полиморфизмы, связанные с фолиевой кислотой и витамином B (12), Линьсянь, Китай». Эпидемиология, биомаркеры и профилактика рака. 12 (11, Пт 1): 1222–6. PMID 14652285.
- ^ а б c Уоткинс Д., Розенблатт Д.С. (июнь 1988 г.). «Генетическая гетерогенность среди пациентов с дефицитом метилкобаламина. Определение двух групп комплементации, cblE и cblG». Журнал клинических исследований. 81 (6): 1690–4. Дои:10.1172 / JCI113507. ЧВК 442612. PMID 3384945.
- ^ а б c d е ж г час я Завадакова П., Фаулер Б., Земан Дж., Суормала Т., Приступилова К., Козич В., Завадьякова П. (октябрь 2002 г.). «CblE-тип гомоцистинурии из-за недостаточности метионинсинтазы редуктазы: клинические и молекулярные исследования и пренатальная диагностика в двух семьях». Журнал наследственных метаболических заболеваний. 25 (6): 461–76. Дои:10.1023 / А: 1021299117308. PMID 12555939. S2CID 9114486.
- ^ а б c d е ж г Ботто Н., Андреасси М.Г., Манфреди С., Мазетти С., Коччи Ф., Коломбо М.Г., Сторти С., Рицца А., Бьяджини А. (сентябрь 2003 г.). «Генетический полиморфизм метаболизма фолиевой кислоты и гомоцистеина как факторы риска повреждения ДНК». Европейский журнал генетики человека. 11 (9): 671–8. Дои:10.1038 / sj.ejhg.5201024. PMID 12939653.
- ^ а б Brown CA, McKinney KQ, Kaufman JS, Gravel RA, Rozen R (июнь 2000 г.). «Распространенный полиморфизм метионинсинтазы редуктазы увеличивает риск преждевременной болезни коронарных артерий». Журнал сердечно-сосудистых рисков. 7 (3): 197–200. Дои:10.1177/204748730000700306. PMID 11006889. S2CID 32898984.
- ^ Шоу Г.М., Лу В., Чжу Х., Ян В., Бриггс Ф. Б., Кармайкл С. Л., Барселлос Л. Ф., Ламмер Э. Дж., Финнелл Р. Х. (июнь 2009 г.). «118 SNP генов, связанных с фолиевой кислотой, и риски расщелины позвоночника и конотрункальных пороков сердца». BMC Medical Genetics. 10: 49. Дои:10.1186/1471-2350-10-49. ЧВК 2700092. PMID 19493349.
- ^ Balduino Victorino D, de Godoy MF, Goloni-Bertollo EM, Pavarino ÉC (2014). «Генетические полиморфизмы, участвующие в метаболизме фолиевой кислоты и материнском риске синдрома Дауна: метаанализ». Маркеры заболеваний. 2014: 1–12. Дои:10.1155/2014/517504. ЧВК 4269293. PMID 25544792.
- ^ Мутхусвами С., Агарвал С. (2016). «Верна ли связь полиморфизма гена MTHFR и синдрома Дауна с беременностью? Исследование индейского населения и метаанализ случай-контроль». Египетский журнал медицинской генетики человека. 17 (1): 87–97. Дои:10.1016 / j.ejmhg.2015.08.003. ISSN 1110-8630.
- ^ а б c О'Лири В. Б., Парл-Макдермотт А., Моллой А. М., Кирк П. Н., Джонсон З., Конли М., Скотт Дж. М., Миллс Дж. Л. (январь 2002 г.). «Полиморфизм MTRR и MTHFR: связь с синдромом Дауна?». Американский журнал медицинской генетики. 107 (2): 151–5. Дои:10.1002 / ajmg.10121. PMID 11807890.
- ^ а б Мартинес-Фриас М.Л., Перес Б., Десвиат Л.Р., Кастро М., Леал Ф., Родригес Л., Мансилла Е., Мартинес-Фернандес М.Л., Бермехо Е., Родригес-Пинилья Е., Прието Д., Угарте М. (май 2006 г.). «Материнские полиморфизмы 677C-T и 1298A-C генов MTHFR и 66A-G MTRR: есть ли какая-либо взаимосвязь между полиморфизмом пути фолиевой кислоты, уровнями материнского гомоцистеина и риском рождения ребенка с синдромом Дауна?». Американский журнал медицинской генетики. Часть А. 140 (9): 987–97. Дои:10.1002 / ajmg.a.31203. PMID 16575899. S2CID 44819166.
- ^ Боско П., Геант-Родригес Р.М., Анелло Дж., Бароне С., Намур Ф., Карачи Ф., Романо А., Романо С., Геант Дж. Л. (сентябрь 2003 г.). «Полиморфизм метионинсинтазы (MTR) 2756 (A -> G), двойная гетерозиготность метионинсинтазы 2756 AG / метионинсинтаза редуктазы (MTRR) 66 AG и повышенная гомоцистеинемия - три фактора риска для рождения ребенка с синдромом Дауна». Американский журнал медицинской генетики. Часть А. 121A (3): 219–24. Дои:10.1002 / ajmg.a.20234. PMID 12923861. S2CID 38425348.
- ^ Аль-Газали Л.И., Падманабхан Р., Мельник С., Йи П., Погрибный И.П., Погрибна М., Бакир М., Хамид З.А., Абдулраззак И., Даводу А., Джеймс С.Дж. (октябрь 2001 г.). «Аномальный метаболизм фолиевой кислоты и генетический полиморфизм пути фолиевой кислоты у ребенка с синдромом Дауна и дефектом нервной трубки». Американский журнал медицинской генетики. 103 (2): 128–32. Дои:10.1002 / ajmg.1509. PMID 11568918.
дальнейшее чтение
- Уилсон А., Платт Р., Ву К., Леклерк Д., Кристенсен Б., Ян Х., Гравел Р. А., Розен Р. (август 1999 г.). «Распространенный вариант редуктазы метионинсинтазы в сочетании с низким содержанием кобаламина (витамина B12) увеличивает риск расщелины позвоночника». Молекулярная генетика и метаболизм. 67 (4): 317–23. Дои:10.1006 / мг.1999.2879. PMID 10444342.
- Уилсон А., Леклерк Д., Розенблатт Д.С., Гравий Р.А. (октябрь 1999 г.). «Молекулярная основа дефицита метионинсинтазы редуктазы у пациентов, принадлежащих к группе нарушений комплементации cblE в метаболизме фолиевой кислоты / кобаламина». Молекулярная генетика человека. 8 (11): 2009–16. Дои:10.1093 / hmg / 8.11.2009. PMID 10484769.
- Джеймс С.Дж., Погрибна М., Погрибный И.П., Мельник С., Хайн Р.Дж., Гибсон Дж.Б., Йи П., Тафоя Д.Л., Свенсон Д.Х., Уилсон В.Л., Гейлор Д.В. (октябрь 1999 г.). «Аномальный метаболизм фолиевой кислоты и мутация в гене метилентетрагидрофолатредуктазы могут быть факторами риска развития синдрома Дауна у матери». Американский журнал клинического питания. 70 (4): 495–501. Дои:10.1093 / ajcn / 70.4.495. PMID 10500018.
- Leclerc D, Odièvre M, Wu Q, Wilson A, Huizenga JJ, Rozen R, Scherer SW, Gravel RA (ноябрь 1999 г.). «Молекулярное клонирование, экспрессия и физическое картирование гена редуктазы метионинсинтазы человека». Ген. 240 (1): 75–88. Дои:10.1016 / S0378-1119 (99) 00431-X. PMID 10564814.
- Дулин М.Т., Барбо С., Макдоннелл М., Хёсс К., Уайтхед А.С., Митчелл Л.Е. (ноябрь 2002 г.). «Генетические эффекты матери, оказываемые генами, участвующими в реметилировании гомоцистеина, влияют на риск расщелины позвоночника». Американский журнал генетики человека. 71 (5): 1222–6. Дои:10.1086/344209. ЧВК 385102. PMID 12375236.
- Олтяну Х., Мансон Т., Банерджи Р. (ноябрь 2002 г.). «Различия в эффективности восстановительной активации метионинсинтазы и экзогенных акцепторов электронов между общими полиморфными вариантами редуктазы метионинсинтазы человека». Биохимия. 41 (45): 13378–85. Дои:10.1021 / bi020536s. PMID 12416982.
- Завадакова П., Фаулер Б., Земан Дж., Суормала Т., Приступилова К., Козич В., Завадьякова П. (октябрь 2002 г.). «CblE-тип гомоцистинурии из-за недостаточности метионинсинтазы редуктазы: клинические и молекулярные исследования и пренатальная диагностика в двух семьях». Журнал наследственных метаболических заболеваний. 25 (6): 461–76. Дои:10.1023 / А: 1021299117308. PMID 12555939. S2CID 9114486.
- Петржик Дж. Дж., Бик-Мултановски М, Санак М, Твардовска М (2003). «Полиморфизмы генов 5,10-метилентетрагидрофолата и метионинсинтазы редуктазы как независимые факторы риска расщелины позвоночника». Журнал прикладной генетики. 44 (1): 111–3. PMID 12590188.
- Чжу Х., Плетеный Нью-Джерси, Шоу Г.М., Ламмер Э.Дж., Хендрикс К., Суарес Л., Кэнфилд М., Финнелл Р.Х. (март 2003 г.). «Полиморфизм фермента реметилирования гомоцистеина и повышенный риск дефектов нервной трубки». Молекулярная генетика и метаболизм. 78 (3): 216–21. Дои:10.1016 / S1096-7192 (03) 00008-8. PMID 12649067.
- Брилакис Е.С., Бергер ПБ, Баллман К.В., Розен Р. (июнь 2003 г.). «Полиморфизм метилентетрагидрофолатредуктазы (MTHFR) 677C> T и метионинсинтаза редуктазы (MTRR) 66A> G: связь с сывороточным гомоцистеином и ангиографической болезнью коронарной артерии в эпоху мучных продуктов, обогащенных фолиевой кислотой». Атеросклероз. 168 (2): 315–22. Дои:10.1016 / S0021-9150 (03) 00098-4. PMID 12801615.
- Sliwerska E, Szpecht-Potocka A (2003). «[Мутации генов MTHFR, MTR, MTRR как факторы высокого риска дефектов нервной трубки]». Medycyna Wieku Rozwojowego. 6 (4): 371–82. PMID 12810988.
- Бейер К., Лао Джи, Латорре П., Риуторт Н., Матуте Б., Фернандес-Фигерас М.Т., Мате Дж.Л., Ариса А. (июль 2003 г.). «Полиморфизм метионинсинтазы является фактором риска болезни Альцгеймера». NeuroReport. 14 (10): 1391–4. Дои:10.1097 / 01.wnr.0000073683.00308.0e. PMID 12876480. S2CID 33245738.
- Боско П., Геант-Родригес Р.М., Анелло Дж., Бароне С., Намур Ф., Карачи Ф., Романо А., Романо С., Геант Дж. Л. (сентябрь 2003 г.). «Полиморфизм метионинсинтазы (MTR) 2756 (A -> G), двойная гетерозиготность метионинсинтазы 2756 AG / метионинсинтаза редуктазы (MTRR) 66 AG и повышенная гомоцистеинемия - три фактора риска для рождения ребенка с синдромом Дауна». Американский журнал медицинской генетики. Часть А. 121A (3): 219–24. Дои:10.1002 / ajmg.a.20234. PMID 12923861. S2CID 38425348.
- Olteanu H, Wolthers KR, Munro AW, Scrutton NS, Banerjee R (февраль 2004 г.). «Кинетическая и термодинамическая характеристика общих полиморфных вариантов редуктазы метионинсинтазы человека». Биохимия. 43 (7): 1988–97. Дои:10.1021 / bi035910i. PMID 14967039.
- Джеммати Д., Онгаро А., Скаполи Г.Л., Делла Порта М., Тоньяццо С., Серино М.Л., Ди Бона Е., Родегьеро Ф., Гилли Дж., Ревербери Р., Карузо А., Паселло М., Пеллати А., Де Маттей М. (май 2004 г.). «Общие полиморфизмы генов в метаболическом пути фолиевой кислоты и метилирования и риск острого лимфобластного лейкоза и неходжкинской лимфомы у взрослых». Эпидемиология, биомаркеры и профилактика рака. 13 (5): 787–94. PMID 15159311.
- Леал Н.А., Олтяну Х., Банерджи Р., Бобик Т.А. (ноябрь 2004 г.). «Человеческий АТФ: аламин-аденозилтрансфераза Cob (I) и его взаимодействие с метионинсинтазоредуктазой». Журнал биологической химии. 279 (46): 47536–42. Дои:10.1074 / jbc.M405449200. PMID 15347655.
- Вон Дж. Д., Бейли Л. Б., Шелнутт К. П., Данвуди К. М., Маневал Д. Р., Дэвис С. Р., Куинливан Е. П., Грегори Дж. Ф., Териак Д. В., Кауэлл Г.П. (ноябрь 2004 г.). «Полиморфизм метионинсинтазы редуктазы 66A-> G связан с повышенной концентрацией гомоцистеина в плазме при сочетании с гомозиготным вариантом метилентетрагидрофолатредуктазы 677C-> T». Журнал питания. 134 (11): 2985–90. Дои:10.1093 / jn / 134.11.2985. PMID 15514263.







