Полиднавирус - Polydnavirus
| Полиднавирус | |
|---|---|
 | |
| Электронная микрофотография браковируса | |
| Классификация вирусов | |
| (без рейтинга): | Вирус |
| Область: | incertae sedis |
| Королевство: | incertae sedis |
| Тип: | incertae sedis |
| Учебный класс: | incertae sedis |
| Заказ: | incertae sedis |
| Семья: | Полиднавириды |
| Роды | |
А полиднавирус /пɒˈлɪdпəvаɪрəs/ (PDV) является членом семья Полиднавириды из насекомое вирусы. Сейчас 53 разновидность в этой семье, разделенной на 2 роды. Полиднавирусы образуют симбиотические отношения с паразитоид осы (ихновирусы (IV) встречаются в ихневмонидные осы виды и браковирусы (BV) в Браконидные осы ), но сами эти осы паразитируют на Чешуекрылые (мотыльки и бабочки).[1][2] Мало или нет гомология последовательностей существует между BV и IV, что позволяет предположить, что два рода эволюционировали независимо в течение долгого времени.
Таксономия
Группа: дцДНК
Заказ: не назначен
Семья: Полиднавириды[2]
- Apanteles crassicornis bracovirus
- Apanteles fumiferanae bracovirus
- Ascogaster argentifrons bracovirus
- Ascogaster quadridentata bracovirus
- Cardiochiles nigriceps bracovirus
- Chelonus altitudinis bracovirus
- Chelonus blackburni bracovirus
- Chelonus inanitus bracovirus
- Chelonus insularis bracovirus
- Chelonus nr. curvimaculatus bracovirus
- Chelonus texanus bracovirus
- Cotesia congregata bracovirus
- Cotesia flavipes bracovirus
- Cotesia glomerata bracovirus
- Cotesia hyphantriae bracovirus
- Cotesia kariyai bracovirus
- Cotesia marginiventris bracovirus
- Cotesia melanoscela bracovirus
- Cotesia rubecula bracovirus
- Cotesia schaeferi bracovirus
- Diolcogaster facetosa bracovirus
- Glyptapanteles flavicoxis bracovirus
- Glyptapanteles indiensis bracovirus
- Glyptapanteles liparidis bracovirus
- Hypomicrogaster canadensis bracovirus
- Hypomicrogaster ectdytolophae bracovirus
- Микроплит croceipes bracovirus
- Микроплит, разрушающий браковирус
- Phanerotoma flavitestacea bracovirus
- Pholetesor ornigis bracovirus
- Protapanteles paleacritae bracovirus
- Tranosema rostrale bracovirus
- Campoletis aprilis ichnovirus
- Campoletis flavicincta ichnovirus
- Campoletis sonorensis ichnovirus
- Casinaria arjuna ichnovirus
- Casinaria forcipata ichnovirus
- Casinaria infesta ichnovirus
- Diadegma acronyctae ichnovirus
- Ichnovirus диадегмы прерывистой
- Diadegma terebrans ichnovirus
- Enytus montanus ichnovirus
- Eriborus terebrans ichnovirus
- Glypta fumiferanae ichnovirus
- Hyposoter annulipes ichnovirus
- Hyposoter exiguae ichnovirus
- Hyposoter fugitivus ichnovirus
- Hyposoter lymantriae ichnovirus
- Hyposoter pilosulus ichnovirus
- Hyposoter rivalis ichnovirus
- Благодетель олезикампа ихновирус
- Olesicampe geniculatae ichnovirus
- Synetaeris tenuifemur ichnovirus
Структура
Вирусы Polydnaviridae: окутанный, с вытянутый эллипсоид и цилиндрические геометрии. Геномы круглые и сегментированные, состоят из множества сегментов двухцепочечных, сверхспиральная ДНК упакован в капсид белки. Их длина составляет около 2,0–31 КБ.[1]
| Род | Структура | Симметрия | Капсид | Геномное расположение | Геномная сегментация |
|---|---|---|---|---|---|
| Ихновирус | Вытянутый эллипсоид | Окутанный | Круговой | Сегментированный | |
| Браковирус | Вытянутый эллипсоид | Окутанный | Круговой | Сегментированный |
Жизненный цикл
Репликация вируса является ядерной. ДНК-шаблон транскрипция это метод транскрипции. Вирус покидает клетку-хозяина путем экспорта ядерных пор.
Осы-паразитоиды служат хозяевами вируса, а чешуекрылые - хозяевами этих ос. Самка осы вводит хозяину одно или несколько яиц вместе с некоторым количеством вируса. Вирус и оса находятся в мутуалистический симбиотический Взаимосвязь: экспрессия вирусных генов не позволяет иммунной системе осы убить инъецированное яйцо осы и вызывает другие физиологические изменения, которые в конечном итоге приводят к смерти паразитированного хозяина. Маршруты передачи - родительские.[1]
| Род | Детали хоста | Тканевый тропизм | Детали входа | Детали выпуска | Сайт репликации | Сайт сборки | Передача инфекции |
|---|---|---|---|---|---|---|---|
| Ихновирус | Осы-паразитоиды (Ichneumonidae) | Гемоциты; толстые тела | Неизвестный | Лизис; подающий надежды | Ядро | Ядро | Неизвестный |
| Браковирус | Осы-паразитоиды (Braconidae) | Гемоциты; толстые тела | Неизвестный | Лизис; подающий надежды | Ядро | Ядро | Неизвестный |
Биология
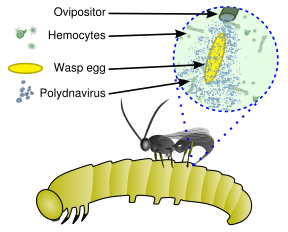
Эти вирусы являются частью уникальной биологической системы, состоящей из эндопаразитарной осы (паразитоид ), хост (обычно чешуекрылые ) личинка и вирус. Полный геном вируса эндогенный, рассредоточенные по геному осы. Вирус реплицируется только в определенной части яичника, называемой чашечкой, куколки и взрослой самки ос. Вирус вводится вместе с яйцом осы в полость тела гусеницы чешуекрылых-хозяев и заражает клетки гусеницы. Инфекция не приводит к репликации новых вирусов, а поражает гусеницу. иммунная система, поскольку вирион несет гены вирулентности вместо генов репликации вируса.[3] Их можно считать разновидностью вирусные векторы.[4]
Без вирусной инфекции, фагоцитарный гемоциты (клетки крови) инкапсулируют и убивают яйцо и личинки осы, но подавление иммунитета, вызванное вирусом, позволяет выжить яйцу и личинкам осы, что приводит к вылуплению и полному развитию неполовозрелой осы в гусенице. Кроме того, гены, экспрессируемые полиднавирусом в паразитированном хозяине, изменяют его развитие и метаболизм, что способствует росту и выживанию личинок паразитоидов. Таким образом, у вируса и осы есть симбиотический (мутуалистический ) отношение.[5][6]
Подсемейства ос, несущие PDV
Характеристики
Оба рода PDV имеют определенные характеристики:
- вирусные частицы каждого содержат несколько сегментов дцДНК (двухцепочечной, или «нормальной» ДНК, в отличие от одноцепочечной ДНК или РНК с положительным или отрицательным смыслом, как обнаружено в некоторых других вирусах), причем каждый сегмент содержит только часть полный геном (как хромосомы у эукариотических организмов)
- геном вируса обладает эукариотическими характеристиками, такими как наличие интронов и низкая плотность кодирования
- геном каждого вируса интегрирован в геном осы-хозяина
- геном организован в несколько семейств генов, состоящих из нескольких членов (которые различаются у браковирусов и ихновирусов)
- вирусные частицы реплицируются (продуцируются) только в определенных типах клеток репродуктивных органов самок осы
Однако морфология этих двух родов различна при наблюдении с помощью электронной микроскопии. Ихновирусы обычно имеют яйцевидную (яйцевидную) форму, тогда как браковирусы представляют собой короткие палочки. Вирионы браковирусов высвобождаются путем лизиса клеток; вирионы ихновирусов высвобождаются почкованием.
Эволюция
Нуклеиновая кислота анализ предполагает очень долгую ассоциацию вирусов с осами (более 70 миллионов лет).
Было выдвинуто два предложения о том, как развивалась ассоциация оса / вирус. Первый предполагает, что вирус произошел от генов ос. Многие паразитоиды, не использующие PDV, вводят белки, которые обеспечивают многие из тех же функций, то есть подавление иммунного ответа на яйцо паразита. В этой модели бракониды и ихневмонидные осы упаковали гены для этих функций в вирусы, по существу создавая систему переноса генов, которая приводит к тому, что гусеница производит факторы иммуноподавления. В этом сценарии структурные белки (капсиды) PDV, вероятно, были «заимствованы» у существующих вирусов.[8]
Альтернативное предложение предполагает, что у предков осы возникла полезная ассоциация с существующим вирусом, что в конечном итоге привело к интеграции вируса в геном осы. После интеграции гены, ответственные за репликацию вируса, и капсиды (в конечном итоге) больше не включались в геном PDV. Эта гипотеза подтверждается отчетливыми морфологическими различиями между IV и BV, предполагающими наличие разных предковых вирусов для двух родов. BV, вероятно, произошла от нудивирус ~100 миллион лет назад.[9] IV имеет менее ясное происхождение; хотя в более ранних отчетах обнаружен белок p44 / p53 со структурным сходством с асковирус, связь не была подтверждена в более поздних исследованиях.[10] В любом случае оба рода образовались в результате единого интеграционного события в соответствующих линиях осин.[3]
Две группы вирусов в семействе на самом деле филогенетически не связаны, что позволяет предположить, что этот таксон может нуждаться в пересмотре.[11]
Влияние на иммунитет хозяина
У хозяина могут запускаться несколько механизмов иммунной системы насекомых, когда оса откладывает яйца и когда развивается паразитическая оса. Когда большое тело (яйцо осы или маленькая частица, используемая в экспериментах) вводится в тело насекомого, классической иммунной реакцией является инкапсуляция гематоцитами. Инкапсулированное тело также можно меланизировать, чтобы задушить его, благодаря другому типу гемоцитов, который использует фенолоксидаза путь производства меланина. Маленькие частицы могут быть фагоцитированы, а клетки макрофагов могут затем меланизироваться в узелок. Наконец, насекомые также могут реагировать производством противовирусных пептидов.[12]
ПолиДНКвирус защищает личинок перепончатокрылых от иммунной системы хозяина, действуя на разных уровнях.
- Сначала они могут вывести из строя или уничтожить гематоциты. ПолиДНКвирус, связанный с Cotesia rubecula, кодируют белок CrV1, который денатурирует актиновые филаменты в гематоцитах, поэтому эти клетки становятся менее способными двигаться и прикрепляться к личинкам.[12] Снос микроплита Браковирус (MdBV) вызывает апоптоз гематоцитов благодаря своему гену PTP-H2.[12] Он также снижает адгезионную способность гематоцитов благодаря своему гену Glc1.8. Ген также подавляет фагоцитоз.[13]
- PolyDNAvirus также может действовать на меланизацию, MdBV препятствует выработке фенолоксидаза.[14]
- Наконец, полиДНК-вирус также может продуцировать вирусные анкирины, которые препятствуют производству противовирусных пептидов.[15] В некоторых ихновирусах ванкирин также может предотвращать апоптоз, крайнюю реакцию клетки на блокирование распространения вируса.[16][17]
- Ихновирусы производят некоторые белки, называемые виннексинами, которые признаны гомологичными иннексинам насекомых. Они отвечают за кодирование структурных единиц щелевых соединений. Эти белки могут изменять межклеточную коммуникацию, что может объяснить нарушение инкапсуляция процесс.[18]
Вирусоподобные частицы
Еще одна стратегия, используемая паразитоидами Перепончатокрылые чтобы защитить свое потомство - это производство вирусоподобные частицы. По структуре VLP похожи на вирусы, но не содержат нуклеиновых кислот. Например, Venturia canescens (Ichneumonidea ) и Лептопилина sp. (Figitidaea ) производят VLP.
VLP можно сравнить с полиДНК-вирусом, потому что они секретируются одинаково, и оба они действуют, чтобы защитить личинок от иммунной системы хозяина. V. canescens-VLP (VcVLP1, VcVLP2, VcNEP ...) продуцируются в клетках чашечки, прежде чем они попадут в яйцеводы. Работы 2006 года не обнаружили их связи с какими-либо вирусами и предполагали клеточное происхождение.[8] Более недавнее сравнение связывает их с сильно перетасованными домашними Нудивирус последовательности.[19]
VLP защищают личинок перепончатокрылых локально, тогда как полиДНК-вирус может иметь более глобальный эффект. VLP позволяют личинкам избегать иммунной системы: личинка не распознается хозяином как вредная, или иммунные клетки не могут взаимодействовать с ней благодаря VLP.[8] V. canescens используйте их вместо полиднавирусов, потому что ихновирус деактивирован.[19]
Оса Лептопилина гетеротома секретируют VLP, которые способны проникать в ламеллоциты благодаря специфическим рецепторам, а затем изменяют их форму и свойства поверхности, поэтому они становятся неэффективными, а личинки защищены от инкапсуляции.[20] В Лептопилина VLP или внеклеточные везикулы смешанной стратегии (MSEV) содержат некоторые системы секреции. Их эволюционная картина менее ясна,[21] но недавно зарегистрированный вирус, L. boulardi Нитчатый вирус (LbFV), похоже, имеет сходство.[22]
Микро-РНК
МикроРНК - это небольшие фрагменты РНК, продуцируемые в клетках-хозяевах благодаря специфическому ферментативному механизму. Они способствуют разрушению вирусной РНК. МикроРНК прикрепляются к вирусной РНК, потому что они комплементарны. Затем комплекс распознается ферментом, который его разрушает. Это явление известно как PTGS (посттранскрипционное молчание генов).[23]
Интересно рассмотреть феномен микроРНК в контексте полиДНК-вируса. Можно сформулировать множество гипотез:
- Braconidae несут нудивирус -связанные гены в их геноме,[24] поэтому они могут быть способны продуцировать микроРНК против нудивируса как врожденный иммунитет.
- Возможно, осы используют микроРНК для контроля вирусных генов, которые они несут.
- ПолиДНКвирус также может использовать PTGS для вмешательства в экспрессию генов хозяина.
- PTGS также используется для развития организмов, используя те же ферменты, что и подавление антивирусных генов, поэтому мы можем представить, что если хозяин использует PTGS против полиДНК-вируса, возможно, это также влияет на его развитие.
Смотрите также
Рекомендации
- ^ а б c «Вирусная зона». ExPASy. Получено 15 июн 2015.
- ^ а б ICTV. «Таксономия вирусов: выпуск 2014 г.». Получено 15 июн 2015.
- ^ а б Strand, MR; Берк, Г.Р. (май 2015 г.). «Полиднавирусы: от открытия к текущим открытиям». Вирусология. 479-480: 393–402. Дои:10.1016 / j.virol.2015.01.018. ЧВК 4424053. PMID 25670535.
- ^ а б Burke, Gaelen R .; Стрэнд, Майкл Р. (31 января 2012 г.). «Полиднавирусы паразитических ос: одомашнивание вирусов в качестве переносчиков генов». Насекомые. 3 (1): 91–119. Дои:10.3390 / насекомые3010091. ЧВК 4553618. PMID 26467950.
- ^ Уэбб, Б.А. (1998). Биология полиднавирусов, структура генома и эволюция. В Miller, L.K., Ball, L.A., Eds. Вирусы насекомых. Издательская корпорация «Пленум». С. 105–139.
- ^ Русинк, М. Дж. (2011). «Изменения в динамике популяций мутуалистических и патогенных вирусов». Вирусы. 3 (1): 12–19. Дои:10.3390 / v3010012. ЧВК 3187592. PMID 21994724.
- ^ Мерфи, Николас; Бэнкс, Джонатан К .; Уитфилд, Джеймс Б.; Остин, Эндрю Д. (1 апреля 2008 г.). «Филогения паразитарных подсемейств микрогастроидов (Hymenoptera: Braconidae), основанная на данных о последовательностях семи генов, с улучшенной временной оценкой происхождения линии». Молекулярная филогенетика и эволюция. 47 (1): 378–395. Дои:10.1016 / j.ympev.2008.01.022. PMID 18325792.
- ^ а б c Аннетт Рейнеке; Сасан Асгари и Отто Шмидт (2006). «Эволюционное происхождение вирусоподобных частиц Venturia canescens». Архивы биохимии и физиологии насекомых. 61 (3): 123–133. Дои:10.1002 / arch.20113. PMID 16482583.
- ^ Эрниу Э.А., Хуге Э., Тезе Дж., Безье А., Перике Дж., Дрезен Дж. М. (2013). «Когда паразитические осы захватили вирусы: геномная и функциональная эволюция полиднавирусов». Philos Trans R Soc Lond B Biol Sci. 368 (1626): 20130051. Дои:10.1098 / rstb.2013.0051. ЧВК 3758193. PMID 23938758.
- ^ Волков, АН; Жуан, V; Урбах, S; Samain, S; Бергойн, М; Винкер, П; Demettre, E; Cousserans, F; Провост, Б; Кулибали, Франция; Legeai, F; Béliveau, C; Cusson, M; Гяпай, Г; Дрезен, Дж. М. (27 мая 2010 г.). «Анализ структурных компонентов вириона выявляет остатки генома предкового ихновируса». Патогены PLOS. 6 (5): e1000923. Дои:10.1371 / journal.ppat.1000923. ЧВК 2877734. PMID 20523890.
- ^ Дюпюи C, Huguet E, Drezen JM (2006). «Разворачивая историю эволюции полиднавирусов». Вирус Res. 117 (1): 81–89. Дои:10.1016 / j.virusres.2006.01.001. PMID 16460826.
- ^ а б c JM. Дрезен; С. Савари; М. Пуарье; Ж. Перике (1999). «Полиднавирусы, вирусные образования, одомашненные паразитоидными осами». Вирусология. 3 (1): 11–21.
- ^ Маркус Бек и Майкл Р. Стрэнд (февраль 2005 г.). «Glc1.8 из микроплита, разрушающего браковирус, вызывает потерю адгезии и фагоцитоз в клетках High Five и S2 насекомых». Журнал вирусологии. 79 (3): 1861–1870. Дои:10.1128 / jvi.79.3.1861-1870.2005. ЧВК 544146. PMID 15650210.
- ^ Лу Чжицян; Бек Маркус Х .; Strand Michael R (июль 2010 г.). «Вирусный белок Egf1.0 представляет собой ингибитор двойной активности протеиназ 1 и 3, активирующих пропенолоксидазу, из Manduca sexta». Биохимия и молекулярная биология насекомых. 40 (7).
- ^ Пэ Сону; Ким Ёнгюн (1 сентября 2009 г.). «Гены IkB, кодируемые в Cotesia plutellae bracovirus, подавляют противовирусный ответ и повышают патогенность бакуловируса в отношении моли, Plutella xylostella». Журнал патологии беспозвоночных. 102 (1): 79–87. Дои:10.1016 / j.jip.2009.06.007. ISSN 0022-2011. PMID 19559708.
- ^ Фатх-Гудин А .; Kroemer J. A .; Уэбб Б. А. (август 2009 г.). «Белок ванкирина ichnovirus Campoletis sonorensis P-vank-1 ингибирует апоптоз в клетках Sf9 насекомых». Молекулярная биология насекомых. 18 (4): 497–506. Дои:10.1111 / j.1365-2583.2009.00892.x. PMID 19453763.
- ^ Clavijo G, Dorémus T., Ravallec M, Mannucci MA, Jouan V, Volkoff AN, Darboux I (2011). «Мультигенные семейства ихновирусов: исследование тканевой специфичности и специфичности хозяина посредством анализа экспрессии ванкиринов из Дидиматор гипозотера Ихновирус ». PLOS ONE. 6 (11): e27522. Bibcode:2011PLoSO ... 627522C. Дои:10.1371 / journal.pone.0027522. ЧВК 3210807. PMID 22087334.
- ^ Марциано Н.К .; Hasegawa D.K .; Фелан П .; Тернбулл М.В. (октябрь 2011 г.). «Функциональные взаимодействия между полиднавирусом и клеточными иннексинами-хозяевами». Журнал вирусологии. 85 (19): 10222–9. Дои:10.1128 / jvi.00691-11. ЧВК 3196458. PMID 21813607.
- ^ а б Леобольд, Матье; Безье, Энни; Пишон, Аполлина; Эрниу, Элизабет А; Волкова, Энн-Натали; Дрезен, Жан-Мишель; Абергель, Шанталь (июль 2018 г.). «Одомашнивание большого ДНК-вируса осой Venturia canescens предполагает целенаправленное сокращение генома посредством псевдогенизации». Геномная биология и эволюция. 10 (7): 1745–1764. Дои:10.1093 / gbe / evy127. ЧВК 6054256. PMID 29931159.
- ^ Р. М. Ризки и Т. М. Ризки (ноябрь 1990 г.). «Паразитоидные вирусоподобные частицы разрушают клеточный иммунитет дрозофилы». Труды Национальной академии наук Соединенных Штатов Америки. 87 (21): 8388–8392. Bibcode:1990PNAS ... 87.8388R. Дои:10.1073 / pnas.87.21.8388. ЧВК 54961. PMID 2122461.
- ^ Хевнер, Мэн; Ramroop, Дж; Gueguen, G; Рамраттан, G; Dolios, G; Скарпати, М; Kwiat, J; Бхаттачарья, S; Wang, R; Сингх, S; Говинд, С (25 сентября 2017 г.). «Новые органеллы с элементами бактериальной и эукариотической систем секреции, превращающие паразитов дрозофил в оружие». Текущая биология. 27 (18): 2869–2877.e6. Дои:10.1016 / j.cub.2017.08.019. ЧВК 5659752. PMID 28889977.
- ^ Джованни, Д. Ди; Lepetit, D .; Boulesteix, M .; Couté, Y .; Ravallec, M .; Варальди, Дж. (6 июня 2019 г.). «Вирус, манипулирующий поведением, родственник как источник адаптивных генов для паразитоидных ос». bioRxiv 10.1101/342758.
- ^ Ли, Х.В. И Дин, С. (2005). «Антивирусное подавление у животных». FEBS Lett. 579 (26): 5965–5973. Дои:10.1016 / j.febslet.2005.08.034. ЧВК 1350842. PMID 16154568.
- ^ Bézier A, Annaheim M, Herbinière J, Wetterwald C, Gyapay G, Bernard-Samain S, Wincker P, Roditi I, Heller M, Belghazi M, Pfister-Wilhem R, Periquet G, Dupuy C, Huguet E, Volkoff AN, Lanzrein Б. Дрезен Дж. М. (13 февраля 2009 г.). «Полиднавирусы браконидных ос происходят от наследственного нудивируса». Наука. 13. 323 (5916): 926–30. Bibcode:2009Sci ... 323..926B. Дои:10.1126 / science.1166788. PMID 19213916.
- Управление ICTVdB (2006 г.). 00.055. Polydnaviridae. В: ICTVdB - Универсальная база данных вирусов, версия 4. Бюхен-Осмонд, К. (Эд), Колумбийский университет, Нью-Йорк, США.
- Флеминг, Ж.-А. Г. В. и Саммерс, М. Д. (1991). «ДНК полиднавируса интегрирована в ДНК его паразитоидного хозяина осы». Труды Национальной академии наук. 88 (21): 9770–9774. Bibcode:1991PNAS ... 88.9770F. Дои:10.1073 / пнас.88.21.9770. ЧВК 52802. PMID 1946402.
- Уитфилд, Дж. Б. (2002). «Оценка возраста симбиоза полиднавирус-браконидная оса». Труды Национальной академии наук. 99 (11): 7508–7513. Bibcode:2002PNAS ... 99,7508 Вт. Дои:10.1073 / pnas.112067199. ЧВК 124262. PMID 12032313.
- Espagne, E .; и другие. (2004). «Последовательность генома полиднавируса: взгляд на эволюцию симбиотического вируса». Наука. 306 (5694): 286–289. Bibcode:2004Наука ... 306..286E. Дои:10.1126 / science.1103066. PMID 15472078.
- Webb, B.A .; и другие. (2006). «Геномы полиднавирусов отражают их двойную роль как мутуалистов и патогенов». Вирусология. 347 (1): 160–174. Дои:10.1016 / j.virol.2005.11.010. PMID 16380146.
- Бернар-Самайн, С., Винкер, П., Иродити, И., Хеллер, М., Белгхази, М., Пфистер-Вильхем, Р., Перике, Г., Дюпюи, К., Юге, Э., Волков , А.Н., Ланцрейн, Б., Дрезен, Дж. М., Полиднавирусы браконидных ос
внешняя ссылка
- http://research.biology.arizona.edu/mosquito/willott/507/polydnaviruses.html
- ДНК полиднавируса интегрирована в ДНК его паразитоидного хозяина осы - статья из Труды Национальной академии наук.
- Абстрактный статьи PNAS.
- Последовательность генома полиднавируса: взгляд на эволюцию симбиотического вируса статья из журнала Science.
- Viralzone: Polydnaviridae
- ICTV
