Пиридоксин 5'-фосфатоксидаза - Pyridoxine 5′-phosphate oxidase
| Пиридоксаль 5'-фосфатсинтаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| Идентификаторы | |||||||||
| Номер ЕС | 1.4.3.5 | ||||||||
| Количество CAS | 9029-21-4 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | AmiGO / QuickGO | ||||||||
| |||||||||
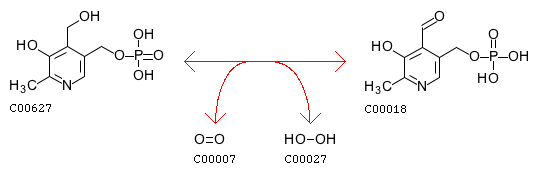
Пиридоксин 5'-фосфатоксидаза является фермент который катализирует несколько реакций в витамин B6 путь метаболизма. Пиридоксин-5'-фосфатоксидаза катализирует конечный ограничивающий шаг в витамине B6 метаболизм, биосинтез пиридоксаль-5'-фосфата, биологически активной формы витамина B6 который действует как важный кофактор.[1] Пиридоксин-5'-фосфатоксидаза относится к классу ферментов оксидазы, или более конкретно, оксидоредуктазы. Эти ферменты катализируют одновременную окислительно-восстановительную реакцию. Ферменты субстрата оксидазы гидроксилируются одним атомом кислорода молекулярного кислорода.[2]Одновременно другой атом кислорода восстанавливается до воды. Несмотря на то, что молекулярный кислород является акцептором электронов в реакциях этих ферментов, они уникальны, потому что кислород не появляется в окисленном продукте.
Структура
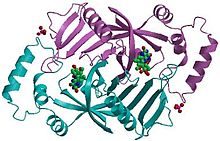
Пиридоксин 5'-фосфатоксидаза представляет собой гомодимер или молекула, состоящая из двух идентичных полипептидных субъединиц. Предполагается, что два мономера удерживаются вместе за счет дисульфидные связи. Между двумя мономерами также существуют солевые мостиковые взаимодействия. Каждая субъединица прочно связывает одну молекулу пиридоксаль-5'-фосфата на каждой субъединице. И то и другое альфа-спирали и бета-листы присутствуют в белковом мотиве, который лучше всего можно описать как структуру с расщепленными стволами. Эта структура частично связана с дисульфидными связями, присутствующими во вторичной структуре белка этого фермента. Множественный тиол группы (–SH) указывают на наличие дисульфидных связей в структуре молекулы. Этот фермент требует наличия кофактора FMN (флавинмононуклеотид ).[3]Кофакторы - это ионы или коферменты, необходимые для активности фермента. FMN расположен в глубокой щели (образованной двумя полипептидными субъединицами) и удерживается на месте обширными взаимодействиями водородных связей с белком. В этом конкретном случае FMN помогает ферменту связывать субстраты. В отсутствие пиридоксаль-5'-фосфата (PLP) активный сайт фермента находится в «открытой» конформации. Как только субстрат связывается и превращается в PLP, активный центр фермента находится в частично «закрытой» конформации. Определенные аминокислотные остатки могут образовывать водородные связи с PLP, образуя, таким образом, крышку, которая физически покрывает активный сайт, что приводит к «закрытой» конформации.[4]
Путь
Пиридоксин-5'-фосфатоксидаза - это фермент, катализирующий стадию B6 путь метаболизма. Витамин B6, который также известен как пиридоксин, является важным питательным веществом для человеческого организма, поскольку он отвечает за большее количество функций организма, чем любой другой витамин. Витамин B6 является коферментом метаболизма углеводов, жиров и белков. Это означает, что ферменты, которые расщепляют эти объекты для использования в организме, не могут функционировать, если витамин B6 присутствует, чтобы вызвать конформационное изменение фермента, таким образом активируя его. Витамин B6 также играет роль в синтезе гормоны, красные кровяные клетки, нейротрансмиттеры и ферменты. Человек с дефицитом витамина B6 может страдать бессонницей, а также поражаться центральной нервной системой.[1]
Реакции
Пиридоксин-5'-фосфатоксидаза катализирует несколько реакций; два наиболее важных дезаминирование пиридоксамин-5'-фосфата и дезаминирование пиридоксин-5-фосфата, оба из которых являются ключевыми промежуточными продуктами в метаболизме B6.[5] Число ЕС пиридоксин-5'-фосфатоксидазы составляет 1.4.3.5.[3]
- пиридоксин фосфат + O2 ⇌ H2О2 + пиридоксальфосфат
Пиридоксин-5'-фосфатоксидаза также играет роль в метаболизме азота, превращая амины к альдегиды и NH3 по реакции:
- амин + H2О + О2 ⇌ альдегид + NH3 + H2О2
Кинетика
У человека фермент пиридоксин-5'-фосфатоксидаза проявляет низкую каталитическую активность. константа скорости 0,2 с−1, с низким Kм значения как для пиридоксин-5'-фосфата, так и для пиридоксамин-5'-фосфата. Фермент также имеет низкую скорость оборота, что означает, что он относительно медленно превращает субстрат в продукт. Пиридоксаль-5'-фосфат - эффективный ингибитор продукта. Поскольку пиридоксаль-5'-фосфат, активная форма витамин B6, является продуктом метаболического пути, если он существует в избытке, то путь не обязательно должен продолжаться для продолжения производства продукта. Однако, если он существует в низких концентрациях, то это сигнал для пути к большему синтезу. Это пример подавление обратной связи.[6]
Пиридоксин-5'-фосфатоксидаза у разных организмов
Пиридоксин-5'-фосфатоксидаза в течение долгого времени была высоко консервативной, поскольку есть много общего между ферментом, обнаруженным у человека, и кишечная палочка. Хотя сохраняется только 39% аминокислотной последовательности из Кишечная палочка версии фермента к версии человека, последовательности для сайта связывания FMN и активных сайтов субстрата являются одними из очень высококонсервативных частей. Одно из ключевых отличий состоит в том, что пиридоксин-5'-фосфатоксидаза человека имеет более высокую специфичность к пиридоксамин-5'-фосфатному субстрату, тогда как пиридоксин-5'-фосфатоксидаза в Кишечная палочка имеет более высокую специфичность пиридоксаль-5'-фосфатного субстрата.[6]
использованная литература
- ^ а б "Витамин B6". Получено 2007-06-03.
- ^ Нельсон Д.Л., Кокс М.М. (2005). Принципы биохимии Ленингера, четвертое издание. Нью-Йорк: В. Х. Фриман и компания. ISBN 0-7167-4339-6.
- ^ а б Онлайн-менделевское наследование в человеке (OMIM): Пиридоксамин-5-прайм-фосфатоксидаза; ПНПО - 603287
- ^ PDB: 1jnw; ди Сальво М.Л., Ко Т.П., Мусаев Ф.Н., Рабони С., Ширх В., Сафо М.К. (январь 2002 г.). «Структура активного центра и стереоспецифичность пиридоксин-5'-фосфатоксидазы Escherichia coli». Журнал молекулярной биологии. 315 (3): 385–97. Дои:10.1006 / jmbi.2001.5254. PMID 11786019.
- ^ «Метаболизм витамина В6». Справочный путь. KEGG: Киотская энциклопедия генов и геномов.
- ^ а б Мусаев Ф.Н., Ди Сальво М.Л., Ко Т.П., Ширч В., Сафо М.К. (июль 2003 г.). «Структура и свойства рекомбинантной пиридоксин-5'-фосфатоксидазы человека». Белковая наука. 12 (7): 1455–63. Дои:10.1110 / пс 0356203. ЧВК 2323923. PMID 12824491.
внешние ссылки
 СМИ, связанные с Пиридоксин 5'-фосфатоксидаза в Wikimedia Commons
СМИ, связанные с Пиридоксин 5'-фосфатоксидаза в Wikimedia Commons