Радиорезистентность - Radioresistance
эта статья нужны дополнительные цитаты для проверка. (Май 2017 г.) (Узнайте, как и когда удалить этот шаблон сообщения) |
Радиорезистентность уровень ионизирующее излучение это организмы способны выдержать.
Организмы, устойчивые к ионизирующему излучению (IRRO), были определены как организмы, для которых доза острого ионизирующего излучения (IR), необходимая для достижения 90% снижения (D10), превышает 1000 серых (Гр) [1]
Радиорезистентность у многих организмов на удивление высока, в отличие от ранее существовавших взглядов. Например, изучение окружающей среды, животных и растений вокруг Чернобыльская катастрофа области выявила неожиданное выживание многих видов, несмотря на высокий уровень радиации. А Бразильский учиться на холме в состоянии Минас-Жерайс который имеет высокие уровни естественной радиации от урановых месторождений, также показал много радиорезистентных насекомые, черви и растения.[2][3] Определенный экстремофилы, например, бактерии Дейнококк радиодуранс и тихоходки, выдерживает большие дозы ионизирующее излучение порядка 5000 Гр.[4][5][6]
Индуцированная радиорезистентность
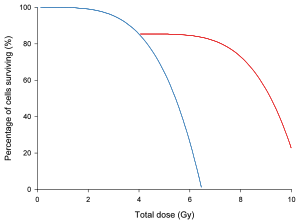
На графике слева кривая доза / выживаемость для гипотетический группа ячеек нарисована с и без времени отдыха для восстановления ячеек. За исключением времени восстановления в середине облучения, клетки обрабатывались бы идентично.
Радиорезистентность может быть вызвана воздействием малых доз ионизирующего излучения. Несколько исследований подтвердили этот эффект в дрожжи, бактерии, простейшие, водоросли, растения, насекомые, а также в in vitro млекопитающее и человеческие клетки и в животные модели. Могут быть задействованы несколько механизмов радиозащиты клетки, например, изменение уровней некоторых цитоплазматический и ядерный белки и увеличился экспрессия гена, Ремонт ДНК и другие процессы. Также биофизические модели представили общие основы этого явления.[7]
Было обнаружено, что многие организмы обладают механизмом самовосстановления, который в некоторых случаях может быть активирован под воздействием радиации. Ниже описаны два примера этого процесса самовосстановления у людей.
Деваир Алвес Феррейра получил большую дозу (7,0 Гр ) в течение Гоянская авария, и выжил, а его жена, получившая дозу 5,7 Гр, умерла. Наиболее вероятное объяснение[нужна цитата ] состоит в том, что его доза была разделена на множество меньших доз, которые поглощались в течение длительного периода времени, пока его жена оставалась в доме больше и подвергалась непрерывному облучению без перерыва, что давало механизмам самовосстановления в ее теле меньше времени для восстановления некоторых из ущерб, нанесенный радиацией. Это привело к ее смерти. В конце концов, он тоже умер в 1994 году. Точно так же некоторые из людей, которые работали в подвале разрушенного здания. Чернобыль накопили дозы в 10 Гр, эти рабочие получали эти дозы небольшими фракциями, чтобы избежать острых эффектов.
Это было найдено в радиационная биология эксперименты, согласно которым при облучении группы клеток по мере увеличения дозы количество выживших клеток уменьшается. Также было обнаружено, что если популяции клеток дать дозу перед тем, как ее отложить (без облучения) на некоторое время перед повторным облучением, то радиация имеет меньшую способность вызывать смерть клетки. Человеческое тело содержит множество видов клетки и человека можно убить из-за потери одной ткани в жизненно важном органе[нужна цитата ]. Для многих краткосрочных радиационных смертей (от 3 до 30 дней) потеря клеток, образующих клетки крови (Костный мозг ) и клетки пищеварительной системы (стенка кишечник ) вызывают смерть.
Наследование радиорезистентности
Существуют убедительные доказательства того, что радиорезистентность может быть генетически детерминирована и унаследована, по крайней мере, у некоторых организмов. Генрих Нётель, генетик из Freie Universität Berlin провели наиболее обширное исследование радиорезистентности мутации используя общие плодовая муха, Drosophila melanogaster, в серии из 14 публикаций.
Эволюция радиорезистентности
С точки зрения истории эволюции и причинно-следственной связи, радиорезистентность не представляется адаптивной чертой, потому что не существует документально подтвержденного естественного давления отбора, которое могло бы придать приспособленность способности организмов выдерживать дозы ионизирующего излучения в диапазоне нескольких наблюдалось, что экстремофильные виды способны к выживанию.[8] Это в первую очередь потому, что магнитное поле Земли защищает всех ее жителей от солнечного космического излучения и галактических космических лучей,[9] которые являются двумя основными источниками ионизирующего излучения в нашей Солнечной системе,[10] и даже включая все зарегистрированные наземные источники ионизирующего излучения, такие как газ радон и первичные радионуклиды в географических точках, которые считаются естественными объектами высокого уровня радиации, годовая доза естественного фонового излучения[11] остается в десятки тысяч раз меньше, чем уровни ионизирующего излучения, которым могут противостоять многие очень радиорезистентные организмы.
Одним из возможных объяснений существования радиорезистентности является то, что это пример кооптированной адаптации или экстаптации, где радиорезистентность может быть косвенным следствием эволюции другой, связанной адаптации, которая была положительно выбрана эволюцией. Например, гипотеза адаптации к высыханию предполагает, что экстремальные температуры, присутствующие в местах обитания гипертермофилов, таких как Dеinococcus radiodurans вызывать клеточное повреждение, которое практически идентично повреждению, обычно вызываемому ионизирующим излучением, и что механизмы восстановления клеток, которые развились для восстановления этого теплового или высыхающего повреждения, также могут быть обобщены на радиационное повреждение, что позволяет D. Radiodurans выжить в экстремальных дозах ионизирующего излучения.[12] Воздействие гамма-излучения приводит к повреждению клеточной ДНК, включая изменения в спаривании оснований, повреждение сахарно-фосфатного остова и повреждения двухцепочечной ДНК.[13] Чрезвычайно эффективные механизмы восстановления клеток, которые Deinoccocus виды как D. Radiodurans эволюционировали для восстановления теплового повреждения, вероятно, также способны обратить вспять эффекты повреждения ДНК, вызванного ионизирующим излучением, например, собирая вместе любые компоненты своего генома, которые были фрагментированы излучением.[14][15][16]
Бациллы sp. производящие необычно устойчивые к радиации (и перекиси) споры, были изолированы от сборочных объектов космических кораблей и рассматриваются как кандидаты, которые могут путешествовать на космических кораблях посредством межпланетной передачи.[17][18][19][20][21] Анализ генома некоторых из этих продуцентов радиационно-устойчивых спор пролил свет на генетические особенности, которые могут быть ответственны за наблюдаемую устойчивость.[22][23][24][25]
Радиорезистентность в радиационной онкологии
Радиорезистентность также термин, иногда используемый в медицине (онкология ) для рак клетки, которые трудно лечить лучевая терапия. Радиорезистентность раковых клеток может быть внутренней или индуцированной самой лучевой терапией.
Сравнение радиорезистентности
Сравнение в таблице ниже предназначено только для того, чтобы дать приблизительные показатели радиорезистентности для различных видов, и к нему следует относиться с большой осторожностью. Обычно существуют большие различия в радиорезистентности одного вида в разных экспериментах из-за того, как радиация влияет на живые ткани, и из-за различных условий эксперимента. Например, мы должны учитывать, что, поскольку радиация препятствует делению клеток, незрелые организмы менее устойчивы к радиации, чем взрослые, а взрослых стерилизуют в дозах, намного меньших, чем это необходимо для их уничтожения. Например, для насекомого-паразитоида Габробракон hebetor, LD50 для гаплоидного эмбриона при дроблении (возраст 1–3 часа) - 200 р, но примерно через 4 часа это уже 7000 р (для интенсивности рентгеновского излучения 110 Р / мин), а гаплоидные (= мужские) эмбрионы более устойчивы, чем диплоидные (= женские) эмбрионы.[26] Смертность взрослых Х. Хебетор подверглись дозе 180 250 р то же самое для необлученной контрольной группы (питание не было предоставлено ни одной из групп) (6000 р / мин).[27][28] Однако более низкой дозы 102000 Р (для 6000 Р / мин) достаточно, чтобы вызвать состояние летаргии. Х. Хебетор это проявляется в полном прекращении активности, включая прекращение кормления, и эти люди в конечном итоге позволяют себе умереть от голода.[28] И даже более низкой дозы 4858 Р (для 2650 Р / мин) достаточно для стерилизации взрослой женщины. Х. Хебетор (бесплодие наступает через 3 дня после контакта).[29] Другие важные факторы, влияющие на уровень радиорезистентности, включают: продолжительность времени, в течение которого доза облучения доставляется - дозы, доставляемые в течение более длительных периодов или с временными интервалами, связаны со значительным уменьшением негативных эффектов;[29][30]Состояние кормления особей - особи, получавшие до и после кормления, более устойчивы к радиации по сравнению с голодными особями;[29][30] Тип используемого излучения (например, тихоходки Milnesium tardigradum облученные тяжелыми ионами имеют более высокую выживаемость, чем при облучении гамма-лучами при той же дозе облучения);[31] Физиологическое состояние особей (например, тихоходки) Рихтерсиус коронифер и Milnesium tardigradum более устойчивы к гамма-излучению в гидратированном состоянии, и Macrobiotus areolatus в ангидробиотическом состоянии более устойчив к рентгеновскому излучению).[31] Способ измерения летальности также является источником вариаций для предполагаемой радиорезистентности вида. Облученные образцы не погибают мгновенно, если они не подвергаются воздействию очень высокой дозы (острой дозы).[32] Следовательно, облученные образцы умирают в течение определенного периода времени, и более низкие дозы облучения соответствуют более длительному выживанию. Это означает, что доза облучения LD50 колеблется в зависимости от времени измерения. Например, доза β-излучения, вызывающая 50% -ную смертность в Американский таракан через 25 дней после воздействия составляет 5700 Р, но для достижения 50% смертности через 3 дня после воздействия необходимо 45 610 Р.[30] 25 дней могут представлять собой длительный период выживания для короткоживущих видов, таких как насекомые, но будут представлять очень короткое время выживания для долгоживущих видов, таких как млекопитающие, поэтому сравнение выживания разных видов через такое же количество времени после воздействия также создает некоторые проблемы интерпретации. Эти примеры иллюстрируют многие проблемы, связанные со сравнением радиорезистентности между видами, и необходимость осторожности при этом.
| Организм | Смертельная доза | LD50 | LD100 | Класс / Королевство |
|---|---|---|---|---|
| Собака | 3,5 (LD50/30 дней)[33] | Млекопитающие | ||
| Человек | 4–10[34] | 4.5[35] | 10[36] | Млекопитающие |
| Крыса | 7.5 | Млекопитающие | ||
| Мышь | 4.5–12 | 8.6–9 | Млекопитающие | |
| Кролик | 8 (ЛД50/30 дней)[33] | Млекопитающие | ||
| Черепаха | 15 (ЛД50/30 дней)[33] | Рептилия | ||
| Золотая рыбка | 20 (ЛД50/30 дней)[33] | Рыбы | ||
| кишечная палочка | 60 | 60 | Бактерии | |
| Немецкий таракан | 64[34] | Насекомые | ||
| Моллюски | 200 (ЛД50/30 дней)[33] | - | ||
| Обыкновенная плодовая муха | 640[34] | Насекомые | ||
| C. elegans∗ | 160-200 [37] | ≫ 500-800[38][39] | Нематода | |
| Амеба | 1000 (ЛД50/30 дней)[33] | - | ||
| Габробракон хебетор | 1,800[27][28] | Насекомые | ||
| Milnesium tardigradum | 5,000[31] | Eutardigrade | ||
| Дейнококк радиодуранс | 15,000[34] | Бактерии | ||
| Thermococcus gammatolerans | 30,000[34] | Археи |
∗ В то время как ЛД50 сообщалось о диком типе C. elegans индивидуумов, верхний предел летальности не установлен, скорее, «почти все животные были живы без каких-либо признаков избыточной летальности до 800 Гр, самая высокая доза ... измеренная».[39]
Смотрите также
- Экс-рад а радиозащитный препарат изучен на его способность защищать от острый лучевой синдром
- CBLB502 похожий радиозащитный препарат, который защищает от острый лучевой синдром, в течение лучевая терапия.
- Радиочувствительность
- Фоновое излучение
- Радиационный гормезис
- Радиотрофный гриб
- Койевая кислота
Примечания и ссылки
- ^ Сгайер, Хайтам; Гедира, Каис; Бенкахла, Алия; Баркаллах, Инсаф (2008). «Механизм базальной репарации ДНК подлежит положительному отбору у устойчивых к ионизирующему излучению бактерий». BMC Genomics. 9: 297. Дои:10.1186/1471-2164-9-297. ЧВК 2441631. PMID 18570673.
- ^ Cordeiro, AR; Marques, EK; Вейга-Нето, AJ (1973). «Радиорезистентность естественной популяции Дрозофила виллистони живущие в радиоактивной среде ". Мутационные исследования. 19 (3): 325–9. Дои:10.1016/0027-5107(73)90233-9. PMID 4796403.
- ^ Мустаччи, Э (1965). «Индукция физическими и химическими агентами мутаций радиорезистентности у Saccharomyces cerevisiae». Мутационные исследования. 2 (5): 403–12. Дои:10.1016/0027-5107(65)90052-7. PMID 5878261.
- ^ Moseley BEB; Маттингли А (1971). «Ремонт облученной трансформирующей дезоксирибонуклеиновой кислоты у дикого типа и радиационно-чувствительного мутанта Micrococcus radioduranns». J. Bacteriol. 105 (3): 976–83. Дои:10.1128 / JB.105.3.976-983.1971. ЧВК 248526. PMID 4929286.
- ^ Мюррей РГЭ. 1992. Семейство Deino-coccaceae. В Прокариотах, изд. Баллоуз, Х. Г. Трупер, М. Дворкин, У. Хардер, К. Х. Шлейфер 4: 3732–44. Нью-Йорк: Springer-Verlag
- ^ Ито Н; Watanabe H; Takeshia M; Иидзука Х (1983). «Выделение и идентификация радиационно-устойчивых кокков, принадлежащих к роду Deinococcus, из осадков сточных вод и кормов для животных». Сельскохозяйственная и биологическая химия. 47 (6): 1239–47. Дои:10.1271 / bbb1961.47.1239.
- ^ Форнальский К.В. (2019). «Радиационно-адаптивный ответ и рак: с точки зрения статистической физики». Физический обзор E. 99 (2): 022139. Bibcode:2019PhRvE..99b2139F. Дои:10.1103 / PhysRevE.99.022139. PMID 30934317.
- ^ Анитори, Роберто Пол (2012). Экстремофилы: микробиология и биотехнология. Horizon Scientific Press. ISBN 9781904455981.
- ^ Мукерджи, Саумитра (2008-12-03). «Космическое влияние на среду Солнце-Земля». Датчики (Базель, Швейцария). 8 (12): 7736–7752. Дои:10,3390 / с8127736. ISSN 1424-8220. ЧВК 3790986. PMID 27873955.
- ^ Кеннеди, Энн Р. (2014-04-01). «Биологические эффекты космической радиации и разработка эффективных мер противодействия». Науки о жизни в космических исследованиях. 1: 10–43. Bibcode:2014ЛССР .... 1 ... 10 тыс.. Дои:10.1016 / j.lssr.2014.02.004. ISSN 2214-5524. ЧВК 4170231. PMID 25258703.
- ^ Шахбази-Гахруэй, Дарьюш; Голами, Мехрдад; Сетаянде, Самане (1 января 2013 г.). «Обзор естественного радиационного фона». Передовые биомедицинские исследования. 2 (1): 65. Дои:10.4103/2277-9175.115821. ISSN 2277-9175. ЧВК 3814895. PMID 24223380.
- ^ Mattimore, V .; Баттиста, Дж. Р. (февраль 1996 г.). «Радиорезистентность Deinococcus radiodurans: функции, необходимые для выживания при ионизирующем излучении, также необходимы, чтобы пережить длительное высыхание». Журнал бактериологии. 178 (3): 633–637. Дои:10.1128 / jb.178.3.633-637.1996. ISSN 0021-9193. ЧВК 177705. PMID 8550493.
- ^ Friedberg, Errol C .; Фридберг, ЕС; Уокер, GC; Уокер, Грэм С .; Зиде, Вольфрам; Вольфрам, Зиде (1995). Ремонт ДНК и мутагенез. ASM Press. ISBN 9781555810887.
- ^ Минтон, К. У. (июль 1994 г.). «Восстановление ДНК в чрезвычайно радиоустойчивой бактерии Deinococcus radiodurans». Молекулярная микробиология. 13 (1): 9–15. Дои:10.1111 / j.1365-2958.1994.tb00397.x. ISSN 0950-382X. PMID 7984097.
- ^ Слэйд, Деа; Радман, Мирослав (март 2011). «Устойчивость к окислительному стрессу у Deinococcus radiodurans». Обзоры микробиологии и молекулярной биологии. 75 (1): 133–191. Дои:10.1128 / MMBR.00015-10. ISSN 1098-5557. ЧВК 3063356. PMID 21372322.
- ^ Агапов, А. А .; Кульбачинский, А.В. (октябрь 2015). «Механизмы стрессоустойчивости и регуляции генов у радиорезистентной бактерии Deinococcus radiodurans». Биохимия. Биохимия. 80 (10): 1201–1216. Дои:10.1134 / S0006297915100016. ISSN 1608-3040. PMID 26567564. S2CID 14981740.
- ^ La Duc MT, Николсон В., Керн Р., Венкатесваран К. (2003). «Микробиологическая характеристика космического корабля Mars Odyssey и его установки для герметизации». Environ Microbiol. 5 (10): 977–85. Дои:10.1046 / j.1462-2920.2003.00496.x. PMID 14510851.
- ^ Линк Л., Сойер Дж., Венкатесваран К., Николсон В. (февраль 2004 г.). «Чрезвычайная стойкость спор к ультрафиолетовому излучению Bacillus pumilus изоляты, полученные из сверхчистой сборки космических аппаратов ". Microb Ecol. 47 (2): 159–163. Дои:10.1007 / s00248-003-1029-4. PMID 14502417. S2CID 13416635.
- ^ Кемпф М.Дж., Чен Ф., Керн Р., Венкатесваран К. (июнь 2005 г.). «Повторное выделение устойчивых к перекиси водорода спор Bacillus pumilus из сборочного цеха космических кораблей ». Астробиология. 5 (3): 391–405. Bibcode:2005AsBio ... 5..391K. Дои:10.1089 / ast.2005.5.391. PMID 15941382.
- ^ Ньюкомб Д.А., Шуэргер А.С., Бенардини Дж. Н., Дикинсон Д., Таннер Р., Венкатесваран К. (декабрь 2005 г.). «Выживание микроорганизмов, связанных с космическими кораблями, при моделировании марсианского УФ-излучения». Appl Environ Microbiol. 71 (12): 8147–8156. Дои:10.1128 / AEM.71.12.8147-8156.2005. ЧВК 1317311. PMID 16332797.
- ^ Гош С., Осман С., Вайшампаян П., Венкатешваран К. (2010). «Периодическая изоляция экстремотолерантных бактерий в чистой комнате, где были собраны компоненты космического корабля Phoenix» (PDF). Астробиология. 10 (3): 325–35. Bibcode:2010AsBio..10..325G. Дои:10.1089 / аст.2009.0396. HDL:2027.42/85129. PMID 20446872.
- ^ Джоя Дж., Йеррапрагада С., Цинь Х и др. (Сентябрь 2007 г.). «Парадоксальная репарация ДНК и сохранение гена устойчивости к перекиси в Bacillus pumilus САФР-032 ". PLOS ONE. 2 (9: e928): e928. Bibcode:2007PLoSO ... 2..928G. Дои:10.1371 / journal.pone.0000928. ЧВК 1976550. PMID 17895969.
- ^ Тирумалай MR, Rastogi R, Zamani N, O'Bryant Williams E, Allen S, Diouf F, Kwende S, Weinstock GM, Venkateswaran KJ, Fox GE (июнь 2013 г.). «Гены-кандидаты, которые могут быть ответственны за необычную резистентность, проявляемую Bacillus pumilus SAFR-032 Споры ". PLOS ONE. 8 (6: e66012): e66012. Bibcode:2013PLoSO ... 866012T. Дои:10.1371 / journal.pone.0066012. ЧВК 3682946. PMID 23799069.
- ^ Тирумалай MR, Fox GE (сентябрь 2013 г.). "Элемент, подобный ICEBs1, может быть связан с чрезвычайной радиационной и высыхающей стойкостью Bacillus pumilus Споры SAFR-032 ". Экстремофилов. 17 (5): 767–774. Дои:10.1007 / s00792-013-0559-z. PMID 23812891. S2CID 8675124.
- ^ Тирумалай М.Р., Степанов В.Г., Вюнше А., Монтазари С., Гонсалес Р.О., Венкатесваран К., Fox GE (июнь 2018 г.). "B. safensis FO-36bТ и B. pumilus SAFR-032: Сравнение полного генома двух изолятов сборочного цеха космического корабля ». BMC Microbiol. 18 (57): 57. Дои:10.1186 / s12866-018-1191-у. ЧВК 5994023. PMID 29884123.
- ^ Кларк, AM; Митчелл, CJ (1952). «Действие рентгеновских лучей на гаплоидные и диплоидные эмбрионы Габробракон". Биологический бюллетень. 103 (2): 170–177. Дои:10.2307/1538443. JSTOR 1538443.
- ^ а б Салливан, Р. Грош, Д. (1953). «Радиационная устойчивость взрослой осы». Нуклеотики. 11: 21–23.
- ^ а б c Грош, Д.С. (1954). «Вызванная летаргия и радиационный контроль насекомых». Журнал экономической энтомологии. 49 (5): 629–631. Дои:10.1093 / jee / 49.5.629.
- ^ а б c Грош, Д.С. Салливан, Р.Л. (1954). "Количественные аспекты постоянного и временного бесплодия у женщин Габробракон рентгеновскими лучами и β-излучением ». Радиационные исследования. 1 (3): 294–320. Bibcode:1954РадР .... 1..294Г. Дои:10.2307/3570374. JSTOR 3570374. PMID 13167339.
- ^ а б c Уортон, ДРА; Wharton, ML (1959). «Влияние радиации на долголетие таракана, Periplaneta americanaв зависимости от дозы, возраста, пола и приема пищи ". Радиационные исследования. 11 (4): 600–615. Bibcode:1959RadR ... 11..600Вт. Дои:10.2307/3570814. JSTOR 3570814. PMID 13844254.
- ^ а б c Хорикава DD; Сакашита Т; Катагири С; Watanabe M; и другие. (2006). «Радиационная толерантность тихоходок Milnesium tardigradum». Международный журнал радиационной биологии. 82 (12): 843–8. Дои:10.1080/09553000600972956. PMID 17178624. S2CID 25354328.
- ^ Хайденталь, Г. (1945). "Возникновение индуцированных рентгеновскими лучами доминантных летальных мутаций в Габробракон". Генетика. 30 (2): 197–205. ЧВК 1209282. PMID 17247153.
- ^ а б c d е ж Радиохимия и ядерная химия, G. Choppin, JO. Лильензин и Дж. Ридберг, издание третье, стр. 481, ISBN 0-7506-7463-6
- ^ а б c d е «Тараканы и радиация». 2006-02-23. Получено 2006-05-13.
- ^ «Радиационные заметки: радиационное повреждение и измерение дозы». Получено 2018-06-16.
- ^ "Центр контроля заболеваний, радиационные чрезвычайные ситуации, острый радиационный синдром: информационный бюллетень для врачей". Архивировано из оригинал на 2006-07-16.
- ^ Hartman, P; Goldstein, P; Альгарра, М; Хаббард, Д; Мабери, Дж (1996). «Нематода Caenorhabditis elegans до 39 раз более чувствительна к гамма-излучению от 137Cs, чем от 60Co». Mutat Res. 363 (3): 201–208. Дои:10.1016/0921-8777(96)00012-2. PMID 8765161.
- ^ Weidhaas, J.B .; Eisenmann, D.M .; Holub, J.M .; Наллур, С.В. (2006). «Тканевая модель Caenorhabditis elegans радиационно-индуцированной гибели репродуктивных клеток». Proc Natl Acad Sci USA. 103 (26): 9946–51. Bibcode:2006PNAS..103.9946W. Дои:10.1073 / pnas.0603791103. ЧВК 1502559. PMID 16788064.
- ^ а б Криско, А .; Magali, L .; Radman, M .; Мезельсон, М. (2012). «Экстремальная антиоксидантная защита от ионизирующего излучения у бделлоидных коловраток». Proc Natl Acad Sci USA. 109 (7): 2354–2357. Bibcode:2012PNAS..109.2354K. Дои:10.1073 / pnas.1119762109. ЧВК 3289372. PMID 22308443.
дальнейшее чтение
- Столяр, М. (1994). «Индуцированная радиорезистентность: обзор и историческая перспектива». Международный журнал радиационной биологии. 65 (1): 79–84. Дои:10.1080/09553009414550111. PMID 7905914.
- Клифтон Линг, К .; Эндлих, Б. (1989). «Радиорезистентность, вызванная онкогенной трансформацией». Радиационные исследования. 120 (2): 267–79. Bibcode:1989РадР..120..267Л. Дои:10.2307/3577713. JSTOR 3577713. PMID 2694214.
- Nothel, Х. (1987). «Адаптация популяций Drosophila melanogaster к высокому давлению мутаций: эволюционное регулирование скорости мутаций». Труды Национальной академии наук. 84 (4): 1045–9. Bibcode:1987ПНАС ... 84.1045Н. Дои:10.1073 / пнас.84.4.1045. ЧВК 304358. PMID 3103121.
- Форнальски, К. (2016). «Излучение и эволюция: от уравнения Лотки-Вольтерра к уравнению баланса». Международный журнал низкой радиации. 10 (3): 222–33. Дои:10.1504 / IJLR.2016.10002388.
