Реакция Реймера – Тимана. - Reimer–Tiemann reaction
| Реакция Реймера – Тимана, также известная как реакция RT. | |
|---|---|
| Названный в честь | Карл Реймер Фердинанд Тиманн |
| Тип реакции | Реакция замещения |
| Идентификаторы | |
| RSC ID онтологии | RXNO: 0000072 |
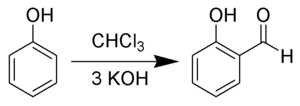
В Реакция Реймера – Тимана. это химическая реакция используется для орто -формилирование фенолов;[1][2][3][4][5] простейшим примером является преобразование фенол к салициловый альдегид. Реакция была обнаружена Карл Реймер[6] и Фердинанд Тиманн. Речь идет о Карле Реймере (1845–1883), а не менее известном Карле Людвиге Реймере (1856–1921).[7]
Механизм реакции

Хлороформ (1) депротонируется сильным основанием (обычно гидроксид ) с образованием карбаниона хлороформа (2) который быстро устранит альфа-канал, чтобы дать дихлоркарбен (3); это основные реактивные частицы. Гидроксид также депротонирует фенол (4) с образованием отрицательно заряженного феноксида (5). Отрицательный заряд делокализован в ароматическом кольце, что делает его гораздо более нуклеофильным. Нуклеофильная атака на дихлоркарбен дает промежуточный дихлорметилзамещенный фенол (7). После основного гидролиза желаемый продукт (9) сформирован.[8]
Селективность
Благодаря своим 2 электроноакцепторным хлорным группам карбен (3) сильно дефицит электронов и притягивается к богатому электронами феноксиду (5). Это взаимодействие способствует селективному орто-формилированию.
Условия реакции
Гидроксиды обычно плохо растворяются в хлороформе, поэтому реакцию обычно проводят в двухфазный система растворителей. В простейшем смысле он состоит из водного раствора гидроксида и органической фазы, содержащей хлороформ. Таким образом, два реагента разделены и должны быть собраны вместе, чтобы реакция прошла. Этого можно добиться быстрым перемешиванием, катализаторы межфазного переноса, или эмульгатор (использование 1,4-диоксан в качестве растворителя является примером).
Чтобы инициировать процесс, реакцию обычно необходимо нагреть, однако после запуска реакция Реймера-Тимана может быть сильно экзотермической, такая комбинация делает ее склонной к тепловые побеги.
Объем
Реакция Реймера – Тимана эффективна для других гидроксиароматических соединений, таких как нафтолы.[9] Электронно-богатые гетероциклы, такие как пирролы и индолы также известны своей реакцией.
Дихлоркарбены могут реагировать с алкенами и аминами с образованием соответственно дихлорциклопропанов и изоцианиды. По существу, реакция Реймера-Тимана может быть неподходящей для субстратов, содержащих эти функциональные группы. Кроме того, многие соединения не выдерживают нагревания в присутствии гидроксида.
Сравнение с другими методами
Прямая формилирование ароматических соединения может быть выполнено различными способами, такими как Реакция Гаттермана, Реакция Гаттермана – Коха, Реакция Вильсмайера – Хаака, или же Дафф реакция; однако, с точки зрения простоты и безопасности операций, реакция Реймера – Тимана часто является наиболее выгодным путем, выбранным в химический синтез. Из реакций, упомянутых ранее, реакция Реймера – Тимана - единственный путь, не требующий кислый и / или безводный условия.[3] Кроме того, реакции Гаттермана-Коха и Вильсмайера-Хаака неприменимы к фенолу. субстраты.
Вариации
Реакцию Реймера – Тимана можно изменить, чтобы получить фенольные кислоты путем замены хлороформ с четыреххлористый углерод.[10] Например, измененная реакция с фенолом даст салициловая кислота а не ожидаемый продукт, салициловый альдегид.
Рекомендации
- ^ Reimer, K .; Тиманн, Ферд. (1876 г.). "Ueber die Einwirkung von Chloroform auf Phenole und besonders aromatische Oxysäuren in alkalischer Lösung" [О влиянии хлороформа на фенолы и особенно ароматические оксикислоты в щелочном растворе]. Berichte der Deutschen Chemischen Gesellschaft. 9 (2): 1268–1278. Дои:10.1002 / cber.18760090270.
- ^ Винберг, Ганс (1960). «Реакция Реймера-Тимана». Химические обзоры. 60 (2): 169–184. Дои:10.1021 / cr60204a003.
- ^ а б Винберг и Мейер, Эгберт, Ганс; Мейер, Эгберт В. (2005). Реакция Реймера – Тимана.. п. 14. Дои:10.1002 / 0471264180.or028.01. ISBN 9780471264187.
- ^ Даубен, Уильям Г. (1982). «Реакция Реймера-Тимана». Органические реакции, том 28. Хобокен, Нью-Джерси: Wiley-Interscience. С. 1–36. Дои:10.1002 / 0471264180.or028.01. ISBN 978-0471861416.
- ^ Винберг, Ганс (1991). «Реакция Реймера – Тимана». Комплексный органический синтез. 2. С. 769–775. Дои:10.1016 / B978-0-08-052349-1.00048-2. ISBN 978-0-08-052349-1. Отсутствует или пусто
| название =(помощь) - ^ Реймер, К. (1876 г.). "Ueber eine neue Bildungsweise aromatischer Aldehyde" [О новом способе образования ароматических альдегидов]. Berichte der Deutschen Chemischen Gesellschaft (на немецком). 9: 423–424. Дои:10.1002 / cber.187600901134.
- ^ Реймер, Карл (1883) "Sitzung vom 22. января 1883". Berichte der deutschen chemischen Gesellschaft. 16, п. 101.
- ^ Хайн, Джек; Ван дер Вин, Джеймс М. (декабрь 1959 г.). «Механизм реакции Реймера-Тимана». Журнал Американского химического общества. 81 (24): 6446–6449. Дои:10.1021 / ja01533a028.
- ^ Рассел, Альфред; Локхарт, Лютер Б. (1942). «2-ГИДРОКСИ-1-НАФТАЛЬДЕГИД». Органический синтез. 22: 63. Дои:10.15227 / orgsyn.022.0063.
- ^ Gaonkar, A.V .; Киртани, Дж. (2010). "ХимИнформ Резюме: Реакция Реймера-Тимана с использованием тетрахлорметана". ХимИнформ. 22 (41): 1991. Дои:10.1002 / чин.199141092.
