Салициловый альдегид - Salicylaldehyde
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название IUPAC 2-гидроксибензальдегид[1] | |||
| Другие имена Салициловый альдегид Салициловый альдегид о-Гидроксибензальдегид | |||
| Идентификаторы | |||
3D модель (JSmol ) | |||
| ЧЭБИ | |||
| ЧЭМБЛ | |||
| ChemSpider | |||
| ECHA InfoCard | 100.001.783 | ||
| UNII | |||
| |||
| |||
| Характеристики | |||
| C7ЧАС6О2 | |||
| Молярная масса | 122.123 г · моль−1 | ||
| Плотность | 1,146 г / см3 | ||
| Температура плавления | -7 ° С (19 ° F, 266 К) | ||
| Точка кипения | От 196 до 197 ° C (от 385 до 387 ° F, от 469 до 470 K) | ||
| -64.4·10−6 см3/ моль | |||
| Опасности | |||
| Паспорт безопасности | [2] | ||
| Пиктограммы GHS |   | ||
| Сигнальное слово GHS | Предупреждение | ||
| H302, H315, H317, H319, H335, H411[2] | |||
| P280, P305 + 351 + 338[2] | |||
| Родственные соединения | |||
Родственные соединения | Салициловая кислота Бензальдегид Салицилальдоксим | ||
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Салициловый альдегид (2-гидроксибензальдегид) является органическое соединение с формулой C6ЧАС4СНО-2-ОН.[3] Вместе с 3-гидроксибензальдегид и 4-гидроксибензальдегид, это один из трех изомеры из гидроксибензальдегид. Эта бесцветная маслянистая жидкость при более высокой концентрации имеет запах горького миндаля. Салицилальдегид является ключевым предшественником различных хелатирующих агентов, некоторые из которых имеют коммерческое значение.
Производство
Салициловый альдегид получают из фенол и хлороформ путем нагревания с едкий натр или же гидроксид калия в Реакция Реймера – Тимана.:[4]
Альтернативно, его получают конденсацией фенола или его производных с формальдегидом с образованием гидроксибензилового спирта, который окисляется до альдегида.
Салицилальдегиды, как правило, могут быть получены из соответствующего фенола путем Дафф реакция, или обработкой параформальдегид в присутствии хлорид магния и база.[5]
Природные явления
Салицилальдегид был идентифицирован как характерный ароматический компонент гречневая крупа.[6]
Это также один из компонентов кастореум экссудат касторовых мешочков зрелого североамериканского бобра (Castor canadensis ) и бобр европейский (Касторовое волокно ), используется в парфюмерии.
Кроме того, салицилальдегид присутствует в защитных секретах личинок нескольких животных. листоед виды, относящиеся к подтрибе Chrysomelina.[7] Примером видов листоедов, которые продуцируют салицилальдегид, является листоед красный тополь. Chrysomela populi.
Реакции и заявки
Салицилальдегид используется для получения следующего:
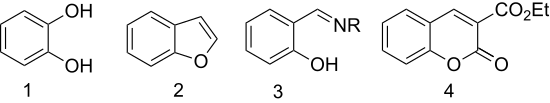
- Окисление пероксид водорода дает катехол (1,2-дигидроксибензол) (Реакция Дакина ).[8]
- Этерификация с хлоруксусная кислота с последующей циклизацией дает гетероцикл бензофуран (кумарон).[9] {Первая стадия этой реакции с замещенным бензофураном называется Конденсация Rap – Stoermer по Э. Рэпу (1895) и Р. Штёрмеру (1900).[10][11]
- Салициловый альдегид превращается в хелатирующий лиганды конденсацией с аминами. С этилендиамин, он конденсируется с образованием лиганда Сален. Гидроксиламин дает салицилальдоксим.
- Конденсация с диэтилмалонат дает 3-карбетоксикумарин (производное кумарин ) от альдольная конденсация.[12]
Рекомендации
- ^ «Переднее дело». Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 (Синяя книга). Кембридж: Королевское химическое общество. 2014. с. 652. Дои:10.1039 / 9781849733069-FP001. ISBN 978-0-85404-182-4.
- ^ а б c Сигма-Олдрич Ко., Салициловый альдегид. Проверено 24 мая 2018.
- ^ Индекс Merck, 11-е издание, 8295
- ^ Brühne, F .; Райт, Э. «Бензальдегид». Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a03_463.CS1 maint: несколько имен: список авторов (связь)
- ^ Тронд Видар Хансен; Ларс Скаттебёль (2005). «Орто-формилирование фенолов; получение 3-бромсалицилальдегида». Органический синтез. 82: 64.
- ^ Janeš, D .; Крефт, С. (2008). «Салицилальдегид - характерный ароматический компонент гречневой крупы». Пищевая химия. 109 (2): 293–298. Дои:10.1016 / j.foodchem.2007.12.032. PMID 26003350.
- ^ Паулс Г., Беккер Т. и др. (2016). Две линии защиты у молодых листоедов; Эфиры 3-нитропропионовой кислоты в гемолимфе и апосематическое предупреждение. Журнал химической экологии 42 (3) 240-248.
- ^ Дакин, Х. Д. (1923). «Катехол» (PDF). Органический синтез. 3: 28.; Коллективный объем, 1, п. 149
- ^ Burgstahler, A. W .; Уорден, Л. Р. (1966). «Кумарон» (PDF). Органический синтез. 46: 28.CS1 maint: несколько имен: список авторов (связь); Коллективный объем, 5, п. 251
- ^ Рэп, Э. (ноябрь 1895 г.). «Сулл-α-Бензоилкумарон» [Об α-Бензоилкумароне]. Gazzetta Chimica Italiana. 2 (4): 285–290.
- ^ Штёрмер, Р. (1900). "Synthesen und Abbaureactionen in der Cumaronreihe". Annalen der Chemie Либиха. 312 (3): 237–336. Дои:10.1002 / jlac.19003120302.
- ^ Хорнинг, Э. С .; Хорнинг, М. Г .; Диммиг, Д. А. (1948). «3-карбетоксикумарин» (PDF). Органический синтез. 28: 24.CS1 maint: несколько имен: список авторов (связь); Коллективный объем, 3, п. 165



