Сциталидопепсин B - Scytalidopepsin B - Wikipedia
| Сциталидокарбоксилпептидаза B | |||||||||
|---|---|---|---|---|---|---|---|---|---|
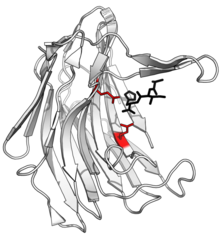 Структура сциталидокарбоксилпептидаза B, с расщепленным пептидом товар в черном и активный сайт Боковые цепи глутамат-глутаминовой диады показаны красным. (PDB: 1С2К) | |||||||||
| Идентификаторы | |||||||||
| Номер ЕС | 3.4.23.32 | ||||||||
| Количество CAS | 104781-89-7 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||
Сциталидокарбоксилпептидаза B, также известный как Сциталидоглутаминовая пептидаза и Сциталидопепсин B (EC 3.4.23.32, устаревшие имена включают Сциталидия аспарагиновая протеиназа B, Карбоксильная протеиназа Ganoderma lucidum, Аспарагиновая протеиназа Ganoderma lucidum, Scytalidium lignicolum аспарагиновая протеиназа B, SLB) это протеолитический фермент.[1][2][3][4][5] Ранее считалось, что это аспарагиновая протеаза, но определение его молекулярной структуры показало, что он принадлежит к новой группе протеаз, глутаминовая протеаза.[6][7]
Протеаза имеет уникальную структуру и новую каталитическую диаду (E136 и Q53) в ее активном центре. Остатки активного центра, глутаминовая кислота (E) и глутамин (Q), были использованы для создания названия семейства протеазы, эколизины, к которой принадлежит сциталидоглутаминовая пептидаза B.[6]
Этот фермент катализирует следующее химическая реакция
- Гидролиз белков с широкой специфичностью, расщепляющих Phe24-Фи и Тир26–Thr, но не Leu15-Тир и Фе25-Тыр в цепочке B инсулин. Он также расщепляет Его6–Про облигация ангиотензин I способность расщеплять пептидную связь с Pro в положении P1 'необычна.
Этот эндопептидаза изолирован от Сциталидий лигниколум. Это кислая протеаза, наиболее активная при pH 2,0, когда в качестве субстрата используется казеин. Эколозины предпочитают громоздкие аминокислотные остатки в сайте P1 и небольшие аминокислотные остатки в сайте P1 '.[8] Субстратная специфичность сциталидоглутаминовой пептидазы уникальна, особенно в предпочтениях субстратов в положениях P3 (основная аминокислота), P1 '(малая аминокислота) и P3' (основная).[9]
Рекомендации
- ^ Терашита, Т .; Ода, К .; Коно, М .; Мурао, С. (1981). "Streptomyces нечувствительная к ингибитору пепсина карбоксильная протеиназа из Lentinus edodes". Agric. Биол. Chem. 45: 1937–1943. Дои:10.1271 / bbb1961.45.1937.
- ^ Maita, T .; Nagata, S .; Matsuda, G .; Maruta, S .; Ода, К .; Murao, S .; Цуру Д. (1984). "Полная аминокислотная последовательность Сциталидий лигниколум кислотная протеаза B ». J. Biochem. 95 (2): 465–473. Дои:10.1093 / oxfordjournals.jbchem.a134628. PMID 6370989.
- ^ Терашита, Т .; Ода, К .; Коно, М .; Мурао, С. (1984). "Streptomyces нечувствительная к ингибитору пепсина карбоксильная протеиназа из Ganoderma lucidum". Agric. Биол. Chem. 48: 1029–1035. Дои:10.1271 / bbb1961.48.1029.
- ^ Кобаяши, H .; Kusakabe, I .; Мураками, К. (1985). "Очистка и характеристика нечувствительной к пепстатину карбоксилпротеиназы из Полипор тюльпановый (Ирпекс лактеус)". Agric. Биол. Chem. 49 (8): 2393–2397. Дои:10.1271 / bbb1961.49.2393.
- ^ Tsuru, D .; Shimada, S .; Maruta, S .; Ёсимото, Т .; Ода, К .; Murao, S .; Miyata, T .; Иванага, С. (1986). «Выделение и аминокислотная последовательность пептида, содержащего реагирующий с эпоксидом остаток, из термолизинового гидролизата Сциталидий лигниколум кислотная протеаза B ». J. Biochem. 99 (5): 1537–1539. Дои:10.1093 / oxfordjournals.jbchem.a135624. PMID 3519605.
- ^ а б Масао Фудзинага; Майя М. Черная; Хироши Ояма; Кохей Ода; Майкл Н. Дж. Джеймс (2004). «Молекулярная структура и каталитический механизм новой карбоксилпептидазы из Scytalidium lignicolum». Proc Natl Acad Sci U S A. 101 (10): 3364–9. Дои:10.1073 / pnas.0400246101. ЧВК 373467. PMID 14993599.
- ^ Пиллай Б., Черный М.М., Хирага К., Такада К., Ода К., Джеймс М.Н. (2007). «Кристаллическая структура сциталидоглутаминовой пептидазы с ее первым мощным ингибитором дает представление о субстратной специфичности и катализе». Журнал молекулярной биологии. 365 (2): 343–61. Epub 2006. Дои:10.1016 / j.jmb.2006.09.058. PMID 17069854.
- ^ Кохей Ода (2012). «Новые семейства карбоксилпептидаз: серин-карбоксилпептидазы и глутаминовые пептидазы». Журнал биохимии. 151 (1): 13–25. Дои:10.1093 / jb / mvr129. PMID 22016395.
- ^ Катаока Й, Такада К., Ояма Х, Цунэми М., Джеймс М. Н., Ода К. (2005). «Каталитические остатки и субстратная специфичность сциталидоглутаминовой пептидазы, первого члена эколизина в семействе (G1) пептидаз». FEBS Lett. 579 (14): 2991–4. Дои:10.1016 / j.febslet.2005.04.050. PMID 15907842.
внешняя ссылка
- Сциталидопепсин + B в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
