Бета-секретаза 1 - Beta-secretase 1
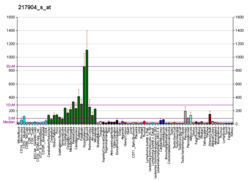
Бета-секретаза 1, также известный как фермент, расщепляющий белок-предшественник амилоида бета-сайта 1, фермент, расщепляющий APP 1 бета-сайта (BACE1), мембраносвязанная аспарагиновая протеаза 2, мемапсин-2, аспартил протеаза 2, и ASP2, является фермент что у людей кодируется BACE1 ген.[5] Экспрессия BACE1 наблюдается в основном в нейроны.
BACE1 - это протеаза аспарагиновой кислоты важен в формировании миелиновые оболочки в периферических нервных клетках: у мышей экспрессия BACE1 высока на постнатальных стадиях, когда миелинизация происходит.[6] В трансмембранный белок содержит два активных сайта аспартат остатки в его внеклеточный белковый домен и может функционировать как димер, его цитоплазматический хвост необходим для правильного созревания и эффективного внутриклеточного движения, но не влияет на активность. Выпускается как профермент, удаление эндопротеолитов происходит после выхода BACE Эндоплазматический ретикулум, в аппарат Гольджи. В дополнение пропептид получает дополнительные сахара для увеличения молекулярной массы.[7] и хвост стал пальмитоилированный.
На экспрессию BACE1 влияет воспалительное состояние: во время ОБЪЯВЛЕНИЕ то цитокины Уменьшить PPAR1 ингибитор мРНК ВАСЕ1).
Роль в болезни Альцгеймера

BACE1 - это основная бета-секретаза для поколения амилоид-β пептиды в нейронах.[8]
Поколение 40 или 42 аминокислота -длинная амилоид-β пептиды это совокупность в мозг пациентов с болезнью Альцгеймера требует двух последовательных расщеплений белок-предшественник амилоида (ПРИЛОЖЕНИЕ). Внеклеточное расщепление APP с помощью BACE1 создает растворимый внеклеточный фрагмент и связанный с клеточной мембраной фрагмент, обозначаемый как C99. Расщепление C99 в его трансмембранном домене посредством γ-секретаза высвобождает внутриклеточный домен АРР и продуцирует амилоид-β. С гамма-секретаза раскалывает приложение ближе к клеточная мембрана чем BACE1, он удаляет фрагмент пептида амилоид-β. Первоначальное расщепление APP α-секретазой, а не BACE1 предотвращает возможное образование амилоида-β, образуя P3, это показывает, что BACE1 и Альфа-секретаза конкурировать за обработку приложения.
В отличие от APP и пресенилин белки, важные для γ-секретазы, неизвестны мутации в ген кодирование BACE1 вызывает раннее начало, семейная болезнь Альцгеймера, что является редкой формой расстройства. Однако было показано, что уровень этого фермента повышен при гораздо более распространенной спорадической болезни Альцгеймера с поздним началом. BACE2 близко гомолог BACE1 без сообщения о расщеплении APP in vivo.
Физиологическая цель расщепления BACE APP и других трансмембранных белков неизвестна: некоторые исследования показали, что BACE1 участвует в миелинизация (он совпадает с нейрегулин 1 тип III). Аналогично обработке приложения VGSC субъединица бета является субстратом для BACE1.[9]
Однако мутация с одним остатком в APP снижает способность BACE1 расщеплять его с образованием бета-амилоида и снижает риск болезни Альцгеймера и других когнитивных нарушений.[10][11]
Ингибиторы BACE
Лекарства, блокирующие этот фермент (ингибиторы BACE), теоретически могут предотвратить накопление бета-амилоида и (согласно Амилоидная гипотеза ) может помочь замедлить или остановить болезнь Альцгеймера.[12]
При болезни Альцгеймера
Несколько компаний находятся на ранних стадиях разработки и тестирования этого потенциального класса лечения.[13][14] В марте 2008 года были опубликованы результаты первого этапа по кандидату CTS-21166 компании CoMentis Inc.[15]
В апреле 2012 г. Merck & Co., Inc сообщила о результатах фазы I своего кандидата вербецестат (МК-8931).[16] В декабре 2012 года компания Merck начала фазу II / III испытания MK-8931, которое, по оценкам, будет завершено в июле 2019 года.[17] В феврале 2017 года Merck остановила поздние испытания вербецестата для лечения болезни Альцгеймера легкой и средней степени тяжести после того, как, по мнению независимой группы экспертов, у него «практически нет шансов» работать. Это произошло всего через три месяца после того, как Eli Lilly & Co. объявила о своей неудаче с соланезумаб. Результаты исследования вербецестата на пациентах с ранней стадией болезни Альцгеймера, проведенного компанией Merck, ожидаются в феврале 2019 года.
В сентябре 2014 г. АстраЗенека и Эли Лилли и компания объявил о соглашении о разработке ланабецестат (AZD3293).[18] Основное клиническое исследование фазы II / III ланабецестата началось в конце 2014 г.[19] но был остановлен в 2018 году до запланированного завершения из-за плохих результатов.[20]
Еще один ингибитор BACE1, который прошел II фазу испытаний, - это ингибитор Eli Lilly’s LY2886721. Данные исследования фазы I были впервые представлены на конференции Alzheimer's Association International в 2012 году. Ежедневное дозирование в течение 2 недель снижало активность BACE1 на 50–75% и CSF Aβ42 на 72% (Willis et al., 2012; Bowman Rogers and Strobel , 2013). Недавно Лилли сообщил, что исследование фазы II LY2886721 было прекращено из-за аномалий печени, которые были обнаружены у 4 из 45 пациентов (Rogers, 2013). Эта токсичность, однако, не обязательно должна быть связана с рабочим механизмом ингибитора, но может отражать нецелевые эффекты, так как печень мышей с нокаутом BACE1 в норме.
Возможные побочные эффекты
Тесты на мышах показали, что протеазы BACE, в частности BACE1, необходимы для правильного функционирования мышечные веретена.[21] Эти результаты повышают вероятность того, что препараты, ингибирующие БАХЭ, которые в настоящее время исследуются для лечения болезни Альцгеймера, могут иметь значительные побочные эффекты, связанные с нарушением координации движений.[22] хотя BACE1 нокаутировать мыши здоровы.[23]
Отношение к плазмепсину
BACE1 отдаленно связан с патогенной протеазой аспарагиновой кислоты. плазмепсин, который является потенциальной мишенью для будущих противомалярийных препаратов.[24]
Рекомендации
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000186318 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000032086 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ «Ссылка на Mouse PubMed:». Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ Вассар Р., Беннетт Б.Д., Бабу-Хан С., Кан С., Мендиаз Э.А., Денис П., Теплов Д. Б., Росс С., Амаранте П., Лоелофф Р., Луо И., Фишер С., Фуллер Дж., Эденсон С., Лайл Дж., Яросински М.А., Биер А.Л., Карран Э., Берджесс Т., Луи Дж. К., Коллинз Ф., Тринор Дж., Роджерс Дж., Цитрон М. (октябрь 1999 г.). «Расщепление бета-секретазой белка-предшественника амилоида болезни Альцгеймера трансмембранной аспарагиновой протеазой ВАСЕ». Наука. 286 (5440): 735–41. Дои:10.1126 / science.286.5440.735. PMID 10531052.
- ^ Виллем М., Гарратт А.Н., Новак Б., Цитрон М., Кауфманн С., Риттгер А., ДеСтрупер Б., Сафтиг П., Бирчмайер С., Хаасс С. (октябрь 2006 г.). «Контроль миелинизации периферических нервов с помощью бета-секретазы BACE1». Наука. 314 (5799): 664–6. Bibcode:2006Научный ... 314..664W. Дои:10.1126 / наука.1132341. PMID 16990514. S2CID 8432207. Сложить резюме – Ученый.
- ^ Капелл, Аня; Штайнер, Харальд; Виллем, Майкл; Кайзер, Хартмут; Мейер, Кармен; Уолтер, Йохен; Ламмих, Свен; Мультхауп, Герд; Хаасс, Кристиан (2000-10-06). «Созревание и пропептидное расщепление β-секретазы». Журнал биологической химии. 275 (40): 30849–30854. Дои:10.1074 / jbc.M003202200. ISSN 0021-9258. PMID 10801872.
- ^ Цай, Хуайбинь; Ван, Яншу; Маккарти, Дайан; Вэнь, Хунцзинь; Борчелт, Дэвид Р .; Прайс, Дональд Л .; Вонг, Филип С. (март 2001 г.). «BACE1 является основной β-секретазой для генерации пептидов Aβ нейронами». Природа Неврологии. 4 (3): 233–234. Дои:10.1038/85064. ISSN 1546-1726. PMID 11224536. S2CID 11973104.
- ^ Ким, Ду Ён; Кэри, Брюс В .; Ван, Хайбинь; Ингано, Лаура А. М .; Биншток, Александр М .; Wertz, Mary H .; Петтингелл, Уоррен Х .; Он, Пинг; Ли, Вирджиния М.-Й .; Вульф, Клиффорд Дж .; Ковач, Дора М. (июль 2007 г.). «BACE1 регулирует потенциал-управляемые натриевые каналы и активность нейронов». Природа клеточной биологии. 9 (7): 755–764. Дои:10.1038 / ncb1602. ISSN 1465-7392. ЧВК 2747787. PMID 17576410.
- ^ «Ген борьбы с болезнью Альцгеймера может вдохновить на лечение». Июль 2012 г.
- ^ Йонссон Т., Атвал Дж. К., Стейнберг С., Снаедал Дж., Йонссон П. В., Бьорнссон С., Стефанссон Х., Сулем П., Гудбьяртссон Д., Малони Дж., Хойте К., Густафсон А., Лю Й, Лу Й, Бхангейл Т., Грэм Р. Р., Хаттенлохер Дж. , Bjornsdottir G, Andreassen OA, Jönsson EG, Palotie A, Behrens TW, Magnusson OT, Kong A, Thorsteinsdottir U, Watts RJ, Stefansson K (август 2012 г.). «Мутация в APP защищает от болезни Альцгеймера и возрастного снижения когнитивных функций». Природа. 488 (7409): 96–9. Bibcode:2012Натура.488 ... 96J. Дои:10.1038 / природа11283. PMID 22801501. S2CID 4333449.
- ^ Pradeepkiran, JA; Редди, AP; Инь, X; Манчак, М; Редди, PH (2020). «Защитные эффекты молекул-лигандов, ингибирующих BACE1, против амилоидных бета-индуцированных синаптических и митохондриальных токсикозов при болезни Альцгеймера». Молекулярная генетика человека. 29 (1): 49–69. Дои:10.1093 / hmg / ddz227. ЧВК 7001603. PMID 31595293.
- ^ Walker LC, Rosen RF (июль 2006 г.). «Терапия Альцгеймера - что после ингибиторов холинэстеразы?». Возраст и старение. 35 (4): 332–5. Дои:10.1093 / старение / afl009. PMID 16644763.
- ^ Бакстер Е.В., Конвей К.А., Кеннис Л., Бишофф Ф., Меркен М.Х., Винтер Х.Л., Рейнольдс СН, Тундж Б.А., Ло С., Скотт М.К., Хуанг Й., Брекен М., Питерс С.М., Бертело Д.Д., Мазер С., Брюнзил В.Д., Иордания А.Д. , Parker MH, Boyd RE, Qu J, Alexander RS, Brenneman DE, Reitz AB (сентябрь 2007 г.). «2-Амино-3,4-дигидрохиназолины в качестве ингибиторов BACE-1 (фермент, расщепляющий бета-сайт APP): использование конструкции на основе структуры для преобразования микромолярного удара в наномолярный отвод». Журнал медицинской химии. 50 (18): 4261–4. Дои:10.1021 / jm0705408. PMID 17685503.
- ^ «Дебют ингибитора БАСЕ CoMentis». Апрель 2008 г.
- ^ «Merck представляет результаты фазы I клинических испытаний по оценке исследуемого ингибитора BACE MK-8931 в Американской академии неврологии». Апрель 2012. Архивировано с оригинал на 2012-07-28.
- ^ «Merck инициирует фазу II / III исследования исследуемого ингибитора BACE, MK-8931, для лечения болезни Альцгеймера». Декабрь 2012 г.
- ^ «AstraZeneca и Lilly объявляют об альянсе по разработке и коммерциализации ингибитора BACE AZD3293 для лечения болезни Альцгеймера». 16 сен 2014. Получено 8 октября 2014.
- ^ «AstraZeneca и Lilly отправляют лекарство от болезни Альцгеймера на большой суд». Рейтер. Декабрь 2014 г.
- ^ «Обновленная информация о клинических испытаниях фазы III ланабецестата». 12 июн 2018. Получено 20 июн 2018.
- ^ Cheret, Сесил; Майкл Виллем; Флоренс Р. Фрикер; Хаген Венде (июнь 2013 г.). «Bace1 и Neuregulin-1 взаимодействуют, чтобы контролировать формирование и поддержание мышечных веретен». EMBO Журнал. 32 (14): 2015–28. Дои:10.1038 / emboj.2013.146. ЧВК 3715864. PMID 23792428.
- ^ Pettersson, A.F .; Olsson, E .; Валунд, Л.-О. (2005). «Моторная функция у субъектов с легкими когнитивными нарушениями и ранней болезнью Альцгеймера». Деменция и гериатрические когнитивные расстройства. 19 (5–6): 299–304. Дои:10.1159/000084555. ISSN 1420-8008. PMID 15785030. S2CID 36382718.
- ^ Робердс С.Л., Андерсон Дж., Баси Дж., Бьенковски М.Дж., Бранстеттер Д.Г., Чен К.С., Фридман С.Б., Фригон Н.Л., Игры D, Ху К., Джонсон-Вуд К., Каппенман К.Э., Кавабе Т.Т., Кола I, Куен Р., Ли М., Лю В., Моттер Р., Николс Н.Ф., Пауэр М., Робертсон Д.В., Шенк Д., Шур М., Шопп Г.М., Шак М.Э., Синха С., Свенссон К.А., Тацуно Г., Тинтруп Х, Вейсман Дж., Райт С., МакКонлог Л. (июнь 2001 г. ). «Мыши с нокаутом BACE здоровы, несмотря на отсутствие активности первичной бета-секретазы в мозге: значение для лечения болезни Альцгеймера». Молекулярная генетика человека. 10 (12): 1317–24. Дои:10.1093 / hmg / 10.12.1317. PMID 11406613.
- ^ Руссо И., Бэббит С., Муралидхаран В., Батлер Т., Оксман А., Голдберг Д.Е. (февраль 2010 г.). "Plasmepsin V лицензирует белки Plasmodium для экспорта в эритроциты хозяина". Природа. 463 (7281): 632–6. Bibcode:2010Натура.463..632R. Дои:10.1038 / природа08726. ЧВК 2826791. PMID 20130644. Сложить резюме – sciencedaily.com.
дальнейшее чтение
- Хун Л., Хэ Икс, Хуанг Х, Чанг В, Тан Дж (2005). «Структурные особенности человеческого мемапсина 2 (бета-секретаза) и их биологические и патологические последствия». Acta Biochimica et Biophysica Sinica. 36 (12): 787–92. Дои:10.1093 / abbs / 36.12.787. PMID 15592644.
- Джонстон Дж. А., Лю В. В., Тодд С. А., Колсон Д. Т., Мерфи С., Ирвин Дж. Б., Пассмор А. П. (2006). «Экспрессия и активность фермента, расщепляющего белок-предшественник амилоида бета-сайта при болезни Альцгеймера». Сделки Биохимического Общества. 33 (Pt 5): 1096–100. Дои:10.1042 / BST20051096. PMID 16246054. S2CID 44248549.
- Домингес Д.И., Хартманн Д., Де Строопер Б. (2006). «BACE1 и пресенилин: две необычные аспартилпротеазы, участвующие в болезни Альцгеймера». Нейродегенеративные заболевания. 1 (4–5): 168–74. Дои:10.1159/000080982. PMID 16908986.
- Заккетти Д., Кьерегатти Э., Беттегацци Б., Михайлович М., Соуза В.Л., Гроховаз Ф., Мелдолези Дж. (2007). «Экспрессия и активность BACE1: актуальность при болезни Альцгеймера». Нейродегенеративные заболевания. 4 (2–3): 117–26. Дои:10.1159/000101836. PMID 17596706. S2CID 32898359.
внешняя ссылка
- В МЕРОПЫ онлайн-база данных пептидаз и их ингибиторов: A01.004
- бета-секретаза: молекула месяца, Дэвид Гудселл, RCSB Protein Data Bank
- Человек BACE1 расположение генома и BACE1 страница сведений о генах в Браузер генома UCSC.
- Обзор всей структурной информации, доступной в PDB за UniProt: P56817 (Бета-секретаза 1 человека) на PDBe-KB.