Белок-предшественник амилоида - Amyloid precursor protein

Белок-предшественник амилоида (ПРИЛОЖЕНИЕ) является интегральный мембранный белок выражено во многих ткани и сосредоточен в синапсы из нейроны. Его основная функция неизвестна, хотя предполагается, что он является регулятором образования синапсов.[5] нейронная пластичность,[6] антимикробная активность,[7] и экспорт железа.[8] APP наиболее известен как молекула-предшественник, чья протеолиз генерирует амилоид бета (Aβ), полипептид, содержащий от 37 до 49 аминокислота остатки, чьи амилоид фибриллярный форма является основным компонентом амилоидные бляшки найдено в мозгах Болезнь Альцгеймера пациенты.
Генетика
APP - древний и очень консервированный белок.[9] В люди, то ген для приложения находится на хромосома 21 и содержит 18 экзоны охват 290 килобазы.[10][11] Несколько альтернативное сращивание изоформы АРР наблюдались у людей в диапазоне длины от 639 до 770 аминокислот, при этом некоторые изоформы предпочтительно экспрессировались в нейронах; изменения в соотношении нейронов этих изоформ были связаны с болезнью Альцгеймера.[12] Гомологичный белки были идентифицированы у других организмов, таких как Дрозофила (плодовые мошки), C. elegans (круглые черви),[13] и все млекопитающие.[14] Бета-амилоидная область белка, расположенная в трансмембранном домене, плохо сохраняется у разных видов и не имеет очевидной связи с АРР. родной биологические функции.[14]
Мутации в критических областях белка-предшественника амилоида, включая область, которая генерирует бета-амилоид (Aβ), вызывают семейную восприимчивость к болезни Альцгеймера.[15][16][17] Например, было обнаружено, что несколько мутаций за пределами области Aβ, связанных с семейной болезнью Альцгеймера, резко увеличивают продукцию Aβ.[18]
Мутация (A673T) в гене APP защищает от болезни Альцгеймера. Эта замена находится рядом с сайтом расщепления бета-секретазой и приводит к 40% снижению образования бета-амилоида in vitro.[19]
Структура


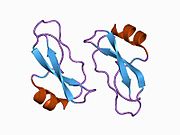
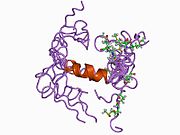
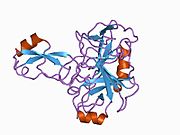
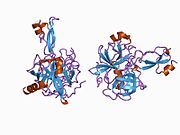
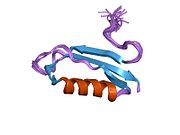
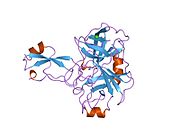
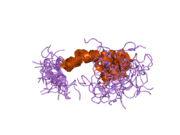
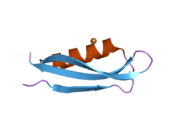
Ряд отдельных, в значительной степени независимоскладывание структурный домены были идентифицированы в последовательности APP. Внеклеточная область, намного больше, чем внутриклеточная область, делится на домены E1 и E2, связанные кислым доменом (AcD); E1 содержит два субдомена, включая домен, подобный фактору роста (GFLD) и медь -связывающий домен (CuBD) тесно взаимодействует между собой.[21] Домен ингибитора сериновой протеазы, отсутствующий в изоформе, дифференциально экспрессируемой в головном мозге, обнаружен между кислой областью и доменом E2.[22] Полная кристаллическая структура APP еще не решена; однако отдельные домены были успешно кристаллизованы, домен, подобный фактору роста,[23] то медь -связывающий домен,[24] полный домен E1[21] и домен E2.[20]
Посттрансляционная обработка
APP проходит обширную посттрансляционная модификация включая гликозилирование, фосфорилирование, сиалирование, и сульфатирование тирозина, а также многие виды протеолитический обработка для создания пептидных фрагментов.[25] Обычно он раскалывается протеазы в секрета семья; альфа-секретаза и бета-секретаза оба удаляют почти весь внеклеточный домен, чтобы высвободить закрепленный на мембране карбокси-концевой фрагменты, которые могут быть связаны с апоптоз.[14] Расщепление на гамма-секретаза внутри трансмембранного домена после расщепления бета-секретазой образуется фрагмент бета-амилоида; гамма-секретаза представляет собой большой комплекс из нескольких субъединиц, компоненты которого еще не полностью охарактеризованы, но включают пресенилин, ген которого был идентифицирован как главный генетический фактор риска болезни Альцгеймера.[26]
Амилоидогенный процессинг АРР связан с его присутствием в липидные рафты. Когда молекулы АРР занимают область липидного рафта мембраны, они более доступны и дифференцированно расщепляются бета-секретазой, тогда как молекулы АРР вне рафта дифференцированно расщепляются неамилоидогенной альфа-секретазой.[27] Гамма-секретазная активность также связана с липидными рафтами.[28] Роль холестерин в поддержании липидного рафта, как вероятное объяснение наблюдений, что высокий холестерин и аполипопротеин E генотип являются основными факторами риска болезни Альцгеймера.[29]
Биологическая функция
Хотя природная биологическая роль APP представляет очевидный интерес для исследований болезни Альцгеймера, полное понимание остается труднодостижимым.
Синаптическое образование и восстановление
Наиболее обоснованная роль APP заключается в формировании и восстановлении синапсов;[5] это выражение является усиленный во время нейронального дифференциация и после нервной травмы. Роли в клеточная сигнализация, долгосрочное потенцирование, и клеточная адгезия были предложены и поддержаны пока еще ограниченными исследованиями.[14] В частности, сходство в посттрансляционной обработке потребовало сравнений с сигнальной ролью поверхности. рецептор белок Notch.[30]
ПРИЛОЖЕНИЕ нокаутные мыши жизнеспособны и имеют относительно незначительные фенотипический эффекты, включая нарушение долговременной потенциации и потерю памяти без общей потери нейронов.[31] С другой стороны, сообщалось, что трансгенные мыши с повышенной экспрессией АРР демонстрируют ослабленную долгосрочную потенциацию.[32]
Логический вывод состоит в том, что, поскольку Aβ чрезмерно накапливается при болезни Альцгеймера, его предшественник, APP, также будет повышен. Однако тела нейрональных клеток содержат меньше АРР в зависимости от их близости к амилоидным бляшкам.[33] Данные показывают, что этот дефицит АРР является результатом снижения производства, а не увеличения катализа. Потеря APP нейрона может повлиять на физиологический дефицит, который способствует деменции.
Соматическая рекомбинация
В нейронах человека мозг, соматическая рекомбинация часто встречается в гене, кодирующем APP.[34] Нейроны от лиц со спорадическими Болезнь Альцгеймера показать больше ПРИЛОЖЕНИЕ разнообразие генов из-за соматической рекомбинации, чем нейроны здоровых людей.[34]
Антероградный нейрональный транспорт
Молекулы, синтезированные в телах клеток нейронов, должны транспортироваться наружу в дистальные синапсы. Это достигается через быстрый антероградный транспорт. Было обнаружено, что APP может посредничать между грузом и кинезин и таким образом облегчить эту транспортировку. В частности, короткая пептидная 15-аминокислотная последовательность от карбокси-конца цитоплазмы необходима для взаимодействия с моторным белком.[35]
Кроме того, было показано, что взаимодействие между АРР и кинезином специфично для пептидной последовательности АРР.[36] В недавнем эксперименте по транспортировке конъюгированных с пептидами окрашенных бусы, контроли конъюгировали с одной аминокислотой, глицин, так что они отображают ту же концевую группу карбоновой кислоты, что и АРР, без промежуточной 15-аминокислотной последовательности, упомянутой выше. Контрольные шарики неподвижны, что свидетельствует о том, что концевые COOH фрагмента пептидов недостаточно, чтобы опосредовать транспорт.
Экспорт железа
Другой взгляд на болезнь Альцгеймера показал исследование на мышах, которое показало, что APP обладает ферроксидаза деятельность, похожая на церулоплазмин, облегчая экспорт железа через взаимодействие с ферропортин; кажется, что эта активность блокируется цинком, захваченным накопленным Aβ при болезни Альцгеймера.[8] Было показано, что однонуклеотидный полиморфизм в 5'UTR приложения мРНК может нарушить его перевод.[37]
Гипотеза о том, что APP обладает ферроксидазной активностью в своем домене E2 и способствует экспорту Fe (II), возможно, неверна, поскольку предполагаемый ферроксидазный сайт APP, расположенный в домене E2, не обладает ферроксидазной активностью.[38][39]
Поскольку АРР не обладает ферроксидазной активностью в своем домене Е2, механизм оттока железа из ферропортина, модулируемого АРР, подвергся тщательному изучению. Одна модель предполагает, что APP действует, стабилизируя отток железа ферропортин в плазматическую мембрану клеток, тем самым увеличивая общее количество молекул ферропортина на мембране. Эти переносчики железа затем могут быть активированы известными ферроксидазами млекопитающих (т.е. церулоплазмином или гефестином).[40]
Гормональная регуляция
Белок-предшественник амилоида-β (AβPP) и все связанные секретазы экспрессируются на ранних стадиях развития и играют ключевую роль в развитии эндокринология репродукции - при дифференциальном процессинге AβPP секретазами, регулирующими эмбриональные стволовые клетки человека (hESC) распространение а также их дифференциация в нервные клетки-предшественники (NPC). Гормон беременности хорионический гонадотропин человека (ХГЧ) увеличивает экспрессию AβPP[41] и распространение hESC, в то время как прогестерон направляет процессинг AβPP в неамилоидогенный путь, который способствует дифференцировке hESC в NPC.[42][43][44]
AβPP и его расщепление продукты не способствуют пролиферации и дифференцировке постмитотических нейронов; скорее, избыточная экспрессия AβPP дикого типа или мутантного AβPP в постмитотических нейронах вызывает апоптотическую гибель после их повторного входа в клеточный цикл.[45] Предполагается, что потеря половых стероидов (включая прогестерон), но повышение лютеинизирующий гормон, эквивалент ХГЧ для взрослых, послеменопауза и во время андропауза стимулирует производство амилоида-β[46] и повторный вход постмитотических нейронов в клеточный цикл.
Взаимодействия
Было показано, что белок-предшественник амилоида взаимодействовать с:
APP взаимодействует с катушка, белок, вовлеченный в ряд заболеваний головного мозга, включая болезнь Альцгеймера.[67]
Рекомендации
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000142192 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000022892 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ а б Приллер С., Бауэр Т., Миттереггер Г., Кребс Б., Кречмар Х.А., Хермс Дж. (Июль 2006 г.). «Образование и функция синапсов регулируется белком-предшественником амилоида». Журнал неврологии. 26 (27): 7212–21. Дои:10.1523 / JNEUROSCI.1450-06.2006. ЧВК 6673945. PMID 16822978.
- ^ Тернер PR, О'Коннор К., Тейт WP, Абрахам WC (май 2003 г.). «Роли белка-предшественника амилоида и его фрагментов в регуляции нервной активности, пластичности и памяти». Прогресс в нейробиологии. 70 (1): 1–32. Дои:10.1016 / S0301-0082 (03) 00089-3. PMID 12927332. S2CID 25376584.
- ^ Моир Р.Д., Токарный Р., Танзи Р.Э. (2018). «Гипотеза противомикробной защиты болезни Альцгеймера». Болезнь Альцгеймера и деменция. 14 (12): 1602–1614. Дои:10.1016 / j.jalz.2018.06.3040. PMID 30314800.
- ^ а б Duce JA, Tsatsanis A, Cater MA, James SA, Robb E, Wikhe K, Leong SL, Perez K, Johanssen T, Greenough MA, Cho HH, Galatis D, Moir RD, Masters CL, McLean C, Tanzi RE, Cappai R , Барнхем К.Дж., Чиккото Г.Д., Роджерс Дж.Т., Буш А.И. (сентябрь 2010 г.). «Железо-экспортная ферроксидазная активность белка-предшественника β-амилоида ингибируется цинком при болезни Альцгеймера». Клетка. 142 (6): 857–67. Дои:10.1016 / j.cell.2010.08.014. ЧВК 2943017. PMID 20817278.
- ^ Тарп РГ, Саркар И.Н. (апрель 2013 г.). «Происхождение амилоида-β». BMC Genomics. 14 (1): 290. Дои:10.1186/1471-2164-14-290. ЧВК 3660159. PMID 23627794.
- ^ Йошикай С., Сасаки Х., Дох-ура К., Фуруя Х., Сакаки Й. (март 1990 г.). «Геномная организация гена-предшественника бета-белка амилоида человека». Ген. 87 (2): 257–63. Дои:10.1016 / 0378-1119 (90) 90310-Н. PMID 2110105.
- ^ Lamb BT, Sisodia SS, Lawler AM, Slunt HH, Kitt CA, Kearns WG, Pearson PL, Price DL, Gearhart JD (сентябрь 1993 г.). «Введение и экспрессия гена белка-предшественника амилоида 400 килобаз у трансгенных мышей [исправлено]». Природа Генетика. 5 (1): 22–30. Дои:10.1038 / ng0993-22. PMID 8220418. S2CID 42752531.
- ^ Мацуи Т., Ингельссон М., Фукумото Х., Рамасами К., Кова Х., Фрош М.П., Иризарри М.С., Хайман Б.Т. (август 2007 г.). «Экспрессия мРНК и белков пути АРР при болезни Альцгеймера». Исследование мозга. 1161: 116–23. Дои:10.1016 / j.brainres.2007.05.050. PMID 17586478. S2CID 26901380.
- ^ Ewald, Collin Y .; Ли, Крис (2012-04-01). «Caenorhabditis elegans как модельный организм для изучения функции APP». Экспериментальное исследование мозга. 217 (3–4): 397–411. Дои:10.1007 / s00221-011-2905-7. ISSN 0014-4819. ЧВК 3746071. PMID 22038715.
- ^ а б c d Чжэн Х, Ку Э. (2006). «Белок-предшественник амилоида: помимо амилоида». Молекулярная нейродегенерация. 1 (1): 5. Дои:10.1186/1750-1326-1-5. ЧВК 1538601. PMID 16930452.
- ^ Goate A, Chartier-Harlin MC, Mullan M, Brown J, Crawford F, Fidani L, Giuffra L, Haynes A, Irving N, James L. (февраль 1991 г.). «Разделение миссенс-мутации в гене белка-предшественника амилоида с семейной болезнью Альцгеймера». Природа. 349 (6311): 704–6. Bibcode:1991Натура.349..704Г. Дои:10.1038 / 349704a0. PMID 1671712. S2CID 4336069.
- ^ Мюррелл Дж., Фарлоу М., Гетти Б., Бенсон, Мэриленд (октябрь 1991 г.). «Мутация в белке-предшественнике амилоида, связанная с наследственной болезнью Альцгеймера». Наука. 254 (5028): 97–9. Bibcode:1991Наука ... 254 ... 97М. Дои:10.1126 / наука.1925564. PMID 1925564.
- ^ Chartier-Harlin MC, Crawford F, Houlden H, Warren A., Hughes D, Fidani L, Goate A, Rossor M, Roques P, Hardy J (октябрь 1991 г.). «Болезнь Альцгеймера с ранним началом, вызванная мутациями в кодоне 717 гена белка-предшественника бета-амилоида». Природа. 353 (6347): 844–6. Bibcode:1991Натура.353..844C. Дои:10.1038 / 353844a0. PMID 1944558. S2CID 4345311.
- ^ Цитрон М., Олтерсдорф Т., Хаасс К., МакКонлог Л., Хунг А.Ю., Зойберт П., Виго-Пелфри С., Либербург И., Селкое Д.Д. (декабрь 1992 г.). «Мутация белка-предшественника бета-амилоида при семейной болезни Альцгеймера увеличивает производство бета-белка». Природа. 360 (6405): 672–4. Bibcode:1992Натура. 360..672C. Дои:10.1038 / 360672a0. PMID 1465129. S2CID 4341170.
- ^ Йонссон Т., Атвал Дж. К., Стейнберг С., Снаедал Дж., Йонссон П. В., Бьорнссон С., Стефанссон Х., Сулем П., Гудбьяртссон Д., Малони Дж., Хойте К., Густафсон А., Лю Й, Лу Й, Бхангейл Т., Грэм Р. Р., Хаттенлохер Дж. , Bjornsdottir G, Andreassen OA, Jönsson EG, Palotie A, Behrens TW, Magnusson OT, Kong A, Thorsteinsdottir U, Watts RJ, Stefansson K (август 2012 г.). «Мутация в APP защищает от болезни Альцгеймера и возрастного снижения когнитивных функций». Природа. 488 (7409): 96–9. Bibcode:2012Натура.488 ... 96J. Дои:10.1038 / природа11283. PMID 22801501. S2CID 4333449. Сложить резюме – Нью-Йорк Таймс.
- ^ а б PDB: 1RW6; Ван И, Ха И (август 2004 г.). «Рентгеновская структура антипараллельного димера человеческого домена E2 белка-предшественника амилоида». Молекулярная клетка. 15 (3): 343–53. Дои:10.1016 / j.molcel.2004.06.037. PMID 15304215.
- ^ а б Dahms SO, Hoefgen S, Roeser D, Schlott B, Gührs KH, Than ME (март 2010 г.). «Структура и биохимический анализ гепарин-индуцированного димера E1 белка-предшественника амилоида». Труды Национальной академии наук Соединенных Штатов Америки. 107 (12): 5381–6. Bibcode:2010PNAS..107.5381D. Дои:10.1073 / pnas.0911326107. ЧВК 2851805. PMID 20212142.; см. также PDB ID 3KTM
- ^ Sisodia SS, Koo EH, Hoffman PN, Perry G, Price DL (июль 1993 г.). «Идентификация и транспорт полноразмерных белков-предшественников амилоида в периферической нервной системе крыс». Журнал неврологии. 13 (7): 3136–42. Дои:10.1523 / JNEUROSCI.13-07-03136.1993. ЧВК 6576678. PMID 8331390.
- ^ Россджон Дж, Каппай Р., Фейл С.К., Генри А., МакКинстри В.Дж., Галатис Д., Гессе Л., Мультхауп Дж., Бейройтер К., Мастерс С.Л., Паркер М.В. (апрель 1999 г.). «Кристаллическая структура N-концевого, подобного фактору роста домена белка-предшественника амилоида болезни Альцгеймера». Структурная биология природы. 6 (4): 327–31. Дои:10.1038/7562. PMID 10201399. S2CID 30925432.; см. также PDB ID 1MWP
- ^ Конг Г.К., Адамс Дж. Дж., Харрис Х. Х., Боас Дж. Ф., Кертейн С. К., Галатис Д., Мастерс С. Л., Барнхэм К. Дж., МакКинстри В. Дж., Каппаи Р., Паркер М. В. (март 2007 г.). «Структурные исследования медьсвязывающего домена белка-предшественника амилоида болезни Альцгеймера показывают, как он связывает ионы меди». Журнал молекулярной биологии. 367 (1): 148–61. Дои:10.1016 / j.jmb.2006.12.041. PMID 17239395.; См. Также идентификаторы PDB 2007 г. 2FJZ, 2FK2, 2ФКЛ.
- ^ Де Струпер Б., Аннаерт В. (июнь 2000 г.). «Протеолитический процессинг и клеточные биологические функции белка-предшественника амилоида». Журнал клеточной науки. 113 (11): 1857–70. PMID 10806097.
- ^ Chen F, Hasegawa H, Schmitt-Ulms G, Kawarai T, Bohm C, Katayama T, Gu Y, Sanjo N, Glista M, Rogaeva E, Wakutani Y, Pardossi-Piquard R, Ruan X, Tandon A, Checler F, Marambaud П., Хансен К., Вестэвей Д., Сент-Джордж-Хислоп П., Фрейзер П. (апрель 2006 г.). «TMP21 представляет собой компонент комплекса пресенилина, который модулирует активность гамма-секретазы, но не активность эпсилон-секретазы». Природа. 440 (7088): 1208–12. Дои:10.1038 / природа04667. PMID 16641999. S2CID 4349251.
- ^ Эхехальт Р., Келлер П., Хаасс К., Тиле С., Саймонс К. (январь 2003 г.). «Амилоидогенный процессинг белка-предшественника бета-амилоида болезни Альцгеймера зависит от липидных рафтов». Журнал клеточной биологии. 160 (1): 113–23. Дои:10.1083 / jcb.200207113. ЧВК 2172747. PMID 12515826.
- ^ Ветривел К.С., Ченг Х., Лин В., Сакураи Т., Ли Т., Нукина Н., Вонг П.С., Сю Х., Тинакаран Дж. (Октябрь 2004 г.). «Ассоциация гамма-секретазы с липидными рафтами в пост-Гольджи и эндосомных мембранах». Журнал биологической химии. 279 (43): 44945–54. Дои:10.1074 / jbc.M407986200. ЧВК 1201506. PMID 15322084.
- ^ Ридделл Д.Р., Кристи Дж., Хусейн I, Дингуолл С. (август 2001 г.). «Компартментализация бета-секретазы (Asp2) в некавеолярные липидные рафты с низкой плавучестью». Текущая биология. 11 (16): 1288–93. Дои:10.1016 / S0960-9822 (01) 00394-3. PMID 11525745. S2CID 15502857.
- ^ Селькое Д., Копан Р. (2003). «Notch и пресенилин: регулируемый внутримембранный протеолиз связывает развитие и дегенерацию». Ежегодный обзор нейробиологии. 26 (1): 565–97. Дои:10.1146 / annurev.neuro.26.041002.131334. PMID 12730322.
- ^ Финни А.Л., Калхун М.Э., Вулфер Д.П., Липп Х.П., Чжэн Х., Джакер М (1999). «Отсутствие потери нейронов гиппокампа или синаптических бутонов у пожилых мышей, лишенных белка-предшественника бета-амилоида с нарушением обучения». Неврология. 90 (4): 1207–16. Дои:10.1016 / S0306-4522 (98) 00645-9. PMID 10338291. S2CID 6001957.
- ^ Мацуяма С., Тераока Р., Мори Х., Томияма Т. (2007). «Обратная корреляция между белком-предшественником амилоида и синаптической пластичностью у трансгенных мышей». NeuroReport. 18 (10): 1083–7. Дои:10.1097 / WNR.0b013e3281e72b18. PMID 17558301. S2CID 34157306.
- ^ Баргер С.В., ДеУолл К.М., Лю Л., Мрак Р.Э., Гриффин В.С. (август 2008 г.). «Отношения между экспрессией аполипопротеина E и белка-предшественника бета-амилоида изменяются в непосредственной близости от бета-амилоидных бляшек болезни Альцгеймера: возможные объяснения из исследований клеточных культур». Журнал невропатологии и экспериментальной неврологии. 67 (8): 773–83. Дои:10.1097 / NEN.0b013e318180ec47. ЧВК 3334532. PMID 18648325.
- ^ а б Ли М.Х., Сиддоуэй Б., Кэзер Дж. Э., Сегота I, Ривера Р., Романоу В.Дж., Лю С.С., Пак С., Кеннеди Дж., Лонг Т., Чун Дж. (Ноябрь 2018 г.). «Соматическая рекомбинация гена APP при болезни Альцгеймера и нормальных нейронах». Природа. 563 (7733): 639–645. Bibcode:2018Натура.563..639L. Дои:10.1038 / s41586-018-0718-6. ЧВК 6391999. PMID 30464338.
- ^ Сатпуте-Кришнан П., ДеГиоргис Дж. А., Конли М. П., Джанг М., Носитель Е. Л. (октябрь 2006 г.). «Зип-код пептида, достаточный для антероградного транспорта в белке-предшественнике амилоида». Труды Национальной академии наук Соединенных Штатов Америки. 103 (44): 16532–7. Bibcode:2006ПНАС..10316532С. Дои:10.1073 / pnas.0607527103. ЧВК 1621108. PMID 17062754.
- ^ Seamster PE, Loewenberg M, Pascal J, Chauviere A, Gonzales A, Cristini V, Bearer EL (октябрь 2012 г.). «Количественные измерения и моделирование грузомоторных взаимодействий во время быстрой транспортировки в живом аксоне». Физическая биология. 9 (5): 055005. Bibcode:2012ФБио ... 9e5005S. Дои:10.1088/1478-3975/9/5/055005. ЧВК 3625656. PMID 23011729.
- ^ Роджерс Дж.Т., Буш А.И., Чо Х.Х., Смит Д.Х., Томсон А.М., Фридлих А.Л., Лахири Д.К., Лидман П.Дж., Хуанг Х, Кэхилл С.М. (декабрь 2008 г.). «Железо и трансляция белка-предшественника амилоида (APP) и мРНК ферритина: риборегуляция против окислительного повреждения нервной системы при болезни Альцгеймера». Сделки Биохимического Общества. 36 (Pt 6): 1282–7. Дои:10.1042 / BST0361282. ЧВК 2746665. PMID 19021541.
- ^ Эбрахими К.Х., Хагедорн П.Л., Хаген В.Р. (2012). «Синтетический пептид с предполагаемым железосвязывающим мотивом белка-предшественника амилоида (АРР) не каталитически окисляет железо». PLOS ONE. 7 (8): e40287. Bibcode:2012PLoSO ... 740287E. Дои:10.1371 / journal.pone.0040287. ЧВК 3419245. PMID 22916096.
- ^ Хонарманд Эбрахими К., Динеманн С., Хефген С., Тан М.Э., Хагедорн П.Л., Хаген В.Р. (2013). «Белок-предшественник амилоида (APP) не имеет сайта ферроксидазы в его домене E2». PLOS ONE. 8 (8): e72177. Bibcode:2013PLoSO ... 872177H. Дои:10.1371 / journal.pone.0072177. ЧВК 3747053. PMID 23977245.
- ^ McCarthy RC, Park YH, Kosman DJ (июль 2014 г.). «sAPP модулирует отток железа из эндотелиальных клеток микрососудов головного мозга, стабилизируя ферропортин, экспортирующий двухвалентное железо». EMBO отчеты. 15 (7): 809–15. Дои:10.15252 / наб.201338064. ЧВК 4196985. PMID 24867889.
- ^ Porayette P, Gallego MJ, Kaltcheva MM, Meethal SV, Atwood CS (декабрь 2007 г.). «Экспрессия и модуляция белка-предшественника амилоида-бета в человеческих эмбриональных стволовых клетках: новая роль хорионического гонадотропина человека». Сообщения о биохимических и биофизических исследованиях. 364 (3): 522–7. Дои:10.1016 / j.bbrc.2007.10.021. PMID 17959150.
- ^ Porayette P, Gallego MJ, Kaltcheva MM, Bowen RL, Vadakkadath Meethal S, Atwood CS (август 2009 г.). «Дифференциальный процессинг белка-предшественника бета-амилоида направляет пролиферацию и дифференцировку эмбриональных стволовых клеток человека в клетки-предшественники нейронов». Журнал биологической химии. 284 (35): 23806–17. Дои:10.1074 / jbc.M109.026328. ЧВК 2749153. PMID 19542221.
- ^ Галлего MJ, Porayette P, Kaltcheva MM, Meethal SV, Atwood CS (июнь 2009 г.). «Передача сигналов опиоидов и прогестерона является обязательной для раннего эмбриогенеза человека». Стволовые клетки и развитие. 18 (5): 737–40. Дои:10.1089 / scd.2008.0190. ЧВК 2891507. PMID 18803462.
- ^ Галлего MJ, Porayette P, Kaltcheva MM, Bowen RL, Vadakkadath Meethal S, Atwood CS (2010). «Гормоны беременности, хорионический гонадотропин человека и прогестерон, вызывают пролиферацию и дифференциацию эмбриональных стволовых клеток человека в нейроэктодермальные розетки». Исследование стволовых клеток и терапия. 1 (4): 28. Дои:10.1186 / scrt28. ЧВК 2983441. PMID 20836886.
- ^ Макфи Д.Л., Куперсмит Р., Хайнс-Перальта А., Чен Ю., Айвинс К.Дж., Мэнли С.П., Козловски М.Р., Неве К.А., Неве Р.Л. (июль 2003 г.). «Синтез ДНК и апоптоз нейронов, вызванные семейными мутантами по болезни Альцгеймера белка-предшественника амилоида, опосредуются активированной p21 киназой PAK3». Журнал неврологии. 23 (17): 6914–27. Дои:10.1523 / JNEUROSCI.23-17-06914.2003. ЧВК 6740729. PMID 12890786.
- ^ Боуэн Р.Л., Вердайл Дж., Лю Т., Парлоу А.Ф., Перри Дж., Смит М.А., Мартинс Р.Н., Этвуд С.С. (май 2004 г.). «Лютеинизирующий гормон, репродуктивный регулятор, который модулирует процессинг белка-предшественника бета-амилоида и отложение бета-амилоида». Журнал биологической химии. 279 (19): 20539–45. Дои:10.1074 / jbc.M311993200. PMID 14871891.
- ^ а б c Бидерер Т., Цао Х, Зюдхоф ТК, Лю Х (сентябрь 2002 г.). «Регулирование APP-зависимых транскрипционных комплексов с помощью Mint / X11s: дифференциальные функции изоформ Mint». Журнал неврологии. 22 (17): 7340–51. Дои:10.1523 / JNEUROSCI.22-17-07340.2002. ЧВК 6757996. PMID 12196555.
- ^ а б Борг Дж. П., Оои Дж., Леви Е., Марголис Б. (ноябрь 1996 г.). «Домены взаимодействия фосфотирозина X11 и FE65 связываются с различными сайтами на мотиве YENPTY белка-предшественника амилоида». Молекулярная и клеточная биология. 16 (11): 6229–41. Дои:10.1128 / mcb.16.11.6229. ЧВК 231626. PMID 8887653.
- ^ а б Араки Ю., Томита С., Ямагути Н., Мияги Н., Сумиока А., Кирино Ю., Сузуки Т. (декабрь 2003 г.). «Новые связанные с кадгерином мембранные белки, алькадеины, усиливают опосредованную X11-подобным белком стабилизацию метаболизма предшественников бета-амилоидных белков». Журнал биологической химии. 278 (49): 49448–58. Дои:10.1074 / jbc.M306024200. PMID 12972431.
- ^ Томита С., Одзаки Т., Тару Х., Огучи С., Такеда С., Яги Ю., Сакияма С., Кирино Ю., Сузуки Т. (январь 1999 г.). «Взаимодействие нейрон-специфического белка, содержащего PDZ-домены, с белком-предшественником амилоида Альцгеймера». Журнал биологической химии. 274 (4): 2243–54. Дои:10.1074 / jbc.274.4.2243. PMID 9890987.
- ^ Танахаши Х., Табира Т. (февраль 1999 г.). «X11L2, новый член семейства белков X11, взаимодействует с белком-предшественником бета-амилоида Альцгеймера». Сообщения о биохимических и биофизических исследованиях. 255 (3): 663–7. Дои:10.1006 / bbrc.1999.0265. PMID 10049767.
- ^ Замбрано Н., Буксбаум Дж. Д., Минополи Дж., Фиоре Ф., Де Кандиа П., Де Рензис С., Фараонио Р., Сабо С., Читам Дж., Судол М., Руссо Т. (март 1997 г.). «Взаимодействие фосфотирозинового взаимодействия / фосфотирозинсвязывающих доменов Fe65 с белками-предшественниками бета-амилоида Альцгеймера дикого типа и мутантными белками Альцгеймера». Журнал биологической химии. 272 (10): 6399–405. Дои:10.1074 / jbc.272.10.6399. PMID 9045663.
- ^ Генетт С.Ю., Чен Дж., Джондро П.Д., Танзи Р.Э. (октябрь 1996 г.). «Ассоциация нового человеческого FE65-подобного белка с цитоплазматическим доменом белка-предшественника бета-амилоида». Труды Национальной академии наук Соединенных Штатов Америки. 93 (20): 10832–7. Bibcode:1996PNAS ... 9310832G. Дои:10.1073 / pnas.93.20.10832. ЧВК 38241. PMID 8855266.
- ^ Танахаши Х., Табира Т. (февраль 1999 г.). «Молекулярное клонирование человеческого Fe65L2 и его взаимодействие с белком-предшественником бета-амилоида Альцгеймера». Письма о неврологии. 261 (3): 143–6. Дои:10.1016 / S0304-3940 (98) 00995-1. PMID 10081969. S2CID 54307954.
- ^ Троммсдорф М., Борг Дж. П., Марголис Б., Херц Дж. (Декабрь 1998 г.). «Взаимодействие цитозольных адаптерных белков с нейрональными рецепторами аполипопротеина Е и белком-предшественником амилоида». Журнал биологической химии. 273 (50): 33556–60. Дои:10.1074 / jbc.273.50.33556. PMID 9837937.
- ^ Чоу Н., Коренберг-младший, Чен XN, Неве Р.Л. (май 1996 г.). «APP-BP1, новый белок, который связывается с карбоксильным концом белка-предшественника амилоида». Журнал биологической химии. 271 (19): 11339–46. Дои:10.1074 / jbc.271.19.11339. PMID 8626687.
- ^ Чжэн П., Истман Дж., Ванде Поль С., Pimplikar SW (декабрь 1998 г.). «PAT1, белок, взаимодействующий с микротрубочками, распознает базолатеральный сигнал сортировки белка-предшественника амилоида». Труды Национальной академии наук Соединенных Штатов Америки. 95 (25): 14745–50. Bibcode:1998PNAS ... 9514745Z. Дои:10.1073 / пнас.95.25.14745. ЧВК 24520. PMID 9843960.
- ^ Ван Б., Нгуен М., Брекенридж Д. Г., Стоянович М., Клемонс П. А., Куппиг С., Шор ГК (апрель 2003 г.). «Нерасщепленный BAP31 в ассоциации с белком A4 в эндоплазматическом ретикулуме является ингибитором Fas-инициированного высвобождения цитохрома c из митохондрий». Журнал биологической химии. 278 (16): 14461–8. Дои:10.1074 / jbc.M209684200. PMID 12529377.
- ^ Лефтеров И.М., Колдамова Р.П., Лазо Ю.С. (сентябрь 2000 г.). «Блеомицин гидролаза человека регулирует секрецию белка-предшественника амилоида». Журнал FASEB. 14 (12): 1837–47. Дои:10.1096 / fj.99-0938com. PMID 10973933. S2CID 44302063.
- ^ Араки Й., Мияги Н., Като Н., Йошида Т., Вада С., Нисимура М., Комано Х., Ямамото Т., Де Строопер Б., Ямамото К., Судзуки Т. (июнь 2004 г.). «Скоординированный метаболизм алькадеина и предшественника бета-белка амилоида регулирует трансактивацию генов, зависимую от FE65». Журнал биологической химии. 279 (23): 24343–54. Дои:10.1074 / jbc.M401925200. PMID 15037614.
- ^ Икезу Т., Трапп Б.Д., Сонг К.С., Шлегель А., Лисанти М.П., Окамото Т. (апрель 1998 г.). «Кавеолы, микродомены плазматической мембраны для опосредованного альфа-секретазой процессинга белка-предшественника амилоида». Журнал биологической химии. 273 (17): 10485–95. Дои:10.1074 / jbc.273.17.10485. PMID 9553108.
- ^ Хашимото Т., Вакабаяси Т., Ватанабе А., Кова Х., Хосода Р., Накамура А., Канадзава И., Араи Т., Такио К., Манн Д.М., Ивацубо Т. (апрель 2002 г.). «CLAC: новый компонент амилоидной бляшки Альцгеймера, полученный из трансмембранного предшественника, CLAC-P / коллаген типа XXV». Журнал EMBO. 21 (7): 1524–34. Дои:10.1093 / emboj / 21.7.1524. ЧВК 125364. PMID 11927537.
- ^ Осава И., Такамура С., Косака С. (март 2001 г.). «Фибулин-1 связывает амино-концевую головку белка-предшественника бета-амилоида и модулирует его физиологическую функцию». Журнал нейрохимии. 76 (5): 1411–20. Дои:10.1046 / j.1471-4159.2001.00144.x. PMID 11238726. S2CID 83321033.
- ^ Чаухан В.П., Луч I, Чаухан А., Вишневски Х.М. (май 1999 г.). «Связывание гельсолина, секреторного белка, с бета-белком амилоида». Сообщения о биохимических и биофизических исследованиях. 258 (2): 241–6. Дои:10.1006 / bbrc.1999.0623. PMID 10329371.
- ^ Ян С.Д., Фу Дж., Сото К., Чен Х, Чжу Х., Аль-Моханна Ф., Коллисон К., Чжу А., Стерн Э., Сайдо Т., Тохьяма М., Огава С., Рохер А., Стерн Д. (октябрь 1997 г.). «Внутриклеточный белок, который связывает пептид бета-амилоида и опосредует нейротоксичность при болезни Альцгеймера». Природа. 389 (6652): 689–95. Bibcode:1997Натура.389..689D. Дои:10.1038/39522. PMID 9338779. S2CID 4343238.
- ^ Tarr PE, Roncarati R, Pelicci G, Pelicci PG, D'Adamio L (май 2002 г.). «Фосфорилирование тирозина цитоплазматического хвоста белка-предшественника бета-амилоида способствует взаимодействию с Shc». Журнал биологической химии. 277 (19): 16798–804. Дои:10.1074 / jbc.M110286200. PMID 11877420.
- ^ Hoe HS, Lee KJ, Carney RS, Lee J, Markova A, Lee JY, Howell BW, Hyman BT, Pak DT, Bu G, Rebeck GW (июнь 2009 г.). «Взаимодействие рилина с белком-предшественником амилоида способствует росту нейритов». Журнал неврологии. 29 (23): 7459–73. Дои:10.1523 / JNEUROSCI.4872-08.2009. ЧВК 2759694. PMID 19515914. Сложить резюме – Форум исследований болезни Альцгеймера.
дальнейшее чтение
- Бейройтер К., Поллвейн П., Мультхауп Дж., Мённинг У., Кёниг Дж., Диркс Т., Шуберт В., Мастерс CL (сентябрь 1993 г.). «Регулирование и экспрессия предшественника бета / A4 амилоидного белка Альцгеймера в здоровье, болезни и синдроме Дауна». Летопись Нью-Йоркской академии наук. 695 (1 трансдукция): 91–102. Дои:10.1111 / j.1749-6632.1993.tb23035.x. PMID 8239320. S2CID 22058428.
- Штрауб Дж. Э., Гевара Дж., Хо С., Ли Дж. П. (июнь 2002 г.). «Долгое динамическое моделирование: изучение путей сворачивания амилоидного абета-пептида болезни Альцгеймера». Отчеты о химических исследованиях. 35 (6): 473–81. Дои:10.1021 / ar010031e. PMID 12069633.
- Аннаерт В., Де Строопер Б. (2003). «Клеточная биологическая перспектива болезни Альцгеймера». Ежегодный обзор клеточной биологии и биологии развития. 18 (1): 25–51. Дои:10.1146 / annurev.cellbio.18.020402.142302. PMID 12142279.
- Koo EH (ноябрь 2002 г.). «Белок-предшественник бета-амилоида (АРР) и болезнь Альцгеймера: виляет ли собака хвостом?». Трафик. 3 (11): 763–70. Дои:10.1034 / j.1600-0854.2002.31101.x. PMID 12383342. S2CID 40411806.
- Ван Ностранд В.Е., Мельчор Дж. П., Романов Г., Зейглер К., Дэвис Дж. (Ноябрь 2002 г.). «Патогенные эффекты церебральных мутаций амилоидной ангиопатии в предшественнике амилоидного бета-белка». Летопись Нью-Йоркской академии наук. 977 (1): 258–65. Bibcode:2002НЯСА.977..258Н. Дои:10.1111 / j.1749-6632.2002.tb04824.x. PMID 12480759. S2CID 22567664.
- Линг Й., Морган К., Калшекер Н. (ноябрь 2003 г.). «Белок-предшественник амилоида (APP) и биология протеолитического процессинга: отношение к болезни Альцгеймера». Международный журнал биохимии и клеточной биологии. 35 (11): 1505–35. Дои:10.1016 / S1357-2725 (03) 00133-X. PMID 12824062.
- Kerr ML, Small DH (апрель 2005 г.). «Цитоплазматический домен предшественника бета-амилоидного белка болезни Альцгеймера: функция, регуляция протеолиза и значение для разработки лекарств». Журнал неврологических исследований. 80 (2): 151–9. Дои:10.1002 / jnr.20408. PMID 15672415. S2CID 31985212.
- Мэйнард CJ, Буш AI, Masters CL, Cappai R, Li QX (июнь 2005 г.). «Металлы и бета-амилоид при болезни Альцгеймера». Международный журнал экспериментальной патологии. 86 (3): 147–59. Дои:10.1111 / j.0959-9673.2005.00434.x. ЧВК 2517409. PMID 15910549.
- Tickler AK, Wade JD, Separovic F (август 2005 г.). «Роль пептидов Abeta в болезни Альцгеймера». Буквы о белках и пептидах. 12 (6): 513–9. Дои:10.2174/0929866054395905. PMID 16101387.
- Рейнхард К., Эбер С.С., Де Струпер Б. (декабрь 2005 г.). «Белок-предшественник амилоида-бета: интеграция структуры с биологической функцией». Журнал EMBO. 24 (23): 3996–4006. Дои:10.1038 / sj.emboj.7600860. ЧВК 1356301. PMID 16252002.
- Уотсон Д., Кастаньо Е., Кокджон Т.А., Куо Ю.М., Любченко Ю., Пинский Д., Коннолли Е.С., Эш К., Люэрс Д.К., Стайн В.Б., Роуз Л.М., Эммерлинг М.Р., Рохер А.Е. (декабрь 2005 г.). «Физико-химические характеристики растворимых олигомерных Abeta и их патологическая роль в болезни Альцгеймера». Неврологические исследования. 27 (8): 869–81. Дои:10.1179 / 016164105X49436. PMID 16354549. S2CID 25687818.
- Calinisan V, Gravem D, Chen RP, Brittin S, Mohandas N, Lecomte MC, Gascard P (2006). «Новые сведения о потенциальных функциях суперсемейства белков 4.1 в эпителии почек». Границы биологических наук. 11 (1): 1646–66. Дои:10.2741/1911. PMID 16368544.
- Ветривел К.С., Тинакаран Г. (январь 2006 г.). «Амилоидогенный процессинг белка-предшественника бета-амилоида во внутриклеточных компартментах». Неврология. 66 (2 Дополнение 1): S69–73. Дои:10.1212 / 01.wnl.0000192107.17175.39. PMID 16432149. S2CID 35965729.
- Gallo C, Orlassino R, Vineis C (февраль 2006 г.). «[Рецидивирующие внутрипаренхимальные кровотечения у пациента с церебральной амилоидотической ангиопатией: описание одного случая вскрытия]». Патология. 98 (1): 44–7. PMID 16789686.
- Коулсон EJ (август 2006 г.). «Опосредует ли рецептор нейротрофина p75 Abeta-индуцированную токсичность при болезни Альцгеймера?». Журнал нейрохимии. 98 (3): 654–60. Дои:10.1111 / j.1471-4159.2006.03905.x. PMID 16893414. S2CID 20879380.
- Менендес-Гонсалес М., Перес-Пинера П., Мартинес-Ривера М., Калатаюд М. Т., Бласкес Менес Б. (2006). «Обработка APP и участие домена APP-KPI в амилоидном каскаде». Нейродегенеративные заболевания. 2 (6): 277–83. Дои:10.1159/000092315. PMID 16909010. S2CID 45002038.
- Неве Р.Л., Макфи Д.Л. (апрель 2007 г.). «Дисфункция передачи сигналов белка-предшественника амилоида в нейронах приводит к синтезу ДНК и апоптозу». Biochimica et Biophysica Acta (BBA) - Молекулярная основа болезни. 1772 (4): 430–7. Дои:10.1016 / j.bbadis.2006.10.008. ЧВК 1862818. PMID 17113271.
- Чен Х, Стерн Д., Ян С.Д. (декабрь 2006 г.). «Митохондриальная дисфункция и болезнь Альцгеймера». Текущее исследование болезни Альцгеймера. 3 (5): 515–20. Дои:10.2174/156720506779025215. PMID 17168650.
- Caltagarone J, Jing Z, Bowser R (апрель 2007 г.). «Фокальные спайки регулируют передачу сигналов Abeta и гибель клеток при болезни Альцгеймера». Biochimica et Biophysica Acta (BBA) - Молекулярная основа болезни. 1772 (4): 438–45. Дои:10.1016 / j.bbadis.2006.11.007. ЧВК 1876750. PMID 17215111.
- Wolfe MS (февраль 2007 г.). «Когда потеря - это прибыль: снижение протеолитической функции пресенилина приводит к увеличению Abeta42 / Abeta40. Тема для обсуждения роли мутаций пресенилина в болезни Альцгеймера». EMBO отчеты. 8 (2): 136–40. Дои:10.1038 / sj.embor.7400896. ЧВК 1796780. PMID 17268504.
внешняя ссылка
- GeneReviews / NCBI / NIH / UW запись о семейной болезни Альцгеймера с ранним началом
- Амилоид + белок + предшественник в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- Ген Entrez: белок-предшественник бета-амилоида (A4) APP (пептидаза нексин-II, болезнь Альцгеймера)
- Человек ПРИЛОЖЕНИЕ расположение генома и ПРИЛОЖЕНИЕ страница сведений о гене в Браузер генома UCSC.