Reelin - Reelin
Reelin (RELN)[5] большой секретный внеклеточный матрикс гликопротеин что помогает регулировать процессы миграция нейронов и позиционирование в развивающемся мозге, контролируя межклеточные взаимодействия. Помимо этой важной роли в раннем разработка Рилин продолжает работать в мозге взрослого человека.[6] Он модулирует синаптическая пластичность за счет усиления индукции и поддержания долгосрочное потенцирование.[7][8] Он также стимулирует дендриты[9] и дендритный позвоночник[10] развитие и регулирует продолжающуюся миграцию нейробласты генерируется в взрослый нейрогенез такие сайты, как субвентрикулярный и субгранулярные зоны. Встречается не только в мозг но и в печень, щитовидная железа, надпочечник, Фаллопиевых труб, грудь и на сравнительно более низких уровнях в ряде анатомических областей.[11]
Было высказано предположение, что рилин участвует в патогенезе нескольких заболеваний мозга. Было обнаружено, что экспрессия белка значительно ниже в шизофрения и психотический биполярное расстройство,[12] но причина этого наблюдения остается неясной, поскольку исследования показывают, что сам психотропный препарат влияет на экспрессию рилина. Более того, эпигенетические гипотезы, направленные на объяснение измененных уровней экспрессии рилина[13] спорны.[14][15] Полное отсутствие катушки вызывает форму лиссэнцефалия. Рилин также может играть роль в Болезнь Альцгеймера, височная эпилепсия и аутизм.
Имя Рилин происходит от ненормального наматывания походка из моталка мышей,[16] у которых позже было обнаружено дефицит этого мозга белок и были гомозиготный мутации гена RELN. Первичный фенотип, связанный с потерей функции рилина, - это нарушение позиционирования нейронов на протяжении всего развивающегося Центральная нервная система (ЦНС). Мыши гетерозиготный для гена рилина, имея небольшие нейроанатомические дефекты, эндофенотипический черты, связанные с психотическими расстройствами.[17]
Открытие

Мыши-мутанты помогли понять основные молекулярные механизмы развития Центральная нервная система. Впервые полезные спонтанные мутации были выявлены учеными, которые интересовались моторное поведение, и оказалось относительно легко проверить однопометники для мышей, у которых возникли трудности с перемещением по клетке. Было обнаружено несколько таких мышей, которым были даны описательные имена, такие как рилер, ткач, бегун, нервный и шатающийся.[нужна цитата ]
"моталка "мышь была впервые описана в 1951 г. Д. С. Фальконер в Эдинбургский университет как спонтанный вариант, возникший в колонии хотя бы умеренно инбредных белоснежных пузатых мышей в 1948 г.[16] Гистопатологический исследования 1960-х годов показали, что мозжечок мышей reeler резко уменьшаются в размерах, в то время как нормальная ламинарная организация, обнаруженная в нескольких областях мозга, нарушается.[18] 1970-е годы привели к открытию инверсии клеточного слоя в неокортексе мыши.[19] что привлекло больше внимания к мутации reeler.
В 1994 году новый аллель катушки получен с помощью вставного мутагенез.[20] Это обеспечило первое молекулярный маркер из локус, что позволяет картировать ген RELN на хромосоме 7q22, а затем клонировать и идентифицировать.[21] Японские ученые Медицинская школа Кочи успешно вырабатывали антитела против нормальных экстрактов головного мозга у мышей Рилера, позже выяснилось, что эти антитела специфичны. моноклональные антитела для катушки и были обозначены как CR-50 (маркер Кахаля-Ретциуса 50).[22] Они отметили, что CR-50 реагировал конкретно с Нейроны Кахаля-Ретциуса, функциональная роль которого до того времени была неизвестна.[нужна цитата ]
Рецепторы рилина, рецептор аполипопротеина Е 2 (ApoER2) и рецептор липопротеинов очень низкой плотности (VLDLR), были открыты Trommsdorff, Herz и коллегами, которые первоначально обнаружили, что цитозольный адаптерный белок Dab1 взаимодействует с цитоплазматическим доменом членов семейства рецепторов LDL.[23] Затем они показали, что двойной нокаутировать мыши для ApoER2 и VLDLR, которые оба взаимодействуют с Dab1, имели дефекты кортикального слоя, подобные таковым у reeler.[24]
В вниз по течению путь reelin было дополнительно уточнено с помощью других мутантных мышей, включая йотари и скремблер. Эти мутанты имеют фенотип, сходный с фенотипом мышей reeler, но без мутации в reelin. Затем было продемонстрировано, что мышь отключенный гомолог 1 (Dab1 ) ген отвечает за фенотипы этих мутантных мышей, поскольку белок Dab1 отсутствовал (yotari) или едва обнаруживался (scrambler) у этих мутантов.[25] Направленное разрушение Dab1 также вызывает фенотип, сходный с фенотипом reeler. Выявление DAB1 как стержневой регулятор сигнального каскада reelin запускает утомительный процесс расшифровки его сложных взаимодействий.[нужна цитата ]
Затем последовала серия спекулятивных отчетов, связывающих генетические вариации и взаимодействия рилина с шизофренией, болезнью Альцгеймера, аутизмом и другими очень сложными дисфункциями. Эти и другие открытия в сочетании с перспективой раскрытия эволюционных изменений, которые позволили создать человеческий мозг, значительно усилили исследования. По состоянию на 2008 год, примерно через 13 лет после открытия гена, кодирующего этот белок, сотни научных статей посвящены множеству аспектов его структуры и функционирования.[26][27]
Распределение тканей и секреция
Исследования показывают, что рилин отсутствует в синаптические везикулы и секретируется через конститутивный секреторный путь, хранится в Гольджи секреторные пузырьки.[28] Скорость выпуска Рилина не регулируется деполяризация, но строго зависит от скорости его синтеза. Эта связь аналогична той, о которой сообщается для секреции других внеклеточный матрикс белки.[нужна цитата ]
Во время развития мозга рилин секретируется в коре и гиппокампе так называемыми Клетки Кахаля-Ретциуса, Клетки Кахаля и клетки Ретциуса.[29] Рилин-экспрессирующие клетки в пренатальном и раннем постнатальном мозге преимущественно обнаруживаются в маргинальной зоне (MZ) коры и во временной зоне. субпиальный зернистый слой (SGL), которая в наибольшей степени проявляется у человека,[30] и в гиппокампе слой lacunosum-molculare и верхний маргинальный слой зубчатые извилины.
В развивающихся мозжечок, reelin сначала выражается во внешнем гранулярная клетка слой (EGL), прежде чем произойдет миграция гранулярных клеток во внутренний слой гранулярных клеток (IGL).[31]
Достигнув пика сразу после рождения, синтез рилина впоследствии резко снижается, становясь более диффузным по сравнению с отчетливо ламинарной экспрессией в развивающемся мозге. В мозге взрослого человека рилин выражается ГАМК -эргический интернейроны коры и глутаматергических нейронов мозжечка,[32] и немногочисленными сохранившимися клетками Кахаля-Ретциуса. Среди ГАМКергических интернейронов рилин, по-видимому, обнаруживается преимущественно у тех, кто экспрессирует кальретинин и кальбиндин, подобно битутированный, горизонтальный, и Клетки Мартинотти, но нет парвальбумин -выражающие клетки, например люстра или же корзина нейронов.[33][34] В белом веществе небольшая доля интерстициальные нейроны также было обнаружено, что окрашивание положительно на экспрессию рилина.[35]

Вне мозга рилин находится в крови взрослых млекопитающих, печень, гипофиз pars intermedia, и надпочечники хромаффинные клетки.[36] В печени рилин локализуется в звездчатые клетки печени.[37] Экспрессия рилина увеличивается при повреждении печени и возвращается к норме после ее восстановления.[38]В глазах катушка секретируется ганглиозные клетки сетчатки а также находится в эндотелиальный слой роговицы.[39] Так же, как и в печени, его экспрессия увеличивается после травмы.[нужна цитата ]
Белок также производится одонтобласты, которые представляют собой клетки на краях пульпы зуба. Рилин здесь обнаруживается как во время одонтогенеза, так и в зрелом зубе.[40] Некоторые авторы предполагают, что одонтобласты играют дополнительную роль как сенсорные клетки, способные преобразовывать болевые сигналы нервным окончаниям.[41] Согласно гипотезе, рилин участвует в процессе[27] за счет усиления контакта между одонтобластами и нервными окончаниями.[42]
Структура

Рилин состоит из 3461 аминокислоты с относительной молекулярной массой 388 кДа. Он также имеет сериновая протеаза Мероприятия.[44] Ген RELN мыши состоит из 65 экзоны охватывая примерно 450 kb.[45] Один экзон, кодирующий только две аминокислоты рядом с белком C-конец, проходит альтернативное сращивание, но точное функциональное воздействие этого неизвестно.[27] В структуре гена идентифицированы два сайта инициации транскрипции и два сайта полиаденилирования.[45]
Белок рилина начинается с сигнального пептида длиной 27 аминокислот, за которым следует область, имеющая сходство с F-спондин (в домен reeler ), обозначенный на схеме как «SP», и областью, уникальной для reelin, отмеченной как «H». Далее идет 8 повторов из 300–350 аминокислот. Они называются Reelin повторяет и иметь фактор роста эпидермиса мотив в их центре, разделяя каждый повтор на два субповтора, А (в BNR / Asp-box повтор ) и B (в EGF-подобный домен ). Несмотря на это прерывание, две подобласти контактируют напрямую, в результате чего получается компактная общая структура.[46]
Конечный домен рилина содержит высокоосновную и короткую С-концевую область (CTR, помеченную "+") длиной 32 аминокислоты. Этот регион является высококонсервативным и на 100% идентичен у всех исследованных млекопитающих. Считалось, что CTR необходим для секреции катушек, потому что Орлеан моталка мутация, в которой отсутствует часть 8-го повтора и весь CTR, неспособна секретировать белок неправильной формы, что приводит к его концентрации в цитоплазме. Однако другие исследования показали, что CTR не важен для самой секреции, но мутанты, лишенные CTR, были гораздо менее эффективны в активации последующих сигнальных событий.[47]
Reelin расщеплен in vivo на двух сайтах, расположенных после доменов 2 и 6 - примерно между повторами 2 и 3 и между повторами 6 и 7, что приводит к образованию трех фрагментов.[48] Это расщепление не снижает активность белка, так как конструкции, состоящие из предполагаемых центральных фрагментов (повторений 3–6), связываются с рецепторами липопротеинов, запускают Dab1 фосфорилирование и имитировать функции катушки во время корковая пластинка разработка.[49] Более того, обработка рилина эмбриональными нейронами может быть необходима для правильного кортикогенеза.[50]
Функция

Основными функциями рилина являются регуляция кортикогенеза и позиционирования нейрональных клеток в пренатальном периоде, но белок также продолжает играть роль у взрослых. Рилин обнаружен во многих тканях и органах, и его функциональные роли можно примерно разделить по времени экспрессии и по локализации его действия.[11]
Во время разработки
Ряд не нервных тканей и органов экспрессируют рилин во время развития, причем экспрессия резко снижается после формирования органов. Роль белка здесь в значительной степени не изучена, потому что у нокаутных мышей не наблюдается серьезной патологии в этих органах. Роль Рилина в растущей центральной нервной системе подробно описана. Он способствует дифференцировке клеток-предшественников в радиальная глия и влияет на ориентацию его волокон, которые служат проводниками для мигрирующих нейробластов.[53] Положение слоя клеток, секретирующих рилин, важно, потому что волокна ориентируются в направлении его более высокой концентрации.[54] Например, рилин регулирует развитие специфичных для слоев связей в гиппокампе и энторинальной коре.[55][56]

Млекопитающее кортикогенез это еще один процесс, в котором катушка играет важную роль. В этом процессе временный слой, называемый предварительной пластиной, разделяется на маргинальную зону вверху и вспомогательную пластину внизу, а пространство между ними заполняется нейронными слоями по схеме «наизнанку». Такое расположение, при котором вновь созданные нейроны проходят через осевшие слои и располагаются на одну ступень выше, является отличительной чертой мозга млекопитающих, в отличие от эволюционно более старой коры головного мозга рептилий, в которой слои расположены по принципу «снаружи внутрь». мода. Когда рилин отсутствует, как у мутанта моталка мыши, порядок корковых слоев становится примерно инвертированным, при этом более молодые нейроны оказываются неспособными пройти осевшие слои. Нейроны субпластинки не могут остановиться и вторгаются в самый верхний слой, создавая так называемую суперпластинку, в которой они смешиваются с Клетки Кахаля-Ретциуса и некоторые ячейки обычно предназначены для второго слоя.[нужна цитата ]

Нет единого мнения относительно роли рилина в правильном расположении корковых слоев. Исходная гипотеза о том, что белок является стоп-сигналом для мигрирующих клеток, подтверждается его способностью вызывать диссоциацию.[57] его роль в утверждении слоя компактных гранулярных клеток в гиппокампе и тем фактом, что мигрирующие нейробласты уклоняются от областей, богатых рилином. Но эксперимент, в котором кортикогенез у мышей прошел нормально, несмотря на неправильное расположение секретирующего слоя катушки,[58] и отсутствие доказательств того, что рилин влияет на ростовые конусы и передние края нейронов, заставило выдвинуть некоторые дополнительные гипотезы. Согласно одному из них, рилин делает клетки более восприимчивыми к еще не описанному каскаду позиционной передачи сигналов.[нужна цитата ]
Reelin также может гарантировать правильное расположение нейронов в спинной мозг: согласно одному исследованию, расположение и уровень его экспрессии влияет на движение симпатических преганглионарных нейронов.[59]
Считается, что белок воздействует на мигрирующие нейрональные предшественники и, таким образом, контролирует правильное расположение клеток в коре и других структурах мозга. Предлагаемая роль - один из сигналов диссоциации для нейронных групп, позволяющий им разделиться и перейти от тангенциальной миграции цепи к радиальной индивидуальной миграции.[57] Диссоциация отделяет мигрирующие нейроны от глиальные клетки которые действуют как их проводники, превращая их в отдельные клетки, которые могут в одиночку ударить, чтобы найти свое окончательное положение.[нужна цитата ]

Рилин принимает участие в изменении развития Рецептор NMDA конфигурация, повышающая мобильность NR2B -содержащих рецепторов и, таким образом, сокращая время, которое они проводят в синапс.[61][мертвая ссылка ][62][63] Было высказано предположение, что это может быть частью механизма, лежащего в основе «переключателя NR2B-NR2A», который наблюдается в мозге во время его постнатального развития.[64] Продолжающаяся секреция рилина ГАМКергическими нейронами гиппокампа необходима для поддержания низкого уровня NR2B-содержащих рецепторов NMDA.[60]
У взрослых
В нервной системе взрослого человека рилин играет выдающуюся роль в двух наиболее активных участках нейрогенеза, субвентрикулярной зоне и зубчатой извилине. У некоторых видов нейробласты из субвентрикулярной зоны мигрируют цепями в ростральный миграционный поток (RMS), чтобы достичь обонятельной луковицы, где рилин диссоциирует их на отдельные клетки, которые могут мигрировать дальше индивидуально. Они меняют способ миграции с тангенциального на радиальный и начинают использовать волокна радиальной глии в качестве направляющих. Есть исследования, показывающие, что вдоль самого RMS два рецептора, ApoER2 и VLDLR, и их внутриклеточный адаптер DAB1 работать независимо от Reelin,[65] скорее всего, под влиянием недавно предложенного лиганда, тромбоспондин-1.[51] В зубчатой извилине взрослого человека reelin обеспечивает ориентиры для новых нейронов, которые постоянно прибывают в слой гранулярных клеток из субгранулярной зоны, сохраняя слой компактным.[66]
Рилин также играет важную роль в мозге взрослого человека, модулируя кортикальный пирамидный нейрон. дендритный позвоночник плотность экспрессии, ветвление дендриты, и выражение долгосрочное потенцирование[8] поскольку его секреция диффузно продолжается ГАМКергическими кортикальными интернейронами, их происхождение прослеживается до медиального ганглиозное возвышение.
Во взрослом организме ненейронная экспрессия гораздо менее распространена, но резко возрастает при повреждении некоторых органов.[38][39] Точная функция активации катушки после травмы все еще исследуется.[нужна цитата ]
Эволюционное значение


Взаимодействия Reelin-DAB1 могли сыграть ключевую роль в структурной эволюции коры, которая эволюционировала из одного слоя в общем предшественнике амниот в многослойную кору современных млекопитающих.[67] Исследования показывают, что экспрессия рилина повышается по мере усложнения коры головного мозга, достигая максимума в человеческом мозге, в котором секретирующие рилин клетки Кахаля-Ретциуса имеют значительно более сложную аксональную ветвь.[68] Рилин присутствует в конечном мозге всех позвоночных, изученных до сих пор, но паттерн экспрессии сильно различается. Например, данио вообще не имеют клеток Кахала-Ретциуса; вместо этого белок секретируется другими нейронами.[69][70] Эти клетки не образуют особого слоя у земноводных, и радиальная миграция в их головном мозге очень слабая.[69]
По мере того как кора головного мозга становится более сложной и извилистой, миграция вдоль волокон радиальной глии становится более важной для правильного ламинирования. Считается, что появление отчетливого слоя, секретирующего катушки, играет важную роль в этой эволюции.[54] Есть противоречивые данные о важности этого слоя,[58] и они объясняются в литературе либо наличием дополнительного сигнального позиционного механизма, который взаимодействует с каскадом рилинов,[58] или исходя из предположения, что мыши, которые используются в таких экспериментах, имеют избыточную секрецию рилина[71] по сравнению с более локализованным синтезом в человеческом мозге.[30]
Клетки Кахаля-Ретциуса, большинство из которых исчезают во время рождения, коэкспрессируют катушку с HAR1 ген, который, как полагают, претерпел наиболее значительные эволюционные изменения у людей по сравнению с шимпанзе, являясь наиболее "эволюционно ускоренным" из генов от человеческие ускоренные области.[72] Есть также свидетельства того, что варианты гена DAB1 были включены в недавний выборочный анализ китайского населения.[73][74]
Механизм действия

SFK: Киназы семейства SRC.
JIP: JNK-взаимодействующий белок 1
Рецепторы
Считается, что контроль рилина межклеточными взаимодействиями опосредован связыванием рилина с двумя членами семейство генов рецепторов липопротеинов низкой плотности: VLDLR и ApoER2.[76][77][78][79] Два основных рецептора рилина, по-видимому, выполняют несколько разные роли: VLDLR проводит стоп-сигнал, в то время как ApoER2 важен для миграции поздних неокортикальных нейронов.[80] Также было показано, что N-концевой участок рилина, сайт, отличный от участка рилина, который, как было показано, связан с VLDLR / ApoER2, связывается с альфа-3-бета-1 интегрин рецептор.[81] Предложение о том, что протокадгерин CNR1 ведет себя как рецептор рилина[82] был опровергнут.[49]
Как члены суперсемейства липопротеиновых рецепторов, и VLDLR, и ApoER2 имеют в своей структуре домен интернализации, называемый NPxY мотив. После связывания с рецепторами рилин интернализуется эндоцитоз, и N-концевой фрагмент белка повторно секретируется.[83] Этот фрагмент может служить постнатально для предотвращения разрастания апикальных дендритов пирамидных нейронов кортикального слоя II / III, действуя по пути, независимому от канонических рецепторов рилина.[84]
Рецепторы рилина присутствуют на обоих нейроны и глиальные клетки. Более того, радиальная глия выразить такое же количество ApoER2 но будучи в десять раз менее богатым VLDLR.[53] рецепторы бета-1 интегрина на глиальных клетках играют более важную роль в расслоении нейронов, чем те же рецепторы на мигрирующих нейробластах.[85]
Рилин-зависимое усиление долгосрочное потенцирование это вызвано ApoER2 взаимодействие с Рецептор NMDA. Это взаимодействие происходит, когда ApoER2 имеет область, кодируемую экзоном 19. Ген ApoER2 альтернативно сплайсируется, причем вариант, содержащий экзон 19, более активно продуцируется в периоды активности.[86] Согласно одному исследованию, экспрессия барабана в гиппокампе быстро повышается, когда возникает потребность в сохранении памяти, так как деметилазы открыть ген RELN.[87] Активация роста дендритов рилином, по-видимому, осуществляется через Src семья киназы и зависит от выражения Crk семейные белки,[88] согласуется с взаимодействием Crk и CrkL с фосфорилированным тирозином Dab1.[89] Более того, Cre-loxP рекомбинация модель мыши, в которой отсутствует Crk и CrkL в большинстве нейронов[90] сообщалось, что моталка фенотип, указывающий на то, что Crk / CrkL находятся между DAB1 и Акт в сигнальной цепи reelin.
Сигнальные каскады
Рилин активирует сигнальный каскад Notch-1, вызывая выражение FABP7 и побуждая клетки-предшественники предполагать лучевая глия фенотип.[91] Кроме того, кортикогенез in vivo сильно зависит от того, как рилин обрабатывается эмбриональными нейронами,[50] которые, как считается, секретируют еще неопознанные металлопротеиназы которые освобождают центральную сигнальную часть белка. Некоторые другие неизвестные протеолитические механизмы также могут играть роль.[92] Предполагается, что полноразмерный рилин прилипает к волокнам внеклеточного матрикса на более высоких уровнях, а центральные фрагменты, когда они освобождаются за счет разрушения катушки, способны проникать на более низкие уровни.[50] Возможно, что как нейробласты достигая более высоких уровней, они останавливают свою миграцию либо из-за повышенной комбинированной экспрессии всех форм рилина, либо из-за специфического способа действия полноразмерных молекул рилина и его гомодимеров.[27]
Внутриклеточный адаптер DAB1 связывается с VLDLR и ApoER2 через NPxY мотив и участвует в передаче сигналов рилина через эти липопротеиновые рецепторы. Он фосфорилируется Src[93] и Fyn[94] киназ и, по-видимому, стимулирует актин цитоскелет изменяет свою форму, влияя на долю рецепторов интегрина на поверхности клетки, что приводит к изменению адгезия. Фосфорилирование DAB1 приводит к его убиквитинирование и последующая деградация, и это объясняет повышенные уровни DAB1 в отсутствии reelin.[95] Такой негативный отзыв считается важным для правильного кортикального ламинирования.[96] Активированные двумя антителами, VLDLR и ApoER2 вызывают фосфорилирование DAB1, но, по-видимому, без последующей деградации и без спасения моталка фенотип, и это может указывать на то, что часть сигнала проводится независимо от DAB1.[49]

Белок, играющий важную роль в лиссэнцефалия и соответственно назвал LIS1 (PAFAH1B1 ), как было показано, взаимодействует с внутриклеточным сегментом VLDLR, таким образом реагируя на активацию пути рилина.[75]
Комплексы
Было показано, что молекулы рилина[97][98] с образованием большого белкового комплекса, дисульфидно-связанный гомодимер. Если гомодимер не образуется, эффективный тирозин фосфорилирование из DAB1 in vitro терпит неудачу. Более того, два основных рецептора рилина способны образовывать кластеры.[99] которые, скорее всего, играют основную роль в передаче сигналов, заставляя внутриклеточный адаптер DAB1 димеризоваться или олигомеризоваться, в свою очередь. В исследовании было показано, что такая кластеризация активирует сигнальную цепь даже в отсутствие самого рилина.[99] Кроме того, сам рилин может разрезать пептидные связи, удерживающие вместе другие белки, являясь сериновая протеаза,[44] и это может повлиять на процессы клеточной адгезии и миграции. Передача сигналов рилина приводит к фосфорилированию актин -взаимодействующий белок кофилин 1 в ser3; это может стабилизировать актиновый цитоскелет и закрепить ведущие процессы миграции нейробластов, предотвращая их дальнейший рост.[100][101]
Взаимодействие с Cdk5
Циклинзависимая киназа 5 (Cdk5), главный регулятор миграции и позиционирования нейронов, как известно, фосфорилирует DAB1[102][103][104] и другие цитозольные мишени передачи сигналов рилина, такие как Тау,[105] которые могут быть активированы также через индуцированную катушкой дезактивацию GSK3B,[106] и НУДЕЛЬ,[107] связана с Lis1, одна из целей DAB1. LTP индукция катушкой в срезах гиппокампа не удается p35 нокауты.[108] P35 является ключевым активатором Cdk5, а двойные нокауты p35 / Dab1, p35 / RELN, p35 / ApoER2, p35 / VLDLR демонстрируют повышенный дефицит миграции нейронов,[108][109] указывает на синергетическое действие путей рилин → ApoER2 / VLDLR → DAB1 и p35 / p39 → Cdk5 в нормальном кортикогенезе.
Возможная патологическая роль
Лиссэнцефалия
Нарушения гена RELN считаются причиной редкой формы лиссэнцефалия с гипоплазия мозжечка классифицируется как микролисэнцефалия называется Синдром Нормана-Робертса.[110][111] Мутации нарушают сращивание РЭЛН мРНК транскрипт, что приводит к низкому или неопределяемому количеству белка рилина. В фенотип у этих пациентов было характерно гипотония, атаксия и задержка развития с отсутствием сидения без опоры и глубокой умственной отсталостью с незначительным развитием речи или без него. Судороги и врожденная лимфедема также присутствуют. Роман хромосомная транслокация Причина синдрома была описана в 2007 году.[112]
Шизофрения
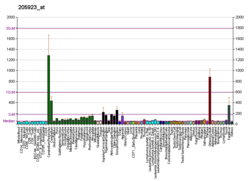
Сниженная экспрессия reelin и его мРНК уровни в мозгу шизофрения пострадавших было зарегистрировано в 1998 г.[113] и 2000 г.,[114] и независимо подтверждено в посмертных исследованиях гиппокампа,[12] мозжечок,[115] базальный ганглий,[116] и кора головного мозга.[117][118] Снижение может достигать 50% в некоторых областях мозга и связано со снижением экспрессии GAD-67 фермент,[115] который катализирует переход глутамат к ГАМК. Уровни в крови катушки и ее изоформы также изменяются при шизофрении вместе с расстройства настроения, согласно одному исследованию.[119] Снижение префронтальной экспрессии мРНК рилина при шизофрении было обнаружено как наиболее статистически значимое нарушение, обнаруженное в многоцентровом исследовании, проведенном в 2001 г. в 14 отдельных лабораториях Консорциумом невропатологов Стэнли.[120]
Эпигенетический гиперметилирование ДНК у больных шизофренией предлагается в качестве причины снижения,[121][122] в соответствии с наблюдениями 1960-х годов, что администрация метионин для больных шизофренией приводит к глубокому обострению симптомов шизофрении у шестидесяти - семидесяти процентов пациентов.[123][124][125][126] Предлагаемый механизм является частью «эпигенетической гипотезы патофизиологии шизофрении», сформулированной группой ученых в 2008 г. (D. Grayson; A. Guidotti; Э. Коста ).[13][127] Посмертное исследование, сравнивающее ДНК-метилтрансфераза (DNMT1 ) и экспрессия мРНК Reelin в корковых слоях I и V пациентов с шизофренией и в нормальном контроле продемонстрировали, что в слое V уровни как DNMT1, так и Reelin были нормальными, тогда как в слое I DNMT1 был в три раза выше, что, вероятно, привело к двукратному снижению уровня Reelin. выражение.[128] Имеются доказательства того, что изменение является селективным и что DNMT1 сверхэкспрессируется в рилин-секретирующих ГАМКергических нейронах, но не в их глутаматергических соседях.[129][130] Метилирование ингибиторы и гистоновая деацетилаза ингибиторы, такие как вальпроевая кислота, увеличить уровни мРНК рилина,[131][132][133] в то время как обработка L-метионином подавляет фенотипическую экспрессию рилина.[134]
Одно исследование показало повышенную регуляцию гистондеацетилазы HDAC1 в гиппокампе пациентов.[135] Гистоновые деацетилазы подавляют промоторы генов; На мышиных моделях было показано, что гиперацетилирование гистонов деметилирует промоторы как рилина, так и GAD67.[136] Было показано, что ингибиторы DNMT1 у животных увеличивают экспрессию как рилина, так и GAD67,[137] и ингибиторы DNMT и ингибиторы HDAC, показанные в одном исследовании[138] для активации обоих генов с сопоставимой зависимостью от дозы и времени. Как показывает одно исследование, S-аденозил метионин (SAM) концентрация в префронтальной коре головного мозга пациентов вдвое выше, чем в коре головного мозга здоровых людей.[139] SAM, являясь донором метильной группы, необходимой для активности DNMT, может еще больше изменить эпигенетический контроль экспрессии генов.[нужна цитата ]
Хромосомная область 7q22 который укрывает RELN ген связан с шизофренией,[140] и сам ген был связан с заболеванием в большом исследовании, которое обнаружило полиморфизм rs7341475 для увеличения риска заболевания у женщин, но не у мужчин. Женщины, у которых есть однонуклеотидный полиморфизм (SNP) примерно в 1,4 раза чаще заболевают, согласно исследованию.[141] Аллельные вариации RELN также коррелировали с рабочей памятью, памятью и исполнительными функциями в нуклеарных семьях, один из членов которых страдает шизофренией.[140] Позднее была воспроизведена ассоциация с рабочей памятью.[142] В одном небольшом исследовании несинонимичный полиморфизм Val997Leu гена был связан с увеличением левого и правого желудочков у пациентов.[143]
Одно исследование показало, что у пациентов снижен уровень одного из рецепторов рилина, VLDLR, в периферийных лимфоциты.[144] Через шесть месяцев антипсихотик терапия выражение поднялось; По мнению авторов, периферические уровни VLRLR могут служить надежным периферическим биомаркером шизофрении.[144]
Учитывая роль рилина в стимулировании дендритогенеза,[9][88] Были высказаны предположения, что локализованный дефицит дендритных шипов, наблюдаемый при шизофрении[145][146] отчасти может быть связано с подавлением активности катушки.[147][148]
Путь рилина также может быть связан с шизофренией и другими психотическими расстройствами через его взаимодействие с генами риска. Одним из примеров является фактор транскрипции нейронов. NPAS3, нарушение которого связано с шизофренией[149] и неспособность к обучению. Нокаутные мыши, лишенные NPAS3 или аналогичного белка NPAS1 имеют значительно более низкие уровни катушки;[150] точный механизм этого неизвестен. Другой пример - ген, связанный с шизофренией. MTHFR, с нокаутами мышей, показывающими снижение уровня рилина в мозжечке.[151] В том же ключе стоит отметить, что ген, кодирующий субъединицу NR2B на который предположительно влияет рилин в процессе развития NR2B-> NR2A состава рецепторов NMDA,[63] стоит как один из самых серьезных рисков гены-кандидаты.[152] Еще один общий аспект между NR2B и RELN заключается в том, что они оба могут регулироваться TBR1 фактор транскрипции.[153]
В гетерозиготный мышь reeler, которая гаплонедостаточный для гена RELN имеет несколько общих нейрохимических и поведенческих аномалий с шизофренией и биполярным расстройством,[154] но точное значение этих изменений поведения мышей для патофизиологии шизофрении остается спорным.[155]
Как описано ранее, рилин играет решающую роль в модуляции ранней миграции нейробластов во время развития мозга. Доказательства измененного положения нервных клеток в мозге пациентов с посмертной шизофренией[156][157] и меняется на сети регуляции генов этот контроль миграция клеток[158][159] предполагает потенциальную связь между измененной экспрессией рилина в ткани мозга пациента и нарушением миграции клеток во время развития мозга. Чтобы смоделировать роль рилина в контексте шизофрении на клеточном уровне, клетки, полученные из обонятельной нейросферы, были созданы из носовой биопсия пациентов с шизофренией и по сравнению с клетками здорового контроля.[158] Клетки, полученные от пациентов с шизофренией, имеют пониженные уровни мРНК рилина[158] и белок[160] по сравнению со здоровыми контрольными клетками, но экспрессирует ключевые рецепторы рилина и дополнительный белок DAB1.[160] Когда вырос in vitro клетки, полученные от пациентов с шизофренией, не могли реагировать на рилин, нанесенный на культура ткани поверхности; Напротив, клетки, полученные из здоровых контролей, были способны изменять свою клеточную миграцию при воздействии рилина.[160] Эта работа продолжала показывать, что отсутствие реакции миграции клеток в клетках, полученных от пациентов, было вызвано неспособностью клетки производить достаточно очаговые спайки of the appropriate size when in contact with extracellular reelin.[160] More research into schizophrenia cell-based models are needed to look at the function of reelin, or lack of, in the pathophysiology of schizophrenia.
Биполярное расстройство
Decrease in RELN expression with concurrent upregulation of DNMT1 типично для биполярное расстройство with psychosis, but is not characteristic of patients with major depression without psychosis, which could speak of specific association of the change with psychoses.[114] One study suggests that unlike in schizophrenia, such changes are found only in the cortex and do not affect the deeper structures in psychotic bipolar patients, as their basal ganglia were found to have the normal levels of DNMT1 and subsequently both the reelin and GAD67 levels were within the normal range.[116]
In a genetic study conducted in 2009, preliminary evidence requiring further Репликация ДНК suggested that variation of the RELN ген (SNP rs362719 ) may be associated with susceptibility to биполярное расстройство у женщин.[161]
Аутизм
Аутизм это расстройство нервного развития that is generally believed to be caused by mutations in several locations, likely triggered by environmental factors. The role of reelin in autism is not decided yet.[162]
Reelin was originally in 2001 implicated in a study finding associations between autism and a полиморфный GGC/CGG повторение preceding the 5' ATG initiator codon of the RELN gene in an Italian population. Longer triplet repeats in the 5' region were associated with an increase in autism susceptibility.[163] However, another study of 125 multiple-incidence families and 68 single-incidence families from the subsequent year found no significant difference between the length of the polymorphic repeats in affected and controls. Although, using a family based association test larger катушка alleles were found to be transmitted more frequently than expected to affected children.[164] An additional study examining 158 subjects with German lineage likewise found no evidence of triplet repeat polymorphisms associated with autism.[165] And a larger study from 2004 consisting of 395 families found no association between autistic subjects and the CGG triplet repeat as well as the allele size when compared to age of first word.[166]In 2010 a large study using data from 4 European cohorts would find some evidence for an association between autism and the rs362780 RELN polymorphism.[167]
Исследования трансгенный mice have been suggestive of an association, but not definitive.[168]
Temporal lobe epilepsy: granule cell dispersion
Decreased reelin expression in the hippocampal tissue samples from patients with височная эпилепсия was found to be directly correlated with the extent of granule cell dispersion (GCD), a major feature of the disease that is noted in 45%–73% of patients.[169][170] The dispersion, according to a small study, is associated with the RELN promoter hypermethylation.[171] According to one study, prolonged seizures in a rat model of mesial temporal lobe epilepsy have led to the loss of reelin-expressing interneurons and subsequent ectopic chain migration and aberrant integration of newborn dentate granule cells. Without reelin, the chain-migrating neuroblasts failed to detach properly.[172] Более того, в каинат -induced mouse epilepsy model, exogenous reelin had prevented GCD, according to one study.[173]
Болезнь Альцгеймера
The Reelin receptors ApoER2 и VLDLR принадлежат к ЛПНП receptor gene family.[174] All members of this family are receptors for Аполипопротеин E (ApoE). Therefore, they are often synonymously referred to as 'ApoE receptors'. ApoE occurs in 3 common isoforms (E2, E3, E4) in the human population. ApoE4 is the primary genetic risk factor for late-onset Болезнь Альцгеймера. This strong genetic association has led to the proposal that ApoE receptors play a central role in the pathogenesis of Alzheimer's Disease.[174][175] According to one study, reelin expression and гликозилирование patterns are altered in Болезнь Альцгеймера. In the cortex of the patients, reelin levels were 40% higher compared with controls, but the cerebellar levels of the protein remain normal in the same patients.[176] This finding is in agreement with an earlier study showing the presence of Reelin associated with amyloid plaques in a transgenic AD mouse model.[177] A large genetic study of 2008 showed that RELN gene variation is associated with an increased risk of Alzheimer's disease in women.[178] The number of reelin-producing Cajal-Retzius cells is significantly decreased in the first cortical layer of patients.[179][180] Reelin has been shown to interact with белок-предшественник амилоида,[181] and, according to one in-vitro study, is able to counteract the Aβ-induced dampening of NMDA-рецептор Мероприятия.[182] This is modulated by ApoE isoforms, which selectively alter the recycling of ApoER2 as well as AMPA and NMDA receptors.[183]
Рак
Метилирование ДНК patterns are often changed in tumours, and the RELN gene could be affected: according to one study, in the панкреатический рак the expression is suppressed, along with other reelin pathway components[184] In the same study, cutting the reelin pathway in cancer cells that still expressed reelin resulted in increased motility and invasiveness. Напротив, в рак простаты the RELN expression is excessive and correlates with Gleason score.[185] Ретинобластома presents another example of RELN overexpression.[186] This gene has also been seen recurrently mutated in cases of acute lymphoblastic leukaemia.[187]
Другие условия
Один исследование ассоциации всего генома indicates a possible role for RELN gene variation in otosclerosis, an abnormal growth of bone of the среднее ухо.[188] In a statistical search for the genes that are differentially expressed in the brains of cerebral malaria-resistant versus cerebral malaria-susceptible mice, Delahaye et al. detected a significant upregulation of both RELN and DAB1 and speculated on possible protective effects of such over-expression.[189] In 2020, a study reported a novel variant in RELN gene (S2486G) which was associated with ankylosing spondylitis in a large family. This suggested a potential insight into the pathophysiological involvement of reelin via inflammation and osteogenesis pathways in ankylosing spondylitis, and it could broaden the horizon toward new therapeutic strategies.[190] A 2020 study from UT Southwestern Medical Center suggests circulating Reelin levels might correlate with MS severity and stages, and that lowering Reelin levels might be a novel way to treat MS.[191]
Factors affecting reelin expression

The expression of reelin is controlled by a number of factors besides the sheer number of Cajal-Retzius cells. Например, TBR1 transcription factor regulates RELN along with other T-element -содержащие гены.[153] On a higher level, increased maternal care was found to correlate with reelin expression in rat pups; such correlation was reported in hippocampus[193] and in the cortex.[192] According to one report, prolonged exposure to кортикостерон significantly decreased reelin expression in murine hippocampi, a finding possibly pertinent to the hypothetical role of кортикостероиды в депрессия.[194] One small postmortem study has found increased methylation of RELN gene in the neocortex of persons past their puberty compared with those that had yet to enter the period of maturation.[195]
Психотропные препараты
As reelin is being implicated in a number of brain disorders and its expression is usually measured posthumously, assessing the possible medication effects is important.[нужна цитата ]
According to the epigenetic hypothesis, drugs that shift the balance in favour of деметилирование have a potential to alleviate the proposed methylation-caused downregulation of RELN and GAD67. In one study, clozapine and sulpiride but not haloperidol and olanzapine were shown to increase the demethylation of both genes in mice pretreated with l-methionine.[196] Вальпроевая кислота, а ингибитор гистондеацетилазы, when taken in combination with antipsychotics, is proposed to have some benefits. But there are studies conflicting the main premise of the epigenetic hypothesis, and a study by Fatemi et al. shows no increase in RELN expression by valproic acid; that indicates the need for further investigation.[нужна цитата ]
Fatemi et al. conducted the study in which RELN mRNA and reelin protein levels were measured in rat prefrontal cortex following a 21-day of intraperitoneal injections of the following drugs:[27]
| Reelin expression | Клозапин | Флуоксетин | Галоперидол | Литий | Оланзапин | Вальпроевая кислота |
|---|---|---|---|---|---|---|
| белок | ↓ | ↔ | ↓ | ↓ | ↑ | ↔ |
| мРНК | ↑ | ↑ | ↓ | ↑ | ↑ | ↓ |
In 2009, Fatemi et al. published the more detailed work on rats using the same medication. Here, cortical expression of several participants (VLDLR, DAB1, GSK3B ) of the signaling chain was measured besides reelin itself, and also the expression of GAD65 и GAD67.[197]
Рекомендации
- ^ а б c GRCh38: Ensembl release 89: ENSG00000189056 - Ансамбль, Май 2017
- ^ а б c GRCm38: Ensembl release 89: ENSMUSG00000042453 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "RELN gene". Домашний справочник по генетике. 25 января 2016 г.. Получено 31 января 2016.
- ^ Bosch C, Muhaisen A, Pujadas L, Soriano E, Martínez A (2016). "Reelin Exerts Structural, Biochemical and Transcriptional Regulation Over Presynaptic and Postsynaptic Elements in the Adult Hippocampus". Границы клеточной неврологии. 10: 138. Дои:10.3389/fncel.2016.00138. ЧВК 4884741. PMID 27303269.
- ^ Weeber EJ, Beffert U, Jones C, Christian JM, Forster E, Sweatt JD, Herz J (October 2002). "Reelin and ApoE receptors cooperate to enhance hippocampal synaptic plasticity and learning". Журнал биологической химии. 277 (42): 39944–52. Дои:10.1074/jbc.M205147200. PMID 12167620.
- ^ а б D'Arcangelo G (August 2005). "Apoer2: a reelin receptor to remember". Нейрон. 47 (4): 471–3. Дои:10.1016/j.neuron.2005.08.001. PMID 16102527. S2CID 15091293.
- ^ а б Niu S, Renfro A, Quattrocchi CC, Sheldon M, D'Arcangelo G (January 2004). "Reelin promotes hippocampal dendrite development through the VLDLR/ApoER2-Dab1 pathway". Нейрон. 41 (1): 71–84. Дои:10.1016/S0896-6273(03)00819-5. PMID 14715136. S2CID 10716252.
- ^ Niu S, Yabut O, D'Arcangelo G (October 2008). "The Reelin signaling pathway promotes dendritic spine development in hippocampal neurons". Журнал неврологии. 28 (41): 10339–48. Дои:10.1523/JNEUROSCI.1917-08.2008. ЧВК 2572775. PMID 18842893.
- ^ а б "Tissue expression of RELN - Summary - The Human Protein Atlas". www.proteinatlas.org. Получено 28 мая 2018.
- ^ а б Fatemi SH, Earle JA, McMenomy T (November 2000). "Reduction in Reelin immunoreactivity in hippocampus of subjects with schizophrenia, bipolar disorder and major depression". Молекулярная психиатрия. 5 (6): 654–63, 571. Дои:10.1038/sj.mp.4000783. PMID 11126396.
- ^ а б Grayson DR, Guidotti A, Costa E (17 January 2008). "Current Hypotheses". Schizophrenia Research Forum. schizophreniaforum.org. Архивировано из оригинал 17 сентября 2008 г.. Получено 23 августа 2008.
- ^ Tochigi M, Iwamoto K, Bundo M, Komori A, Sasaki T, Kato N, Kato T (March 2008). "Methylation status of the reelin promoter region in the brain of schizophrenic patients". Биологическая психиатрия. 63 (5): 530–3. Дои:10.1016/j.biopsych.2007.07.003. PMID 17870056. S2CID 11816759.
- ^ Mill J, Tang T, Kaminsky Z, Khare T, Yazdanpanah S, Bouchard L, Jia P, Assadzadeh A, Flanagan J, Schumacher A, Wang SC, Petronis A (March 2008). "Epigenomic profiling reveals DNA-methylation changes associated with major psychosis". Американский журнал генетики человека. 82 (3): 696–711. Дои:10.1016/j.ajhg.2008.01.008. ЧВК 2427301. PMID 18319075.
- ^ а б Falconer DS (January 1951). "Two new mutants, 'trembler' and 'reeler', with neurological actions in the house mouse (Mus musculus L.)" (PDF). Журнал генетики. 50 (2): 192–201. Дои:10.1007/BF02996215. PMID 24539699. S2CID 37918631.
- ^ Tueting P, Doueiri MS, Guidotti A, Davis JM, Costa E (2006). "Reelin down-regulation in mice and psychosis endophenotypes". Неврология и биоповеденческие обзоры. 30 (8): 1065–77. Дои:10.1016/j.neubiorev.2006.04.001. PMID 16769115. S2CID 21156214.
- ^ Hamburgh M (October 1963). "Analysis of the postnatal developmental effects of "reeler," a neurological mutation in mice. A study in developmental genetics". Биология развития. 8 (2): 165–85. Дои:10.1016/0012-1606(63)90040-X. PMID 14069672.
- ^ Caviness VS (December 1976). "Patterns of cell and fiber distribution in the neocortex of the reeler mutant mouse". Журнал сравнительной неврологии. 170 (4): 435–47. Дои:10.1002/cne.901700404. PMID 1002868. S2CID 34383977.
- ^ Miao GG, Smeyne RJ, D'Arcangelo G, Copeland NG, Jenkins NA, Morgan JI, Curran T (November 1994). "Isolation of an allele of reeler by insertional mutagenesis". Труды Национальной академии наук Соединенных Штатов Америки. 91 (23): 11050–4. Bibcode:1994PNAS...9111050M. Дои:10.1073/pnas.91.23.11050. ЧВК 45164. PMID 7972007.
- ^ D'Arcangelo G, Miao GG, Chen SC, Soares HD, Morgan JI, Curran T (April 1995). "A protein related to extracellular matrix proteins deleted in the mouse mutant reeler". Природа. 374 (6524): 719–23. Bibcode:1995Natur.374..719D. Дои:10.1038/374719a0. PMID 7715726. S2CID 4266946.
- ^ Ogawa M, Miyata T, Nakajima K, Yagyu K, Seike M, Ikenaka K, Yamamoto H, Mikoshiba K (May 1995). "The reeler gene-associated antigen on Cajal-Retzius neurons is a crucial molecule for laminar organization of cortical neurons". Нейрон. 14 (5): 899–912. Дои:10.1016/0896-6273(95)90329-1. PMID 7748558. S2CID 17993812.
- ^ Trommsdorff M, Borg JP, Margolis B, Herz J (December 1998). "Interaction of cytosolic adaptor proteins with neuronal apolipoprotein E receptors and the amyloid precursor protein". Журнал биологической химии. 273 (50): 33556–60. Дои:10.1074/jbc.273.50.33556. PMID 9837937.
- ^ Trommsdorff M, Gotthardt M, Hiesberger T, Shelton J, Stockinger W, Nimpf J, Hammer RE, Richardson JA, Herz J (June 1999). "Reeler/Disabled-like disruption of neuronal migration in knockout mice lacking the VLDL receptor and ApoE receptor 2". Клетка. 97 (6): 689–701. Дои:10.1016/S0092-8674(00)80782-5. PMID 10380922. S2CID 13492626.
- ^ Sheldon M, Rice DS, D'Arcangelo G, Yoneshima H, Nakajima K, Mikoshiba K, Howell BW, Cooper JA, Goldowitz D, Curran T (October 1997). "Scrambler and yotari disrupt the disabled gene and produce a reeler-like phenotype in mice". Природа. 389 (6652): 730–3. Bibcode:1997Natur.389..730S. Дои:10.1038/39601. PMID 9338784. S2CID 4414738.
- ^ "Reelin" mentioned in the titles of scientific literature – a search in the Google ученый
- ^ а б c d е Hossein S. Fatemi, ed. (2008). Reelin Glycoprotein: Structure, Biology and Roles in Health and Disease. Springer. п. 444. ISBN 978-0-387-76760-4.
- ^ Lacor PN, Grayson DR, Auta J, Sugaya I, Costa E, Guidotti A (March 2000). "Reelin secretion from glutamatergic neurons in culture is independent from neurotransmitter regulation". Труды Национальной академии наук Соединенных Штатов Америки. 97 (7): 3556–61. Bibcode:2000PNAS...97.3556L. Дои:10.1073/pnas.050589597. ЧВК 16278. PMID 10725375.
- ^ Meyer G, Goffinet AM, Fairén A (December 1999). "What is a Cajal-Retzius cell? A reassessment of a classical cell type based on recent observations in the developing neocortex". Кора головного мозга. 9 (8): 765–75. Дои:10.1093/cercor/9.8.765. PMID 10600995.
- ^ а б Meyer G, Goffinet AM (July 1998). "Prenatal development of reelin-immunoreactive neurons in the human neocortex". Журнал сравнительной неврологии. 397 (1): 29–40. Дои:10.1002/(SICI)1096-9861(19980720)397:1<29::AID-CNE3>3.3.CO;2-7. PMID 9671277.
- ^ Schiffmann SN, Bernier B, Goffinet AM (May 1997). "Reelin mRNA expression during mouse brain development". Европейский журнал нейробиологии. 9 (5): 1055–71. Дои:10.1111/j.1460-9568.1997.tb01456.x. PMID 9182958. S2CID 22576790.
- ^ Pesold C, Impagnatiello F, Pisu MG, Uzunov DP, Costa E, Guidotti A, Caruncho HJ (March 1998). "Reelin is preferentially expressed in neurons synthesizing gamma-aminobutyric acid in cortex and hippocampus of adult rats". Труды Национальной академии наук Соединенных Штатов Америки. 95 (6): 3221–6. Bibcode:1998PNAS...95.3221P. Дои:10.1073/pnas.95.6.3221. ЧВК 19723. PMID 9501244.
- ^ Alcántara S, Ruiz M, D'Arcangelo G, Ezan F, de Lecea L, Curran T, Sotelo C, Soriano E (October 1998). "Regional and cellular patterns of reelin mRNA expression in the forebrain of the developing and adult mouse". Журнал неврологии. 18 (19): 7779–99. Дои:10.1523/JNEUROSCI.18-19-07779.1998. ЧВК 6792998. PMID 9742148.
- ^ Pesold C, Liu WS, Guidotti A, Costa E, Caruncho HJ (March 1999). "Cortical bitufted, horizontal, and Martinotti cells preferentially express and secrete reelin into perineuronal nets, nonsynaptically modulating gene expression". Труды Национальной академии наук Соединенных Штатов Америки. 96 (6): 3217–22. Bibcode:1999PNAS...96.3217P. Дои:10.1073/pnas.96.6.3217. ЧВК 15922. PMID 10077664.
- ^ Suárez-Solá ML, González-Delgado FJ, Pueyo-Morlans M, Medina-Bolívar OC, Hernández-Acosta NC, González-Gómez M, Meyer G (2009). "Neurons in the white matter of the adult human neocortex". Границы нейроанатомии. 3: 7. Дои:10.3389/neuro.05.007.2009. ЧВК 2697018. PMID 19543540.
- ^ Smalheiser NR, Costa E, Guidotti A, Impagnatiello F, Auta J, Lacor P, Kriho V, Pappas GD (February 2000). "Expression of reelin in adult mammalian blood, liver, pituitary pars intermedia, and adrenal chromaffin cells". Труды Национальной академии наук Соединенных Штатов Америки. 97 (3): 1281–6. Bibcode:2000PNAS...97.1281S. Дои:10.1073/pnas.97.3.1281. ЧВК 15597. PMID 10655522.
- ^ Samama B, Boehm N (July 2005). "Reelin immunoreactivity in lymphatics and liver during development and adult life". Анатомическая запись, часть A: открытия в молекулярной, клеточной и эволюционной биологии. 285 (1): 595–9. Дои:10.1002/ar.a.20202. PMID 15912522.
- ^ а б Kobold D, Grundmann A, Piscaglia F, Eisenbach C, Neubauer K, Steffgen J, Ramadori G, Knittel T (May 2002). "Expression of reelin in hepatic stellate cells and during hepatic tissue repair: a novel marker for the differentiation of HSC from other liver myofibroblasts". Journal of Hepatology. 36 (5): 607–13. Дои:10.1016/S0168-8278(02)00050-8. PMID 11983443.
- ^ а б Pulido JS, Sugaya I, Comstock J, Sugaya K (June 2007). "Reelin expression is upregulated following ocular tissue injury". Архив клинической и экспериментальной офтальмологии Грефе. 245 (6): 889–93. Дои:10.1007/s00417-006-0458-4. PMID 17120005. S2CID 12397364.
- ^ Buchaille R, Couble ML, Magloire H, Bleicher F (сентябрь 2000 г.). "A substractive PCR-based cDNA library from human odontoblast cells: identification of novel genes expressed in tooth forming cells". Матричная биология. 19 (5): 421–30. Дои:10.1016 / S0945-053X (00) 00091-3. PMID 10980418.
- ^ Allard B, Magloire H, Couble ML, Maurin JC, Bleicher F (September 2006). "Voltage-gated sodium channels confer excitability to human odontoblasts: possible role in tooth pain transmission". Журнал биологической химии. 281 (39): 29002–10. Дои:10.1074/jbc.M601020200. PMID 16831873.
- ^ Маурин Дж. К., Кубл М. Л., Дидье-Баз М., Бриссон С., Маглуар Н., Блейхер Ф. (август 2004 г.). «Экспрессия и локализация рилина в одонтобластах человека». Матричная биология. 23 (5): 277–85. Дои:10.1016 / j.matbio.2004.06.005. PMID 15464360.
- ^ PDB: 2E26; Yasui N, Nogi T, Kitao T, Nakano Y, Hattori M, Takagi J (June 2007). "Structure of a receptor-binding fragment of reelin and mutational analysis reveal a recognition mechanism similar to endocytic receptors". Труды Национальной академии наук Соединенных Штатов Америки. 104 (24): 9988–93. Bibcode:2007PNAS..104.9988Y. Дои:10.1073/pnas.0700438104. ЧВК 1891246. PMID 17548821.
- ^ а б Quattrocchi CC, Wannenes F, Persico AM, Ciafré SA, D'Arcangelo G, Farace MG, Keller F (January 2002). "Reelin is a serine protease of the extracellular matrix". Журнал биологической химии. 277 (1): 303–9. Дои:10.1074/jbc.M106996200. PMID 11689558.
- ^ а б Royaux I, Lambert de Rouvroit C, D'Arcangelo G, Demirov D, Goffinet AM (December 1997). "Genomic organization of the mouse reelin gene". Геномика. 46 (2): 240–50. Дои:10.1006/geno.1997.4983. PMID 9417911.
- ^ PDB: 2ddu; Nogi T, Yasui N, Hattori M, Iwasaki K, Takagi J (August 2006). "Structure of a signaling-competent reelin fragment revealed by X-ray crystallography and electron tomography". Журнал EMBO. 25 (15): 3675–83. Дои:10.1038/sj.emboj.7601240. ЧВК 1538547. PMID 16858396.
- ^ Nakano Y, Kohno T, Hibi T, Kohno S, Baba A, Mikoshiba K, Nakajima K, Hattori M (July 2007). "The extremely conserved C-terminal region of Reelin is not necessary for secretion but is required for efficient activation of downstream signaling". Журнал биологической химии. 282 (28): 20544–52. Дои:10.1074/jbc.M702300200. PMID 17504759.
- ^ Lambert de Rouvroit C, de Bergeyck V, Cortvrindt C, Bar I, Eeckhout Y, Goffinet AM (March 1999). "Reelin, the extracellular matrix protein deficient in reeler mutant mice, is processed by a metalloproteinase". Экспериментальная неврология. 156 (1): 214–7. Дои:10.1006/exnr.1998.7007. PMID 10192793. S2CID 35222830.
- ^ а б c Jossin Y, Ignatova N, Hiesberger T, Herz J, Lambert de Rouvroit C, Goffinet AM (January 2004). "The central fragment of Reelin, generated by proteolytic processing in vivo, is critical to its function during cortical plate development". Журнал неврологии. 24 (2): 514–21. Дои:10.1523/JNEUROSCI.3408-03.2004. ЧВК 6730001. PMID 14724251.
- ^ а б c Jossin Y, Gui L, Goffinet AM (April 2007). "Processing of Reelin by embryonic neurons is important for function in tissue but not in dissociated cultured neurons". Журнал неврологии. 27 (16): 4243–52. Дои:10.1523/JNEUROSCI.0023-07.2007. ЧВК 6672330. PMID 17442808.
- ^ а б Blake SM, Strasser V, Andrade N, Duit S, Hofbauer R, Schneider WJ, Nimpf J (November 2008). "Thrombospondin-1 binds to ApoER2 and VLDL receptor and functions in postnatal neuronal migration". Журнал EMBO. 27 (22): 3069–80. Дои:10.1038/emboj.2008.223. ЧВК 2585172. PMID 18946489.
- ^ Lennington JB, Yang Z, Conover JC (November 2003). "Neural stem cells and the regulation of adult neurogenesis". Репродуктивная биология и эндокринология. 1: 99. Дои:10.1186/1477-7827-1-99. ЧВК 293430. PMID 14614786.
- ^ а б Hartfuss E, Förster E, Bock HH, Hack MA, Leprince P, Luque JM, Herz J, Frotscher M, Götz M (October 2003). "Reelin signaling directly affects radial glia morphology and biochemical maturation". Разработка. 130 (19): 4597–609. Дои:10.1242/dev.00654. PMID 12925587.
- ^ а б c d е Nomura T, Takahashi M, Hara Y, Osumi N (January 2008). Рех Т. (ред.). "Patterns of neurogenesis and amplitude of Reelin expression are essential for making a mammalian-type cortex". PLOS ONE. 3 (1): e1454. Bibcode:2008PLoSO...3.1454N. Дои:10.1371/journal.pone.0001454. ЧВК 2175532. PMID 18197264.
- ^ Del Río JA, Heimrich B, Borrell V, Förster E, Drakew A, Alcántara S, Nakajima K, Miyata T, Ogawa M, Mikoshiba K, Derer P, Frotscher M, Soriano E (January 1997). "A role for Cajal-Retzius cells and reelin in the development of hippocampal connections". Природа. 385 (6611): 70–4. Bibcode:1997Natur.385...70D. Дои:10.1038/385070a0. PMID 8985248. S2CID 4352996.
- ^ Borrell V, Del Río JA, Alcántara S, Derer M, Martínez A, D'Arcangelo G, Nakajima K, Mikoshiba K, Derer P, Curran T, Soriano E (February 1999). "Reelin regulates the development and synaptogenesis of the layer-specific entorhino-hippocampal connections". Журнал неврологии. 19 (4): 1345–58. Дои:10.1523/JNEUROSCI.19-04-01345.1999. ЧВК 6786030. PMID 9952412.
- ^ а б Hack I, Bancila M, Loulier K, Carroll P, Cremer H (October 2002). "Reelin is a detachment signal in tangential chain-migration during postnatal neurogenesis". Природа Неврология. 5 (10): 939–45. Дои:10.1038/nn923. PMID 12244323. S2CID 7096018.
- ^ а б c Yoshida M, Assimacopoulos S, Jones KR, Grove EA (February 2006). "Massive loss of Cajal-Retzius cells does not disrupt neocortical layer order". Разработка. 133 (3): 537–45. Дои:10.1242/dev.02209. PMID 16410414.
- ^ Yip YP, Mehta N, Magdaleno S, Curran T, Yip JW (July 2009). "Ectopic expression of reelin alters migration of sympathetic preganglionic neurons in the spinal cord". Журнал сравнительной неврологии. 515 (2): 260–8. Дои:10.1002/cne.22044. PMID 19412957. S2CID 21832778.
- ^ а б Campo CG, Sinagra M, Verrier D, Manzoni OJ, Chavis P (2009). Okazawa H (ed.). "Reelin secreted by GABAergic neurons regulates glutamate receptor homeostasis". PLOS ONE. 4 (5): e5505. Bibcode:2009PLoSO...4.5505C. Дои:10.1371/journal.pone.0005505. ЧВК 2675077. PMID 19430527.
- ^ INSERM – Olivier Manzoni – Physiopathology of Synaptic Transmission and Plasticity В архиве 25 November 2006 at the Wayback Machine – Bordo neuroscience institute.
- ^ Sinagra M, Verrier D, Frankova D, Korwek KM, Blahos J, Weeber EJ, Manzoni OJ, Chavis P (June 2005). "Reelin, very-low-density lipoprotein receptor, and apolipoprotein E receptor 2 control somatic NMDA receptor composition during hippocampal maturation in vitro". Журнал неврологии. 25 (26): 6127–36. Дои:10.1523/JNEUROSCI.1757-05.2005. ЧВК 6725049. PMID 15987942.
- ^ а б Groc L, Choquet D, Stephenson FA, Verrier D, Manzoni OJ, Chavis P (September 2007). "NMDA receptor surface trafficking and synaptic subunit composition are developmentally regulated by the extracellular matrix protein Reelin". Журнал неврологии. 27 (38): 10165–75. Дои:10.1523/JNEUROSCI.1772-07.2007. ЧВК 6672660. PMID 17881522.
- ^ Liu XB, Murray KD, Jones EG (October 2004). "Switching of NMDA receptor 2A and 2B subunits at thalamic and cortical synapses during early postnatal development". Журнал неврологии. 24 (40): 8885–95. Дои:10.1523/JNEUROSCI.2476-04.2004. ЧВК 6729956. PMID 15470155.
- ^ Andrade N, Komnenovic V, Blake SM, Jossin Y, Howell B, Goffinet A, Schneider WJ, Nimpf J (May 2007). "ApoER2/VLDL receptor and Dab1 in the rostral migratory stream function in postnatal neuronal migration independently of Reelin". Труды Национальной академии наук Соединенных Штатов Америки. 104 (20): 8508–13. Bibcode:2007PNAS..104.8508A. Дои:10.1073/pnas.0611391104. ЧВК 1895980. PMID 17494763.
- ^ Frotscher M, Haas CA, Förster E (June 2003). "Reelin controls granule cell migration in the dentate gyrus by acting on the radial glial scaffold". Кора головного мозга. 13 (6): 634–40. Дои:10.1093/cercor/13.6.634. PMID 12764039.
- ^ Bar I, Lambert de Rouvroit C, Goffinet AM (December 2000). "The evolution of cortical development. An hypothesis based on the role of the Reelin signaling pathway". Тенденции в неврологии. 23 (12): 633–8. Дои:10.1016/S0166-2236(00)01675-1. PMID 11137154. S2CID 13568642.
- ^ Molnár Z, Métin C, Stoykova A, Tarabykin V, Price DJ, Francis F, Meyer G, Dehay C, Kennedy H (February 2006). "Comparative aspects of cerebral cortical development". Европейский журнал нейробиологии. 23 (4): 921–34. Дои:10.1111/j.1460-9568.2006.04611.x. ЧВК 1931431. PMID 16519657.
- ^ а б Pérez-García CG, González-Delgado FJ, Suárez-Solá ML, Castro-Fuentes R, Martín-Trujillo JM, Ferres-Torres R, Meyer G (January 2001). "Reelin-immunoreactive neurons in the adult vertebrate pallium". Журнал химической нейроанатомии. 21 (1): 41–51. Дои:10.1016/S0891-0618(00)00104-6. PMID 11173219. S2CID 23395046.
- ^ Costagli A, Kapsimali M, Wilson SW, Mione M (August 2002). "Conserved and divergent patterns of Reelin expression in the zebrafish central nervous system". Журнал сравнительной неврологии. 450 (1): 73–93. Дои:10.1002/cne.10292. PMID 12124768. S2CID 23110916.
- ^ Goffinet AM (November 2006). "What makes us human? A biased view from the perspective of comparative embryology and mouse genetics". Journal of Biomedical Discovery and Collaboration. 1: 16. Дои:10.1186/1747-5333-1-16. ЧВК 1769396. PMID 17132178.
- ^ Pollard KS, Salama SR, Lambert N, Lambot MA, Coppens S, Pedersen JS, Katzman S, King B, Onodera C, Siepel A, Kern AD, Dehay C, Igel H, Ares M, Vanderhaeghen P, Haussler D (September 2006). "An RNA gene expressed during cortical development evolved rapidly in humans" (PDF). Природа. 443 (7108): 167–72. Bibcode:2006Natur.443..167P. Дои:10.1038/nature05113. PMID 16915236. S2CID 18107797.
- ^ Williamson SH, Hubisz MJ, Clark AG, Payseur BA, Bustamante CD, Nielsen R (June 2007). "Localizing recent adaptive evolution in the human genome". PLOS Genetics. 3 (6): e90. Дои:10.1371/journal.pgen.0030090. ЧВК 1885279. PMID 17542651.
- ^ Wade N (26 June 2007). "Humans Have Spread Globally, and Evolved Locally". Нью-Йорк Таймс. Получено 23 августа 2008.
- ^ а б Zhang G, Assadi AH, McNeil RS, Beffert U, Wynshaw-Boris A, Herz J, Clark GD, D'Arcangelo G (February 2007). Mueller U (ed.). "The Pafah1b complex interacts with the reelin receptor VLDLR". PLOS ONE. 2 (2): e252. Bibcode:2007PLoSO...2..252Z. Дои:10.1371/journal.pone.0000252. ЧВК 1800349. PMID 17330141.
- ^ D'Arcangelo G, Homayouni R, Keshvara L, Rice DS, Sheldon M, Curran T (October 1999). "Reelin is a ligand for lipoprotein receptors". Нейрон. 24 (2): 471–9. Дои:10.1016/S0896-6273(00)80860-0. PMID 10571240. S2CID 14631418.
- ^ Hiesberger T, Trommsdorff M, Howell BW, Goffinet A, Mumby MC, Cooper JA, Herz J (October 1999). "Direct binding of Reelin to VLDL receptor and ApoE receptor 2 induces tyrosine phosphorylation of disabled-1 and modulates tau phosphorylation". Нейрон. 24 (2): 481–9. Дои:10.1016/S0896-6273(00)80861-2. PMID 10571241. S2CID 243043.
- ^ Andersen OM, Benhayon D, Curran T, Willnow TE (August 2003). "Differential binding of ligands to the apolipoprotein E receptor 2". Биохимия. 42 (31): 9355–64. Дои:10.1021/bi034475p. PMID 12899622.
- ^ Benhayon D, Magdaleno S, Curran T (April 2003). "Binding of purified Reelin to ApoER2 and VLDLR mediates tyrosine phosphorylation of Disabled-1". Brain Research. Молекулярные исследования мозга. 112 (1–2): 33–45. Дои:10.1016/S0169-328X(03)00032-9. PMID 12670700.
- ^ Hack I, Hellwig S, Junghans D, Brunne B, Bock HH, Zhao S, Frotscher M (November 2007). "Divergent roles of ApoER2 and Vldlr in the migration of cortical neurons". Разработка. 134 (21): 3883–91. Дои:10.1242/dev.005447. PMID 17913789.
- ^ Schmid RS, Jo R, Shelton S, Kreidberg JA, Anton ES (October 2005). "Reelin, integrin and DAB1 interactions during embryonic cerebral cortical development". Кора головного мозга. 15 (10): 1632–6. Дои:10.1093/cercor/bhi041. PMID 15703255.
- ^ Senzaki K, Ogawa M, Yagi T (December 1999). «Белки семейства CNR являются множественными рецепторами рилина». Клетка. 99 (6): 635–47. Дои:10.1016 / S0092-8674 (00) 81552-4. PMID 10612399. S2CID 14277878.
- ^ Hibi T, Hattori M (April 2009). "The N-terminal fragment of Reelin is generated after endocytosis and released through the pathway regulated by Rab11". Письма FEBS. 583 (8): 1299–303. Дои:10.1016/j.febslet.2009.03.024. PMID 19303411. S2CID 43542615.
- ^ Chameau P, Inta D, Vitalis T, Monyer H, Wadman WJ, van Hooft JA (April 2009). "The N-terminal region of reelin regulates postnatal dendritic maturation of cortical pyramidal neurons". Труды Национальной академии наук Соединенных Штатов Америки. 106 (17): 7227–32. Bibcode:2009PNAS..106.7227C. Дои:10.1073/pnas.0810764106. ЧВК 2678467. PMID 19366679.
- ^ Belvindrah R, Graus-Porta D, Goebbels S, Nave KA, Müller U (December 2007). "Beta1 integrins in radial glia but not in migrating neurons are essential for the formation of cell layers in the cerebral cortex". Журнал неврологии. 27 (50): 13854–65. Дои:10.1523/JNEUROSCI.4494-07.2007. ЧВК 6673609. PMID 18077697.
- ^ Beffert U, Weeber EJ, Durudas A, Qiu S, Masiulis I, Sweatt JD, Li WP, Adelmann G, Frotscher M, Hammer RE, Herz J (August 2005). "Modulation of synaptic plasticity and memory by Reelin involves differential splicing of the lipoprotein receptor Apoer2" (PDF). Нейрон. 47 (4): 567–79. Дои:10.1016/j.neuron.2005.07.007. PMID 16102539. S2CID 5854936. Архивировано из оригинал (PDF) 30 сентября 2007 г.. Получено 19 мая 2007.
- ^ Miller CA, Sweatt JD (March 2007). "Covalent modification of DNA regulates memory formation". Нейрон. 53 (6): 857–69. Дои:10.1016/j.neuron.2007.02.022. PMID 17359920. S2CID 62791264.
- ^ а б Matsuki T, Pramatarova A, Howell BW (June 2008). "Reduction of Crk and CrkL expression blocks reelin-induced dendritogenesis". Журнал клеточной науки. 121 (11): 1869–75. Дои:10.1242/jcs.027334. ЧВК 2430739. PMID 18477607.
- ^ Ballif BA, Arnaud L, Arthur WT, Guris D, Imamoto A, Cooper JA (April 2004). "Activation of a Dab1/CrkL/C3G/Rap1 pathway in Reelin-stimulated neurons". Текущая биология. 14 (7): 606–10. Дои:10.1016/j.cub.2004.03.038. PMID 15062102. S2CID 52887334.
- ^ Park TJ, Curran T (December 2008). "Crk and Crk-like play essential overlapping roles downstream of disabled-1 in the Reelin pathway". Журнал неврологии. 28 (50): 13551–62. Дои:10.1523/JNEUROSCI.4323-08.2008. ЧВК 2628718. PMID 19074029.
- ^ а б Keilani S, Sugaya K (July 2008). "Reelin induces a radial glial phenotype in human neural progenitor cells by activation of Notch-1". Биология развития BMC. 8 (1): 69. Дои:10.1186/1471-213X-8-69. ЧВК 2447831. PMID 18593473.
- ^ Lugli G, Krueger JM, Davis JM, Persico AM, Keller F, Smalheiser NR (September 2003). "Methodological factors influencing measurement and processing of plasma reelin in humans". BMC Biochemistry. 4: 9. Дои:10.1186/1471-2091-4-9. ЧВК 200967. PMID 12959647.
- ^ Howell BW, Gertler FB, Cooper JA (January 1997). "Mouse disabled (mDab1): a Src binding protein implicated in neuronal development". Журнал EMBO. 16 (1): 121–32. Дои:10.1093/emboj/16.1.121. ЧВК 1169619. PMID 9009273.
- ^ Arnaud L, Ballif BA, Förster E, Cooper JA (January 2003). "Fyn tyrosine kinase is a critical regulator of disabled-1 during brain development". Текущая биология. 13 (1): 9–17. Дои:10.1016/S0960-9822(02)01397-0. PMID 12526739. S2CID 1739505.
- ^ Feng L, Allen NS, Simo S, Cooper JA (November 2007). "Cullin 5 regulates Dab1 protein levels and neuron positioning during cortical development". Гены и развитие. 21 (21): 2717–30. Дои:10.1101/gad.1604207. ЧВК 2045127. PMID 17974915.
- ^ Kerjan G, Gleeson JG (November 2007). "A missed exit: Reelin sets in motion Dab1 polyubiquitination to put the break on neuronal migration". Гены и развитие. 21 (22): 2850–4. Дои:10.1101/gad.1622907. PMID 18006681.
- ^ Utsunomiya-Tate N, Kubo K, Tate S, Kainosho M, Katayama E, Nakajima K, Mikoshiba K (August 2000). "Reelin molecules assemble together to form a large protein complex, which is inhibited by the function-blocking CR-50 antibody". Труды Национальной академии наук Соединенных Штатов Америки. 97 (17): 9729–34. Bibcode:2000PNAS...97.9729U. Дои:10.1073/pnas.160272497. ЧВК 16933. PMID 10920200.
- ^ Kubo K, Mikoshiba K, Nakajima K (August 2002). "Secreted Reelin molecules form homodimers". Нейробиологические исследования. 43 (4): 381–8. Дои:10.1016/S0168-0102(02)00068-8. PMID 12135781. S2CID 10656560.
- ^ а б Strasser V, Fasching D, Hauser C, Mayer H, Bock HH, Hiesberger T, Herz J, Weeber EJ, Sweatt JD, Pramatarova A, Howell B, Schneider WJ, Nimpf J (February 2004). "Receptor clustering is involved in Reelin signaling". Молекулярная и клеточная биология. 24 (3): 1378–86. Дои:10.1128/MCB.24.3.1378-1386.2004. ЧВК 321426. PMID 14729980.
- ^ Chai X, Förster E, Zhao S, Bock HH, Frotscher M (January 2009). "Reelin stabilizes the actin cytoskeleton of neuronal processes by inducing n-cofilin phosphorylation at serine3". Журнал неврологии. 29 (1): 288–99. Дои:10.1523/JNEUROSCI.2934-08.2009. ЧВК 6664910. PMID 19129405.
- ^ Frotscher M, Chai X, Bock HH, Haas CA, Förster E, Zhao S (November 2009). "Role of Reelin in the development and maintenance of cortical lamination". Журнал нейронной передачи. 116 (11): 1451–5. Дои:10.1007/s00702-009-0228-7. PMID 19396394. S2CID 1310387.
- ^ Arnaud L, Ballif BA, Cooper JA (December 2003). "Regulation of protein tyrosine kinase signaling by substrate degradation during brain development". Молекулярная и клеточная биология. 23 (24): 9293–302. Дои:10.1128/MCB.23.24.9293-9302.2003. ЧВК 309695. PMID 14645539.
- ^ Ohshima T, Suzuki H, Morimura T, Ogawa M, Mikoshiba K (April 2007). "Modulation of Reelin signaling by Cyclin-dependent kinase 5". Исследование мозга. 1140: 84–95. Дои:10.1016/j.brainres.2006.01.121. PMID 16529723. S2CID 23991327.
- ^ Keshvara L, Magdaleno S, Benhayon D, Curran T (June 2002). "Cyclin-dependent kinase 5 phosphorylates disabled 1 independently of Reelin signaling". Журнал неврологии. 22 (12): 4869–77. Дои:10.1523/JNEUROSCI.22-12-04869.2002. ЧВК 6757745. PMID 12077184.
- ^ Kobayashi S, Ishiguro K, Omori A, Takamatsu M, Arioka M, Imahori K, Uchida T (December 1993). «Связанная с cdc2 киназа PSSALRE / cdk5 гомологична 30 кДа субъединице тау-протеинкиназы II, пролин-направленной протеинкиназы, связанной с микротрубочками». Письма FEBS. 335 (2): 171–5. Дои:10.1016/0014-5793(93)80723-8. PMID 8253190. S2CID 26474408.
- ^ Бефферт У., Морфини Дж., Бок Х. Х., Рейна Х., Брэди С. Т., Херц Дж. (Декабрь 2002 г.). «Рилин-опосредованная передача сигналов локально регулирует протеинкиназу B / Akt и киназу гликогенсинтазы 3beta». Журнал биологической химии. 277 (51): 49958–64. Дои:10.1074 / jbc.M209205200. PMID 12376533.
- ^ Сасаки С., Шионоя А., Исида М., Гамбелло М. Дж., Инлинг Дж., Виншоу-Борис А., Хироцунэ С. (декабрь 2000 г.). «Комплекс тяжелой цепи LIS1 / NUDEL / цитоплазматический динеин в развивающейся и взрослой нервной системе». Нейрон. 28 (3): 681–96. Дои:10.1016 / S0896-6273 (00) 00146-X. PMID 11163259. S2CID 17738599.
- ^ а б Бефферт У., Вибер Э.Дж., Морфини Дж., Ко Дж., Брэди С.Т., Цай Л.Х., Свитт Д.Д., Герц Дж. (Февраль 2004 г.) «Рилин и циклин-зависимая киназа 5-зависимые сигналы взаимодействуют в регуляции миграции нейронов и синаптической передачи». Журнал неврологии. 24 (8): 1897–906. Дои:10.1523 / JNEUROSCI.4084-03.2004. ЧВК 6730409. PMID 14985430.
- ^ Охима Т., Огава М., Хирасава М., Лонгенекер Дж., Исигуро К., Пант ХК, Брэди Р.О., Кулкарни А.Б., Микошиба К. (февраль 2001 г.). «Синергетический вклад циклин-зависимой киназы 5 / p35 и Reelin / Dab1 в расположение кортикальных нейронов в развивающемся мозге мыши». Труды Национальной академии наук Соединенных Штатов Америки. 98 (5): 2764–9. Bibcode:2001PNAS ... 98.2764O. Дои:10.1073 / pnas.051628498. ЧВК 30213. PMID 11226314.
- ^ Hong SE, Shugart YY, Huang DT, Shahwan SA, Grant PE, Hourihane JO, Martin ND, Walsh CA (сентябрь 2000 г.). «Аутосомно-рецессивная лиссэнцефалия с гипоплазией мозжечка связана с мутациями RELN человека». Природа Генетика. 26 (1): 93–6. Дои:10.1038/79246. PMID 10973257. S2CID 67748801.
- ^ Крино П. (ноябрь 2001 г.). «Новая мутация RELN, связанная с лиссэнцефалией и эпилепсией». Течение эпилепсии. 1 (2): 72–73. Дои:10.1046 / j.1535-7597.2001.00017.x. ЧВК 320825. PMID 15309195.
- ^ Заки М., Шехаб М., Эль-Алим А.А., Абдель-Салам Г., Келлер Х.Б., Илькин Ю., Росс М.Э., Добинс В.Б., Глисон Дж.Г. (май 2007 г.). «Идентификация новой рецессивной мутации RELN с использованием гомозиготной сбалансированной реципрокной транслокации». Американский журнал медицинской генетики. Часть А. 143A (9): 939–44. Дои:10.1002 / ajmg.a.31667. PMID 17431900. S2CID 19126812.
- ^ Импаньатиелло Ф., Гуидотти А.Р., Песолд С., Двиведи Й., Карунчо Х., Пису М.Г., Узунов Д.П., Смалхайзер Н.Р., Дэвис Дж. М., Пандей Г. Н., Папас Г. Д., Тютинг П., Шарма Р. П., Коста Е. (декабрь 1998 г.). «Снижение экспрессии рилина как предполагаемый фактор уязвимости при шизофрении». Труды Национальной академии наук Соединенных Штатов Америки. 95 (26): 15718–23. Bibcode:1998PNAS ... 9515718I. Дои:10.1073 / пнас.95.26.15718. ЧВК 28110. PMID 9861036.
- ^ а б Guidotti A, Auta J, Davis JM, Di-Giorgi-Gerevini V, Dwivedi Y, Grayson DR, Impagnatiello F, Pandey G, Pesold C, Sharma R, Uzunov D, Costa E, DiGiorgi Gerevini V (ноябрь 2000 г.). «Снижение экспрессии декарбоксилазы 67 (GAD67) рилина и глутаминовой кислоты при шизофрении и биполярном расстройстве: посмертное исследование мозга». Архив общей психиатрии. 57 (11): 1061–9. Дои:10.1001 / archpsyc.57.11.1061. PMID 11074872.
- ^ а б Fatemi SH, Hossein Fatemi S, Stary JM, Earle JA, Araghi-Niknam M, Eagan E (январь 2005 г.). «ГАМКергическая дисфункция при шизофрении и расстройствах настроения, что отражается в снижении уровней декарбоксилазы глутаминовой кислоты 65 и 67 кДа и белков рилина в мозжечке». Исследование шизофрении. 72 (2–3): 109–22. Дои:10.1016 / j.schres.2004.02.017. PMID 15560956. S2CID 35193802.
- ^ а б Велдич М., Кадриу Б., Малоку Е., Агис-Бальбоа Р.С., Гуидотти А., Дэвис Дж. М., Коста Е. (март 2007 г.). «Эпигенетические механизмы, выраженные в ГАМКергических нейронах базальных ганглиев, позволяют дифференцировать шизофрению от биполярного расстройства». Исследование шизофрении. 91 (1–3): 51–61. Дои:10.1016 / j.schres.2006.11.029. ЧВК 1876737. PMID 17270400.
- ^ Иствуд С.Л., Харрисон П.Дж. (сентябрь 2003 г.). «Интерстициальные нейроны белого вещества экспрессируют меньше рилина и аномально распределены при шизофрении: в направлении интеграции молекулярных и морфологических аспектов гипотезы развития нервной системы». Молекулярная психиатрия. 8 (9): 769, 821–31. Дои:10.1038 / sj.mp.4001371. PMID 12931209.
- ^ Abdolmaleky HM, Cheng KH, Russo A, Smith CL, Faraone SV, Wilcox M, Shafa R, Glatt SJ, Nguyen G, Ponte JF, Thiagalingam S, Tsuang MT (апрель 2005 г.). «Гиперметилирование промотора рилина (RELN) в головном мозге больных шизофренией: предварительный отчет». Американский журнал медицинской генетики. Часть B, Нейропсихиатрическая генетика. 134B (1): 60–6. Дои:10.1002 / ajmg.b.30140. PMID 15717292. S2CID 23169492.
- ^ Fatemi SH, Kroll JL, Stary JM (октябрь 2001 г.). «Измененные уровни Reelin и его изоформ при шизофрении и расстройствах настроения». NeuroReport. 12 (15): 3209–15. Дои:10.1097/00001756-200110290-00014. PMID 11711858. S2CID 43077109.
- ^ Knable MB, Торри EF, Webster MJ, Bartko JJ (июль 2001 г.). «Многовариантный анализ префронтальных кортикальных данных Консорциума невропатологии Фонда Стэнли». Бюллетень исследований мозга. 55 (5): 651–9. Дои:10.1016 / S0361-9230 (01) 00521-4. PMID 11576762. S2CID 23427111.
- ^ Грейсон Д.Р., Цзя X, Чен И, Шарма Р.П., Митчелл С.П., Гуидотти А., Коста Е. (июнь 2005 г.). «Гиперметилирование промотора рилина при шизофрении». Труды Национальной академии наук Соединенных Штатов Америки. 102 (26): 9341–6. Bibcode:2005PNAS..102.9341G. Дои:10.1073 / pnas.0503736102. ЧВК 1166626. PMID 15961543.
- ^ Донг Э., Аджис-Бальбоа Р.С., Симонини М.В., Грейсон Д.Р., Коста Э., Гуидотти А. (август 2005 г.). «Ремоделирование промотора декарбоксилазы 67 рилина и глутаминовой кислоты в мышиной эпигенетической модели шизофрении, индуцированной метионином». Труды Национальной академии наук Соединенных Штатов Америки. 102 (35): 12578–83. Bibcode:2005PNAS..10212578D. Дои:10.1073 / pnas.0505394102. ЧВК 1194936. PMID 16113080.
- ^ Поллин В., Кардон П.В., Кети С.С. (январь 1961 г.). «Эффекты кормления аминокислотами у больных шизофренией, получавших ипрониазид». Наука. 133 (3446): 104–5. Bibcode:1961Научный ... 133..104П. Дои:10.1126 / science.133.3446.104. PMID 13736870. S2CID 32080078.
- ^ Брун Г.Г., Химвич Х.Э. (май 1962 г.). «Влияние нагрузки метионином на поведение больных шизофренией». Журнал нервных и психических заболеваний. 134 (5): 447–50. Дои:10.1097/00005053-196205000-00007. PMID 13873983. S2CID 46617457.
- ^ Park LC, Baldessarini RJ, Kety SS (апрель 1965 г.). «Эффекты метионина на хронических шизофреников». Архив общей психиатрии. 12 (4): 346–51. Дои:10.1001 / archpsyc.1965.01720340018003. PMID 14258360.
- ^ Antun FT, Burnett GB, Cooper AJ, Daly RJ, Smythies JR, Zealley AK (июнь 1971 г.). «Эффекты L-метионина (без MAOI) при шизофрении». Журнал психиатрических исследований. 8 (2): 63–71. Дои:10.1016/0022-3956(71)90009-4. PMID 4932991.
- ^ Грейсон Д.Р., Чен Ю., Донг Э., Кундакович М., Гвидотти А. (апрель 2009 г.). «От транс-метилирования к метилированию цитозина: эволюция гипотезы метилирования шизофрении». Эпигенетика. 4 (3): 144–9. Дои:10.4161 / epi.4.3.8534. PMID 19395859.
- ^ Ружичка В.Б., Жуби А., Велдич М., Грейсон Д.Р., Коста Е., Гуидотти А. (апрель 2007 г.). «Селективное эпигенетическое изменение ГАМКергических нейронов слоя I, выделенных из префронтальной коры пациентов с шизофренией с помощью лазерной микродиссекции». Молекулярная психиатрия. 12 (4): 385–97. Дои:10.1038 / sj.mp.4001954. PMID 17264840.
- ^ Велдич М., Карунчо Х.Д., Лю В.С., Дэвис Дж., Сатта Р., Грейсон Д.Р., Гвидотти А., Коста Е. (январь 2004 г.). «МРНК ДНК-метилтрансферазы 1 избирательно сверхэкспрессируется в конечных ГАМКергических интернейронах головного мозга, страдающего шизофренией». Труды Национальной академии наук Соединенных Штатов Америки. 101 (1): 348–53. Bibcode:2004ПНАС..101..348В. Дои:10.1073 / пнас.2637013100. ЧВК 314188. PMID 14684836.
- ^ Велдич М., Гвидотти А., Малоку Е., Дэвис Дж. М., Коста Е. (февраль 2005 г.). «При психозе корковые интернейроны сверхэкспрессируют ДНК-метилтрансферазу 1». Труды Национальной академии наук Соединенных Штатов Америки. 102 (6): 2152–7. Bibcode:2005ПНАС..102.2152В. Дои:10.1073 / pnas.0409665102. ЧВК 548582. PMID 15684088.
- ^ Tremolizzo L, Doueiri MS, Dong E, Grayson DR, Davis J, Pinna G, Tueting P, Rodriguez-Menendez V, Costa E, Guidotti A (март 2005 г.). «Вальпроат корректирует подобные шизофрении эпигенетические модификации поведения мышей, вызванные метионином». Биологическая психиатрия. 57 (5): 500–9. Дои:10.1016 / j.biopsych.2004.11.046. PMID 15737665. S2CID 29868395.
- ^ Чен Ю., Шарма Р.П., Коста Р. Х., Коста Е., Грейсон Д. Р. (июль 2002 г.). «Об эпигенетической регуляции промотора рилина человека». Исследования нуклеиновых кислот. 30 (13): 2930–9. Дои:10.1093 / nar / gkf401. ЧВК 117056. PMID 12087179.
- ^ Митчелл С.П., Чен И., Кундакович М., Коста Е., Грейсон Д.Р. (апрель 2005 г.). «Ингибиторы гистон-деацетилазы уменьшают метилирование промотора рилина in vitro». Журнал нейрохимии. 93 (2): 483–92. Дои:10.1111 / j.1471-4159.2005.03040.x. PMID 15816871. S2CID 12445076.
- ^ Tremolizzo L, Carboni G, Ruzicka WB, Mitchell CP, Sugaya I, Tueting P, Sharma R, Grayson DR, Costa E, Guidotti A (декабрь 2002 г.). «Эпигенетическая модель мышей для молекулярных и поведенческих невропатологий, связанных с уязвимостью к шизофрении». Труды Национальной академии наук Соединенных Штатов Америки. 99 (26): 17095–100. Bibcode:2002PNAS ... 9917095T. Дои:10.1073 / pnas.262658999. ЧВК 139275. PMID 12481028.
- ^ Бенес Ф.М., Лим Б., Мацилевич Д., Уолш Дж. П., Суббураджу С., Миннс М. (июнь 2007 г.). «Регуляция фенотипа ГАМК-клеток в гиппокампе шизофреников и биполяров». Труды Национальной академии наук Соединенных Штатов Америки. 104 (24): 10164–9. Bibcode:2007ПНАС..10410164Б. Дои:10.1073 / pnas.0703806104. ЧВК 1888575. PMID 17553960.
- ^ Донг Э., Гвидотти А., Грейсон Д. Р., Коста Э (март 2007 г.). «Гиперацетилирование гистона вызывает деметилирование рилина и промоторов декарбоксилазы глутаминовой кислоты 67 кДа». Труды Национальной академии наук Соединенных Штатов Америки. 104 (11): 4676–81. Bibcode:2007PNAS..104.4676D. Дои:10.1073 / pnas.0700529104. ЧВК 1815468. PMID 17360583.
- ^ Кундакович М., Чен Й, Коста Э, Грейсон Д.Р. (март 2007 г.). «Ингибиторы ДНК-метилтрансферазы координированно индуцируют экспрессию генов декарбоксилазы 67 человека рилина и глутаминовой кислоты». Молекулярная фармакология. 71 (3): 644–53. Дои:10.1124 / моль.106.030635. PMID 17065238. S2CID 18421124.
- ^ Кундакович М., Чен Ю., Гвидотти А., Грейсон Д.Р. (февраль 2009 г.). «Промоторы рилина и GAD67 активируются эпигенетическими препаратами, которые способствуют разрушению локальных репрессорных комплексов». Молекулярная фармакология. 75 (2): 342–54. Дои:10,1124 / моль. 108,051763. ЧВК 2684898. PMID 19029285.
- ^ Guidotti A, Ruzicka W, Grayson DR, Veldic M, Pinna G, Davis JM, Costa E (январь 2007 г.). «Сверхэкспрессия мРНК S-аденозилметионина и ДНК-метилтрансферазы-1 при психозе». NeuroReport. 18 (1): 57–60. Дои:10.1097 / WNR.0b013e32800fefd7. PMID 17259861. S2CID 25378736.
- ^ а б Веденоя Дж., Лукола А., Туулио-Хенрикссон А., Паунио Т., Экелунд Дж., Силандер К., Варило Т., Хейккиля К., Сувисаари Дж., Партонен Т., Лённквист Дж., Пелтонен Л. (июль 2008 г.). «Репликация сцепления на хромосоме 7q22 и ассоциация регионального гена Reelin с рабочей памятью в семьях шизофрении». Молекулярная психиатрия. 13 (7): 673–84. Дои:10.1038 / sj.mp.4002047. PMID 17684500.
- ^ Шифман С., Йоханнессон М., Бронштейн М., Чен С. X., Кольер Д. А., Крэддок Н. Дж., Кендлер К. С., Ли Т., О'Донован М., О'Нил Ф. А., Оуэн М. Дж., Уолш Д., Вайнбергер Д. Р., Сан К., Флинт Дж., Дарваси А (февраль 2008 г.). «Общегеномная ассоциация выявляет общий вариант гена рилина, который увеличивает риск шизофрении только у женщин». PLOS Genetics. 4 (2): e28. Дои:10.1371 / journal.pgen.0040028. ЧВК 2242812. PMID 18282107. бесплатный полный текст
- ^ Веденоя Дж., Туулио-Хенрикссон А., Сувисаари Дж., Лукола А., Паунио Т., Партонен Т., Варило Т., Лённквист Дж., Пелтонен Л. (май 2010 г.). «Репликация ассоциации между рабочей памятью и рилином, потенциальным геном-модификатором при шизофрении». Биологическая психиатрия. 67 (10): 983–91. Дои:10.1016 / j.biopsych.2009.09.026. ЧВК 3083525. PMID 19922905.
- ^ Грегорио С.П., Sallet PC, До К.А., Лин Э., Гаттаз В.Ф., Диас-Нето Э. (январь 2009 г.). «Полиморфизмы генов, участвующих в развитии нервной системы, могут быть связаны с измененной морфологией мозга при шизофрении: предварительные доказательства». Психиатрические исследования. 165 (1–2): 1–9. Дои:10.1016 / j.psychres.2007.08.011. PMID 19054571. S2CID 43548414.
- ^ а б Судзуки К., Накамура К., Ивата И., Секин Ю., Кавай М., Сугихара Г., Цучия К.Дж., Суда С., Мацудзаки Н., Такей Н., Хашимото К., Мори Н. (январь 2008 г.). «Сниженная экспрессия рецептора рилина VLDLR в периферических лимфоцитах у больных шизофренией, не принимавших лекарства». Исследование шизофрении. 98 (1–3): 148–56. Дои:10.1016 / j.schres.2007.09.029. PMID 17936586. S2CID 45594329.
- ^ Sweet RA, Хентелефф Р.А., Чжан В., Сэмпсон А.Р., Льюис Д.А. (январь 2009 г.). «Снижение плотности дендритных шипов в слуховой коре у пациентов с шизофренией». Нейропсихофармакология. 34 (2): 374–89. Дои:10.1038 / npp.2008.67. ЧВК 2775717. PMID 18463626.
- ^ Гланц Л.А., Льюис Д.А. (январь 2000 г.). «Снижение плотности дендритных шипов на префронтальных кортикальных пирамидных нейронах при шизофрении». Архив общей психиатрии. 57 (1): 65–73. Дои:10.1001 / archpsyc.57.1.65. PMID 10632234.
- ^ Родригес М.А., Песолд С., Лю В.С., Крихо В., Гуидотти А., Паппас Г.Д., Коста Е. (март 2000 г.). «Совместная локализация рецепторов интегрина и рилина в постсинаптических плотностях дендритного позвоночника в коре головного мозга взрослых нечеловеческих приматов». Труды Национальной академии наук Соединенных Штатов Америки. 97 (7): 3550–5. Bibcode:2000PNAS ... 97.3550R. Дои:10.1073 / pnas.050589797. ЧВК 16277. PMID 10725376.
- ^ Коста Е., Дэвис Дж., Грейсон Д.Р., Гуидотти А., Папас Г.Д., Песолд С. (октябрь 2001 г.). «Гипопластичность дендритного отдела позвоночника и подавление релина и ГАМКергического тонуса при уязвимости к шизофрении». Нейробиология болезней. 8 (5): 723–42. Дои:10.1006 / nbdi.2001.0436. PMID 11592844. S2CID 31279244.
- ^ Камнасаран Д., Мьюир В.Дж., Фергюсон-Смит М.А., Кокс Д.В. (май 2003 г.). «Нарушение нейронального гена PAS3 в семье, страдающей шизофренией». Журнал медицинской генетики. 40 (5): 325–32. Дои:10.1136 / jmg.40.5.325. ЧВК 1735455. PMID 12746393.
- ^ Эрбель-Зилер К., Дадли С., Чжоу И., Ву Х, Эстилл С.Дж., Хан Т., Диас-Аррастия Р., Бранскилл Е.В., Поттер С.С., Макнайт С.Л. (сентябрь 2004 г.). «Поведенческие и регуляторные нарушения у мышей с дефицитом факторов транскрипции NPAS1 и NPAS3». Труды Национальной академии наук Соединенных Штатов Америки. 101 (37): 13648–53. Bibcode:2004PNAS..10113648E. Дои:10.1073 / pnas.0405310101. ЧВК 518807. PMID 15347806.
- ^ Чен З, Шван BC, Ву Кью, Хе Х, Розен Р. (август 2005 г.). «Постнатальные дефекты мозжечка у мышей с дефицитом метилентетрагидрофолатредуктазы». Международный журнал нейробиологии развития. 23 (5): 465–74. Дои:10.1016 / j.ijdevneu.2005.05.007. PMID 15979267. S2CID 37922852.
- ^ Обзор генов всех опубликованных исследований ассоциации шизофрении для GRIN2B В архиве 13 сентября 2010 г. Wayback Machine - База данных генов шизофрении.
- ^ а б Wang GS, Hong CJ, Yen TY, Huang HY, Ou Y, Huang TN, Jung WG, Kuo TY, Sheng M, Wang TF, Hsueh YP (апрель 2004 г.). «Транскрипционная модификация CASK-взаимодействующим белком сборки нуклеосом». Нейрон. 42 (1): 113–28. Дои:10.1016 / S0896-6273 (04) 00139-4. PMID 15066269. S2CID 14383387.
- ^ Подхорна Дж., Дидриксен М. (август 2004 г.). «Гетерозиготная мышь Reeler: поведенческий фенотип». Поведенческие исследования мозга. 153 (1): 43–54. Дои:10.1016 / j.bbr.2003.10.033. PMID 15219705. S2CID 538066.
- ^ Акбарян С., Ким Дж. Дж., Поткин С. Г., Хетрик В. П., Банни В. Е., Джонс Э. Г. (май 1996 г.). «Неправильное распределение интерстициальных нейронов в префронтальном белом веществе головного мозга больных шизофренией». Архив общей психиатрии. 53 (5): 425–36. Дои:10.1001 / archpsyc.1996.01830050061010. PMID 8624186.
- ^ Джоши Д., Фунг С.Дж., Ротвелл А., Вейкерт С.С. (ноябрь 2012 г.). «Повышенная плотность нейронов гамма-аминомасляной кислоты в белом веществе орбитальной лобной коры при шизофрении». Биологическая психиатрия. 72 (9): 725–33. Дои:10.1016 / j.biopsych.2012.06.021. PMID 22841514. S2CID 8400626.
- ^ а б c Matigian N, Abrahamsen G, Sutharsan R, Cook AL, Vitale AM, Nouwens A, Bellette B, An J, Anderson M, Beckhouse AG, Bennebroek M, Cecil R, Chalk AM, Cochrane J, Fan Y, Féron F, McCurdy R , МакГрат Дж. Дж., Муррелл В., Перри С., Раджу Дж., Равишанкар С., Силбурн П. А., Сазерленд Г. Т., Малер С., Меллик Г. Д., Вуд С. А., Сью С. М., Уэллс Калифорния, Маккей-Сим А (2010). «Специфичные для заболеваний клетки, происходящие из нейросферы, как модели нарушений мозга». Модели и механизмы заболеваний. 3 (11–12): 785–98. Дои:10.1242 / дмм.005447. PMID 20699480.
- ^ Topol A, Zhu S, Hartley BJ, English J, Hauberg ME, Tran N, Rittenhouse CA, Simone A, Ruderfer DM, Johnson J, Readhead B, Hadas Y, Gochman PA, Wang YC, Shah H, Cagney G, Rapoport J , Гейдж Ф. Х., Дадли Дж. Т., Склар П., Маттейзен М., Коттер Д., Фанг Дж., Бреннанд К. Дж. (Май 2016 г.). «Нарушение регуляции miRNA-9 в подгруппе нервных клеток-предшественников шизофрении, полученных от пациентов». Отчеты по ячейкам. 15 (5): 1024–1036. Дои:10.1016 / j.celrep.2016.03.090. ЧВК 4856588. PMID 27117414.
- ^ а б c d Ти Дж.Й., Сутарсан Р., Фан И, Маккей-Сим А (2016). «Клетки, полученные из обонятельной нейросферы, полученные от пациентов с шизофренией, не отвечают на внеклеточный рилин». NPJ Шизофрения. 2: 16027. Дои:10.1038 / npjschz.2016.27. ЧВК 4994154. PMID 27602387.
- ^ Goes FS, Willour VL, Zandi PP, Belmonte PL, MacKinnon DF, Mondimore FM, Schweizer B, DePaulo JR, Gershon ES, McMahon FJ, Potash JB (март 2010 г.). «Половая связь гена Reelin с биполярным расстройством». Американский журнал медицинской генетики. Часть B, Нейропсихиатрическая генетика. 153B (2): 549–553. Дои:10.1002 / ajmg.b.31018. ЧВК 3032172. PMID 19691043.
- ^ Ламмерт Д.Б., Хауэлл Б.В. (31 марта 2016 г.). «Мутации RELN при расстройствах аутистического спектра». Границы клеточной неврологии. 10 (84): 84. Дои:10.3389 / fncel.2016.00084. ЧВК 4814460. PMID 27064498.
- ^ Персико А.М., Д'Агрума Л., Майорано Н, Тотаро А, Милитерни Р., Браваччо С, Вассинк TH, Шнайдер С, Мелмед Р., Трилло С, Монтекки Ф, Палермо М, Паскуччи Т, Пуглиси-Аллегра С, Райхельт К.Л., Конциаторы М., Марино Р., Куатрокки С.К., Балди А., Зеланте Л., Гаспарини П., Келлер Ф. (март 2001 г.). «Аллели и гаплотипы гена рилина как фактор, предрасполагающий к аутистическому расстройству». Молекулярная психиатрия. 6 (2): 150–9. Дои:10.1038 / sj.mp.4000850. PMID 11317216.
- ^ Чжан Х., Лю Х., Чжан С., Мундо Э., Маккарди Ф., Грейсон Д.Р., Гуидотти А.Р., Холден Дж.Дж. (2002). «Аллели гена рилина и предрасположенность к расстройствам аутистического спектра». Молекулярная психиатрия. 7 (9): 1012–7. Дои:10.1038 / sj.mp.4001124. PMID 12399956.
- ^ Бонора Е., Бейер К.С., Лэмб Дж. А., Парр Дж. Р., Клаук С. М., Беннер А., Паолуччи М., Эбботт А., Рагусси I, Поустка А., Бейли А. Дж., Монако А. П. (октябрь 2003 г.). «Анализ рилина как гена-кандидата аутизма». Молекулярная психиатрия. 8 (10): 885–92. Дои:10.1038 / sj.mp.4001310. PMID 14515139.
- ^ Девлин Б., Беннет П., Доусон Г., Фиглевич Д.А., Григоренко Е.Л., МакМахон В., Миншью Н., Паулс Д., Смит М., Спенс М.А., Родье П.М., Стоджелл С., Шелленберг Г.Д. (апрель 2004 г.). «Аллели катушки CGG-повтора не указывают на опасность аутизма в образце из сети CPEA» (PDF). Американский журнал медицинской генетики. Часть B, Нейропсихиатрическая генетика. 126B (1): 46–50. Дои:10.1002 / ajmg.b.20125. PMID 15048647. S2CID 14966506.
- ^ Холт Р., Барнби Г., Маэстрини Е., Бакчелли Е., Броклебанк Д., Соуза И., Малдер Е. Дж., Кантоярви К., Ярвела И., Клаук С. М., Поустка Ф, Бейли А. Дж., Монако AP (сентябрь 2010 г.). «Связь и исследования генов-кандидатов расстройств аутистического спектра в европейских популяциях». Европейский журнал генетики человека. 18 (9): 1013–9. Дои:10.1038 / ejhg.2010.69. ЧВК 2987412. PMID 20442744.
- ^ Пардо CA, Эберхарт CG (октябрь 2007 г.). «Нейробиология аутизма». Патология головного мозга. 17 (4): 434–47. Дои:10.1111 / j.1750-3639.2007.00102.x. PMID 17919129. S2CID 37048272.
- ^ Haas CA, Dudeck O, Kirsch M, Huszka C, Kann G, Pollak S, Zentner J, Frotscher M (июль 2002 г.). «Роль рилина в развитии дисперсии гранулярных клеток при височной эпилепсии». Журнал неврологии. 22 (14): 5797–802. Дои:10.1523 / JNEUROSCI.22-14-05797.2002. ЧВК 6757930. PMID 12122039.
- ^ Генрих С., Нитта Н., Флубахер А., Мюллер М., Фарнер А., Кирш М., Фрейман Т., Сузуки Ф., Депаулис А., Фротшер М., Haas CA (апрель 2006 г.). «Дефицит рилина и смещение зрелых нейронов, но не нейрогенез, лежат в основе образования дисперсии гранулярных клеток в эпилептическом гиппокампе». Журнал неврологии. 26 (17): 4701–13. Дои:10.1523 / JNEUROSCI.5516-05.2006. ЧВК 6674063. PMID 16641251.
- ^ Kobow K, Jeske I, Hildebrandt M, Hauke J, Hahnen E, Buslei R, Buchfelder M, Weigel D, Stefan H, Kasper B, Pauli E, Blümcke I. (апрель 2009 г.). «Повышенное метилирование промотора рилина связано с дисперсией гранулярных клеток при височной эпилепсии человека». Журнал невропатологии и экспериментальной неврологии. 68 (4): 356–64. Дои:10.1097 / NEN.0b013e31819ba737. PMID 19287316.
- ^ Гонг С., Ван Т.В., Хуанг Х.С., Родитель Дж. М. (февраль 2007 г.). «Рилин регулирует миграцию предшественников нейронов в интактном и эпилептическом гиппокампе». Журнал неврологии. 27 (8): 1803–11. Дои:10.1523 / JNEUROSCI.3111-06.2007. ЧВК 6673551. PMID 17314278.
- ^ Müller MC, Osswald M, Tinnes S, Häussler U, Jacobi A, Förster E, Frotscher M, Haas CA (апрель 2009 г.). «Экзогенный рилин предотвращает диспергирование гранулярных клеток при экспериментальной эпилепсии». Экспериментальная неврология. 216 (2): 390–7. Дои:10.1016 / j.expneurol.2008.12.029. PMID 19185570. S2CID 17173306.
- ^ а б Герц Дж., Бефферт У. (октябрь 2000 г.). «Рецепторы аполипопротеина Е: связь развития мозга и болезни Альцгеймера». Обзоры природы. Неврология. 1 (1): 51–8. Дои:10.1038/35036221. PMID 11252768. S2CID 27105032.
- ^ Герц Дж., Чен Й (ноябрь 2006 г.). «Рилин, рецепторы липопротеинов и синаптическая пластичность». Обзоры природы. Неврология. 7 (11): 850–9. Дои:10.1038 / nrn2009. PMID 17053810. S2CID 44317115.
- ^ Ботелла-Лопес А., Бургая Ф., Гавин Р., Гарсия-Айллон М.С., Гомес-Тортоса Е., Пенья-Казанова Дж., Уренья Дж. М., Дель Рио Дж. А., Блеса Р., Сориано Е., Саес-Валеро Дж. (Апрель 2006 г.). «Экспрессия рилина и паттерны гликозилирования изменяются при болезни Альцгеймера». Труды Национальной академии наук Соединенных Штатов Америки. 103 (14): 5573–8. Bibcode:2006ПНАС..103.5573Б. Дои:10.1073 / pnas.0601279103. ЧВК 1414634. PMID 16567613.
- ^ Wirths O, Multhaup G, Czech C, Blanchard V, Tremp G, Pradier L, Beyreuther K, Bayer TA (декабрь 2001 г.). «Рилин в бляшках белка-предшественника бета-амилоида и пресенилин-1 мышей, трансгенных дважды». Письма о неврологии. 316 (3): 145–8. Дои:10.1016 / S0304-3940 (01) 02399-0. PMID 11744223. S2CID 35475092.
- ^ Серипа Д., Матера М.Г., Франчески М., Даниэле А., Биццарро А., Ринальди М., Панса Ф, Фацио В.М., Гравина С., Д'Онофрио Г., Сольфриззи В., Масулло С., Пилотто А. (июль 2008 г.). «Локус RELN при болезни Альцгеймера». Журнал болезни Альцгеймера. 14 (3): 335–44. Дои:10.3233 / jad-2008-14308. PMID 18599960.
- ^ Балояннис SJ (июль 2005 г.). «Морфологические и морфометрические изменения клеток Кахаля-Ретциуса в ранних случаях болезни Альцгеймера: исследование Гольджи и электронного микроскопа». Международный журнал неврологии. 115 (7): 965–80. Дои:10.1080/00207450590901396. PMID 16051543. S2CID 36197073.
- ^ Балояннис С.Дж., Коста V, Маурудис I, Псарулис Д., Манолидес С.Л., Манолидес Л.С. (апрель 2007 г.). «Дендритная и спинномозговая патология акустической коры при болезни Альцгеймера: морфологическая и морфометрическая оценка методом Гольджи и электронной микроскопией». Acta Oto-Laryngologica. 127 (4): 351–4. Дои:10.1080/00016480601126986. PMID 17453452. S2CID 21625263.
- ^ Hoe HS, Lee KJ, Carney RS, Lee J, Markova A, Lee JY, Howell BW, Hyman BT, Pak DT, Bu G, Rebeck GW (июнь 2009 г.). «Взаимодействие рилина с белком-предшественником амилоида способствует росту нейритов». Журнал неврологии. 29 (23): 7459–73. Дои:10.1523 / JNEUROSCI.4872-08.2009. ЧВК 2759694. PMID 19515914.
- ^ Durakoglugil MS, Chen Y, White CL, Kavalali ET, Herz J (сентябрь 2009 г.). «Передача сигналов рилина противодействует бета-амилоиду в синапсе». Труды Национальной академии наук Соединенных Штатов Америки. 106 (37): 15938–43. Bibcode:2009PNAS..10615938D. Дои:10.1073 / pnas.0908176106. ЧВК 2747222. PMID 19805234.
- ^ Chen Y, Durakoglugil MS, Xian X, Herz J (июнь 2010 г.). «ApoE4 снижает функцию рецептора глутамата и синаптическую пластичность, избирательно нарушая рециклинг рецептора ApoE». Труды Национальной академии наук Соединенных Штатов Америки. 107 (26): 12011–6. Bibcode:2010PNAS..10712011C. Дои:10.1073 / pnas.0914984107. ЧВК 2900641. PMID 20547867.
- ^ Сато Н., Фукусима Н., Чанг Р., Мацубаяши Н., Гоггинс М. (февраль 2006 г.). «Профили дифференциальной и эпигенетической экспрессии генов выявляют частые нарушения пути RELN при раке поджелудочной железы». Гастроэнтерология. 130 (2): 548–65. Дои:10.1053 / j.gastro.2005.11.008. PMID 16472607.
- ^ Перроне Дж., Винченци Б., Загами М., Сантини Д., Пантери Р., Фламмия Дж., Верзи А., Лепанто Д., Морини С., Руссо А., Базан В., Томасино Р. М., Морелло В., Тонини Дж., Рабитти С. (март 2007 г.). «Экспрессия рилина при раке простаты человека: маркер агрессивности опухоли на основе корреляции со степенью». Современная патология. 20 (3): 344–51. Дои:10.1038 / modpathol.3800743. PMID 17277764.
- ^ Seigel GM, Hackam AS, Ganguly A, Mandell LM, Gonzalez-Fernandez F (июнь 2007 г.). «Маркеры эмбриональных и нейрональных стволовых клеток человека в ретинобластоме». Молекулярное зрение. 13: 823–32. ЧВК 2768758. PMID 17615543.
- ^ Чжан Дж., Дин Л., Холмфельдт Л., Ву Дж., Хитли С. Л., Пейн-Тернер Д., Истон Дж., Чен Х, Ван Дж., Руш М., Лу К., Чен С. К., Вэй Л., Коллинз-Андервуд-младший, Ма Дж., Робертс KG, Pounds SB, Ulyanov A, Becksfort J, Gupta P, Huether R, Kriwacki RW, Parker M, McGoldrick DJ, Zhao D, Alford D, Espy S, Bobba KC, Song G, Pei D, Cheng C, Roberts S, Барбато М.И., Кампана Д., Кустан-Смит Э., Шертлефф С.А., Раймонди С.К., Клеппе М., Коулс Дж., Шимано К.А., Хермистон М.Л., Дулатов С., Эпперт К., Лауренти Э, Нотта Ф, Дик Дж. Loh ML, Devidas M, Wood B, Winter S, Dunsmore KP, Fulton RS, Fulton LL, Hong X, Harris CC, Dooling DJ, Ochoa K, Johnson KJ, Obenauer JC, Evans WE, Pui CH, Naeve CW, Ley TJ , Mardis ER, Wilson RK, Downing JR, Mullighan CG (январь 2012 г.). «Генетическая основа острого лимфобластного лейкоза - предшественника Т-лимфоцитов». Природа. 481 (7380): 157–63. Bibcode:2012Натура.481..157Z. Дои:10.1038 / природа10725. ЧВК 3267575. PMID 22237106.
- ^ Schrauwen I, Ealy M, Huentelman MJ, Thys M, Homer N, Vanderstraeten K, Fransen E, Corneveaux JJ, Craig DW, Claustres M, Cremers CW, Dhooge I, Van de Heyning P, Vincent R, Offeciers E, Smith RJ, Ван Кэмп G (март 2009 г.). «Полногеномный анализ выявляет генетические варианты в гене RELN, связанные с отосклерозом». Американский журнал генетики человека. 84 (3): 328–38. Дои:10.1016 / j.ajhg.2009.01.023. ЧВК 2667982. PMID 19230858.
- ^ Delahaye NF, Coltel N, Puthier D, Barbier M, Benech P, Joly F, иракский FA, Grau GE, Nguyen C, Rihet P (декабрь 2007 г.). «Анализ экспрессии генов выявляет ранние изменения в нескольких молекулярных путях у мышей, чувствительных к церебральной малярии, по сравнению с мышами, устойчивыми к церебральной малярии». BMC Genomics. 8: 452. Дои:10.1186/1471-2164-8-452. ЧВК 2246131. PMID 18062806.
- ^ Гаршасби М., Махмуди М., Размара Э., Войданян М., Аслани С., Фархади Э. и др. (Июнь 2020 г.). «Идентификация варианта RELN p. (Ser2486Gly) в иранской семье с анкилозирующим спондилитом; первая ассоциация RELN и AS». Европейский журнал генетики человека. 28 (6): 754–762. Дои:10.1038 / s41431-020-0573-4. ЧВК 7253431. PMID 32001840.
- ^ https://neurosciencenews.com/reelin-multiple-sclerosis-16819/
- ^ а б Смит-Ригтер Л.А., Шампанское DL, ван Хофт Дж. А. (2009). Линден Р. (ред.). «Пожизненное влияние изменений в материнской заботе на дендритную структуру и функцию пирамидных нейронов кортикального слоя 2/3 у потомства крыс». PLOS ONE. 4 (4): e5167. Bibcode:2009PLoSO ... 4.5167S. Дои:10.1371 / journal.pone.0005167. ЧВК 2663818. PMID 19357777.
- ^ Weaver IC, Мини MJ, Szyf M (февраль 2006 г.). «Влияние материнской заботы на транскриптом гиппокампа и опосредованное тревогой поведение потомства, обратимое во взрослом возрасте». Труды Национальной академии наук Соединенных Штатов Америки. 103 (9): 3480–5. Bibcode:2006PNAS..103.3480W. Дои:10.1073 / pnas.0507526103. ЧВК 1413873. PMID 16484373.
- ^ Люсье А.Л., Карунчо Х.Д., Калинчук Л.Е. (август 2009 г.). «Многократное воздействие кортикостерона, но не ограничение, снижает количество рилин-положительных клеток в гиппокампе взрослых крыс». Письма о неврологии. 460 (2): 170–4. Дои:10.1016 / j.neulet.2009.05.050. PMID 19477232. S2CID 5305922.
- ^ Линтас С., Персико А.М. (январь 2010 г.). «Метилирование промотора неокортекса RELN значительно увеличивается после полового созревания». NeuroReport. 21 (2): 114–8. Дои:10.1097 / WNR.0b013e328334b343. PMID 19952965. S2CID 206137259.
- ^ Донг Э., Нельсон М., Грейсон Д.Р., Коста Э, Гвидотти А. (сентябрь 2008 г.). «Клозапин и сульпирид, но не галоперидол или оланзапин, активируют деметилирование ДНК мозга». Труды Национальной академии наук Соединенных Штатов Америки. 105 (36): 13614–9. Bibcode:2008PNAS..10513614D. Дои:10.1073 / pnas.0805493105. ЧВК 2533238. PMID 18757738.
- ^ Fatemi SH, Reutiman TJ, Folsom TD (июнь 2009 г.). «Хроническое лечение психотропными препаратами вызывает дифференциальную экспрессию сигнальной системы Reelin во фронтальной коре головного мозга крыс». Исследование шизофрении. 111 (1–3): 138–52. Дои:10.1016 / j.schres.2009.03.002. PMID 19359144. S2CID 37048872.
Рекомендуемое чтение
- Книга: Фатеми, С. Хоссейн (2008). Рилин-гликопротеин: структура, биология и роль в здоровье и болезнях. Молекулярная психиатрия. 10. Берлин: Springer. С. 251–7. Дои:10.1038 / sj.mp.4001613. ISBN 978-0-387-76760-4. PMID 15583703. S2CID 21206951.
- Обзор: Förster E, Jossin Y, Zhao S, Chai X, Frotscher M, Goffinet AM (февраль 2006 г.). «Недавний прогресс в понимании роли рилина в радиальной миграции нейронов с особым акцентом на зубчатой извилине». Европейский журнал нейробиологии. 23 (4): 901–9. Дои:10.1111 / j.1460-9568.2006.04612.x. PMID 16519655. S2CID 25269492.
внешняя ссылка
Статьи, публикации, веб-страницы
- "Габриэлла Д'Арканджело". Университет Рутгерса. Архивировано из оригинал 25 июля 2008 г.. Получено 23 августа 2008.
ученый, открывший ген и белок рилина
- Human RELN в WikiGenes
Рисунки и изображения
- «Экспрессия гена рилина у мышей». Карта экспрессии генов мозга. Детская исследовательская больница Св. Иуды. Архивировано из оригинал 23 января 2005 г.. Получено 23 августа 2008.
- «Схематическое изображение передачи сигналов через члены семейства LDLR apoER2 и рецептор VLDL». Получено 23 августа 2008.[постоянная мертвая ссылка ] - Фигурка из Beffert U, Stolt PC, Herz J (март 2004 г.). «Функции рецепторов липопротеинов в нейронах». Журнал липидных исследований. 45 (3): 403–9. Дои:10.1194 / мл. R300017-JLR200. PMID 14657206.
- «Предлагаемый механизм, с помощью которого промотор RELN мыши регулирует экспрессию гена рилина». Proc. Natl. Акад. Sci. Соединенные Штаты Америки. Получено 23 августа 2008. - Фигурка из Донг Э., Аджис-Бальбоа Р.С., Симонини М.В., Грейсон Д.Р., Коста Э., Гуидотти А. (август 2005 г.). «Ремоделирование промотора декарбоксилазы 67 рилина и глутаминовой кислоты в мышиной эпигенетической модели шизофрении, индуцированной метионином». Труды Национальной академии наук Соединенных Штатов Америки. 102 (35): 12578–83. Bibcode:2005PNAS..10212578D. Дои:10.1073 / pnas.0505394102. ЧВК 1194936. PMID 16113080.
- «Кортикогенез у мышей дикого типа, мышей с мутантами по Рилеру и с дефицитом β1». Архивировано из оригинал 24 декабря 2007 г.. Получено 23 августа 2008.
Наглядное изображение того различия, которое отсутствие катушки привносит в структуру коры
Цитировать журнал требует| журнал =(помощь) - Фигурка из Магдалено С.М., Курран Т. (декабрь 2001 г.). «Развитие мозга: интегрины и путь Reelin». Текущая биология. 11 (24): R1032-5. Дои:10.1016 / S0960-9822 (01) 00618-2. PMID 11747842. S2CID 8790079. - Hong SE, Shugart YY, Huang DT, Shahwan SA, Grant PE, Hourihane JO и др. (Сентябрь 2000 г.). «Аутосомно-рецессивная лиссэнцефалия с гипоплазией мозжечка связана с мутациями RELN человека». Природа Генетика. 26 (1): 93–6. Дои:10.1038/79246. PMID 10973257. S2CID 67748801.