Вверх и вниз по потоку (трансдукция) - Upstream and downstream (transduction)

В вверх по течению сигнальный путь запускается связыванием сигнальной молекулы, лиганд к принимающей молекуле a рецептор. Рецепторы и лиганды существуют во многих различных формах, и они распознают / связывают только определенные молекулы. Передача внеклеточных сигналов выше по течению преобразовывать бесконечное разнообразие внутриклеточных каскадов.[1]
Рецепторы и лиганды - распространенные передающие сигнальные молекулы, которые определяют вниз по течению элементы сигнального пути. Множество различных факторов влияет на то, какие лиганды с какими рецепторами связываются, и на последующий клеточный ответ, который они инициируют.
TGF-β
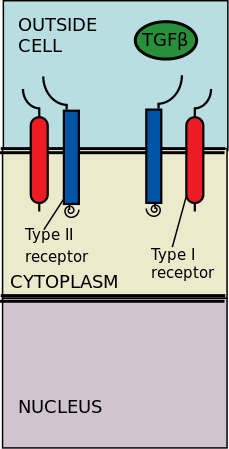
Внеклеточные рецепторы киназ типа II и I связываются с лигандами TGF-β. Трансформирующий фактор роста-β (TGF-β) представляет собой суперсемейство цитокинов, которые играют значительную роль в регуляции Морфогенез, Гомеостаз, пролиферация и дифференциация клеток.[2] Значение TGF-β очевидно при заболеваниях человека, которые возникают при нарушении процессов TGF-β, таких как рак, а также заболевания скелета, кишечника и сердечно-сосудистой системы.[3][4] TGF-β - это плейотропный и многофункциональные, что означает, что они способны воздействовать на самые разные типы клеток.[5]
Механизм
Эффекты трансформирующего фактора роста-β (TGF-β) определяются клеточным контекстом. Существует три типа контекстных факторов, которые определяют форму ответа TGF-β: преобразование сигнала компоненты, транскрипционный кофакторы и эпигенетический состояние клетки. Различные лиганды и рецепторы TGF-β также важны в пути передачи сигнала композиции.[2]
- Компоненты передачи сигнала: изоформы лиганда, ловушки лигандов, корецепторы, подтипы рецепторов, ингибирующие SMAD белки, входы перекрестных помех
- транскрипционные кофакторы белков SMAD: факторы плюрипотентности, регуляторы клонов, ДНК-связывающие кофакторы, Шляпы и HDAC, ОЯТ, читатели хроматина
- эпигенетические факторы: гетерохроматин, плюрипотентность знаки, знаки происхождения, ЕМТ метки, метки ячеек iPS, онкогенный Метки.
Путь вверх по течению
Рецепторы типа II фосфорилируют рецепторы типа I; затем рецепторы типа I получают возможность фосфорилировать цитоплазматические R-Smads, которые затем действуют как регуляторы транскрипции.[6][2] Передача сигналов инициируется связыванием TGF-β с его сериновыми / треониновыми рецепторами. Безмятежные / треониновые рецепторы представляют собой рецепторы типа II и типа I на клеточной мембране. Связывание членов TGF-β индуцирует сборку гетеротетрамерного комплекса двух рецепторов типа I и двух рецепторов типа II на плазматическая мембрана.[6] Отдельные члены семейства TGF-β связываются с определенным набором характерных комбинаций этих рецепторов типа I и типа II.[7] Рецепторы I типа можно разделить на две группы в зависимости от цитоплазматической Р-Смадс что они связывают и фосфорилируют. Первая группа рецепторов типа I (Alk1 / 2/3/6) связывает и активирует R-Smads, Smad1 / 5/8. Вторая группа реакторов типа I (Alk4 / 5/7) действует на R-Smads, Smad2 / 3. Затем фосфорилированные R-Smads образуют комплексы, и сигналы проходят через два регуляторных канала Smad (R-Smad) (Smad1 / 5/8 или Smad2 / 3).[6][2] После того как комплексы лиганд-рецептор фосфорилируют цитоплазматический R-Smads, сигнал затем передается через Smad 1/5/8 или Smad 2/3. Это приводит к нисходящему сигнальному каскаду и нацеливанию на клеточные гены.[6][5]
Путь вниз по течению
TGF-β регулирует множество последующих процессов и клеточных функций. Путь может сильно варьировать в зависимости от клеточного контекста. Сигнальный каскад нижестоящего TGF-β включает регуляцию роста клеток, распространение клеток, дифференциация клеток, и апоптоз.[8]
Рекомендации
- ^ Миллер Д.С., Шмирер Б., Hill CS (июль 2019 г.). «Лиганды семейства TGF-β демонстрируют четкую динамику передачи сигналов, которая определяется локализацией рецептора». Журнал клеточной науки. 132 (14): jcs234039. Дои:10.1242 / jcs.234039. ЧВК 6679586. PMID 31217285.
- ^ а б c d Massagué J (октябрь 2012 г.). «Передача сигналов TGFβ в контексте». Обзоры природы. Молекулярная клеточная биология. 13 (10): 616–30. Дои:10.1038 / nrm3434. ЧВК 4027049. PMID 22992590.
- ^ Кашима Р., Хата А. (январь 2018 г.). «Роль передачи сигналов надсемейства TGF-β в неврологических расстройствах». Acta Biochimica et Biophysica Sinica. 50 (1): 106–120. Дои:10,1093 / abbs / gmx124. ЧВК 5846707. PMID 29190314.
- ^ Хуанг Т., Шор С.Л., Хинк А.П. (сентябрь 2014 г.). «Различия в биологической активности между TGF-β1 и TGF-β3 коррелируют с различиями в жесткости и расположении составляющих их мономеров». Биохимия. 53 (36): 5737–49. Дои:10.1021 / bi500647d. ЧВК 4165442. PMID 25153513.
- ^ а б Леттерио Дж. Дж., Робертс А.Б. (1 апреля 1998 г.). «Регулирование иммунных ответов с помощью TGF-бета». Ежегодный обзор иммунологии. 16 (1): 137–61. Дои:10.1146 / annurev.immunol.16.1.137. PMID 9597127.
- ^ а б c d Вилар Дж. М., Янсен Р., Сандер С. (январь 2006 г.). "Обработка сигналов в сети лиганд-рецептор надсемейства TGF-бета". PLOS вычислительная биология. 2 (1): e3. arXiv:q-bio / 0509016. Bibcode:2006PLSCB ... 2 .... 3 В. Дои:10.1371 / journal.pcbi.0020003. ЧВК 1356091. PMID 16446785.
- ^ Heldin CH, Moustakas A (август 2016 г.). «Сигнальные рецепторы для членов семейства TGF-β». Перспективы Колд-Спринг-Харбор в биологии. 8 (8): a022053. Дои:10.1101 / cshperspect.a022053. ЧВК 4968163. PMID 27481709.
- ^ Ли Н, Се Ц, Лу НХ (2015). «Трансформирующий фактор роста-β: важный медиатор в патогенезе, связанном с Helicobacter pylori». Границы клеточной и инфекционной микробиологии. 5: 77. Дои:10.3389 / fcimb.2015.00077. ЧВК 4632021. PMID 26583078.
