Синаптическая стабилизация - Synaptic stabilization
На этой странице описан процесс стабилизации синапсов, опосредованный молекулами клеточной адгезии. Для просмотра статей по теме посетите страницы на Синаптогенез, Синаптическая пластичность, Молекула клеточной адгезии, Развитие нервной системы.

Синаптическая стабилизация имеет решающее значение для нервной системы развивающегося и взрослого человека и считается результатом поздней фазы долгосрочное потенцирование (ДП). Механизм предполагает усиление и поддержание активного синапсы за счет повышенной экспрессии элементов цитоскелета и внеклеточного матрикса и постсинаптических каркасные белки, при обрезке менее активных. Например, молекулы клеточной адгезии (CAM) играют большую роль в поддержании и стабилизации синапсов. Джеральд Эдельман открыли CAM и изучили их функции во время разработки, которые показали, что CAM необходимы для миграция клеток и формирование всей нервной системы.[1][2] В нервной системе взрослого человека САМ играют важную роль в синаптическая пластичность относящийся к учусь и объем памяти.[3]
Типы CAM
SynCAMs
Молекулы адгезии синаптических клеток (CAM) играют решающую роль в поиске пути аксонов и установлении синапсов между нейронами во время развитие нервной системы и являются неотъемлемыми членами многих синаптических процессов, включая правильное выравнивание пре- и постсинаптических пути передачи сигналов, везикулярная рециркуляция в отношении эндоцитоз и экзоцитоз, интеграция постсинаптических рецепторов и прикрепление к цитоскелет для обеспечения стабильности синаптических компонентов [4]
SynCAM (также известные как Cadm или нектиноподобные молекулы) представляют собой особый тип синаптических CAM, обнаруженных в позвоночные что способствует росту и стабилизации возбуждающих (не тормозных) синапсов. SynCAM локализованы в основном в мозг как в пре-, так и в постсинаптических сайтах, и их структуры состоят из внутриклеточных FERM и PDZ-связывающих доменов, одного трансмембранного домена и трех внеклеточных Ig-домены. Во время развития нервной системы SynCAM, такие как SynCAM1, действуют как «контактные датчики» аксонов. шишки быстро накапливается при образовании аксо-дендритных связей и помогает формировать стабильную адгезия сложный.[5]
synCAM1 вместе с нейролигин являются двумя CAM, которых, как известно, достаточно для инициирования образования пресинаптических окончаний, поскольку добавление synCAM1 к среде совместно культивируемых нейрональных и ненейрональных клеток приводит к образованию пресинаптических окончаний. Гомофильное связывание двух молекул synCAM1 на филоподиях конуса роста аксонов и дендритного шипа позволяет установить начальный контакт между пре- и постсинаптическими клетками.[6]
synCAM принадлежат к Надсемейство Ig белков. Цитозольные PDZ-домены synCAM, встроенные в постсинаптическую мембрану, взаимодействуют с постсинаптическим каркасным белком. PSD-95 который помогает закрепить комплекс на нижележащем цитоскелете.[7]
Кадгерин-катенин

Кадгерины кальций-зависимые, гомофильные молекулы клеточной адгезии которые образуют комплексы с цитозольными партнерами, известные как катенины.[8] Компоненты этого комплекса связываются с рядом различных каркасных белков, фосфотаз, киназ и рецепторов.[9] Классические кадгерины имеют пять внеклеточных повторяющихся структур, которые связывают кальций, единственный трансмембранный домен и внутриклеточный хвост с дистальным цитозольным доменом, который связывает катенин-партнер.[9][10] Недавние исследования показали, что комплекс кадгерин-катенин участвует в ряде различных процессов центральной нервной системы, таких как синаптическая стабилизация и пластичность.[8][9][10]
Многие кадгерины в Центральная нервная система демонстрируют отчетливые пространственные и временные паттерны экспрессии.[9] Например, N-кадгерин широко экспрессируется в развивающемся синапсе и позже остается около зрелой активной зоны, подразумевая, что этот комплекс может быть хорошо приспособлен для обеспечения связи между структурными изменениями и синаптической стабильностью.[9] Фактически, локальные изменения синаптической активности влияют на экспрессию кадгерин-катенин комплексы.[9] Повышение активности на определенном позвоночник приводит к димеризации N-кадгерина, который затем расщепляется, что приводит к репрессии CBP /CREB транскрипция.[9] Это подавление имеет множество последствий, связанных с развитием и пластичностью.
В случае дендритный позвоночник формирование и обрезка, была предложена и подтверждена гипотеза конкуренции.[11][12] Эта гипотеза предполагает, что относительные уровни комплексов кадгерин-катенин, которые распределяются между шипами в локальной области зависимым от активности образом, определяют судьбу отдельных шипов. То есть конкуренция между позвоночником за β-катенин определяет, будет ли позвоночник зрелым (увеличенное количество комплексов) или сокращенным (уменьшенное количество комплексов).[12] Это критический механизм во время уточнения кортикальных цепей, происходящих на протяжении всего развития.[11]
Нектин
Нектины представляют собой отдельную семью молекулы клеточной адгезии. Эти CAM участвуют в начальном контакте пресинаптический и постсинаптические нейрональные процессы во время образования синапсов. Есть только четыре хорошо охарактеризованных нектина. синапс, это нектин-1, 2, 3 и 4.[13] Все мембрана Связанные нектины имеют внеклеточную область с тремя петлями, подобными иммуноглобулину. Самая дальняя от мембраны петля называется петлей V-типа, а две более внутренние петли - петлями типа C2. Несколько нектинов на одной клеточной мембране будут связываться вместе в петле V-типа, образуя кластер белков нектина, процесс, называемый цис-кластеризация. Когда две клетки, обладающие отдельными цис-кластерами, входят в контакт, они образуют сильный комплекс, называемый транс-взаимодействие который обеспечивает адгезию и, в некоторых случаях, передачу сигналов между двумя клетками.[14]
Наиболее достоверные сведения о роли нектина в синаптической стабилизации получены из синапсов, образованных между моховое волокно терминалы и пирамидная ячейка дендриты в CA3 область гиппокампа.[15] Нектины, участвующие в образовании и стабилизации этого синапса, - это нектин-1 и нектин-3, которые выступают из плазматической мембраны постсинаптической клетки и пресинаптической клетки, соответственно, образуя гетерофильные внеклеточный контакты. Внутриклеточный домен всех нектинов напрямую связывается с белком, называемым L-Афадин. Л-Афадин - актин связывающий белок, который связывается с F-актином актина цитоскелет. Таким образом, нектины образуют гребневые связи в архитектуре актина клетки, позволяя синапсу развиваться в контролируемой и стабильной среде.[16]
По мере созревания синапсов в области CA3 нектины и кадгерины, которые тесно связаны друг с другом в синаптической стабилизации, смещаются на периферию активная зона и образуют соединение puncta adherens (PAJ). PAJ работает так же, как прилипает к стыкам в эпителиальный ткани. Смещение этих САМ и образование этого соединения дает возникающим синаптическим мембранам пространство для взаимодействия и созревания, разделяя при этом окружающую мембрану и обеспечивая фиксацию цитоскелета.[14]
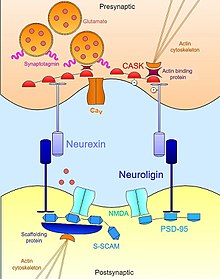
Нейрексин-нейролигин
Нейрексин -Нейролигин взаимодействия помогают установить транссинаптическую функциональную асимметрию, необходимую для стабилизации и поддержания надлежащего синаптическая передача.[17] Пресинаптический нейрексин и его партнер по постсинаптическому связыванию, нейролигин, представляют собой комплекс на ранних этапах нервного развития и оба, как известно, являются мощными индукторами синаптогенез.[18] Ненейронных клеток, которые искусственно экспрессируют нейрексин, достаточно для мобилизации постсинаптических специализаций в совместно культивируемых нейронах;[19] Клетки, экспрессирующие нейролигин, также способны индуцировать маркеры пресинаптической дифференцировки в соседних нейронах.[20][21] Однако, хотя оба они играют важную роль в синаптогенезе, эти молекула клеточной адгезии не нужны для образования нейронных связей в процессе развития.[22] Тройной нокаутирующая мышь мутанты нейрексинов или нейролигинов демонстрируют нормальное количество синапсов, но выражают эмбриональный летальный фенотип из-за нарушения нормальной синаптической передачи.[23] Следовательно, они не нужны для образования синапсов. как таковой но необходимы для созревания и интеграции синапсов в функциональные цепи, необходимые для выживания.
Помимо внеклеточного контакта друг с другом нейрексины и нейролигины также связываются внутриклеточно с обширной сетью адаптерные белки и строительные леса, которые в сочетании с актиновый цитоскелет, помочь локализовать необходимые компоненты синаптической передачи. Например, первый нейролигин (NLGN1 ) обнаружен был идентифицирован по его PDZ домен который привязан к PSD95, известный каркасный белок в глутаматергические синапсы это функционально связывает Рецепторы NMDA в правильную постсинаптическую локаль.[21][24] Аналогичным образом другая изоформа нейролигина (NLGN2 ) взаимодействует с гефирин, каркасный белок, специфичный для ГАМК-ергические синапсы, и отвечает за активацию белка синаптического адаптера коллибистин.[25] В случае нейрексинов их внутриклеточные связывающие взаимодействия столь же важны для рекрутирования необходимого механизма синаптической передачи в активной зоне. Подобно нейролигинам, нейрексины обладают PDZ-доменом, который ассоциируется с КАСКА (Кальций-кальмодулин-зависимая протеинкиназа ).[24] Помимо фосфорилирования себя и нейрексина, CASK способствует взаимодействию между нейрексинами и актинсвязывающими белками, обеспечивая тем самым прямую связь, с помощью которой нейрексин может модулировать динамику цитоскелета, что важно для синаптической стабильности и пластичности. Нейрексин также может связывать синаптотагмин, белок, встроенный в мембрану синаптических везикул, а также может способствовать ассоциации с потенциалзависимый кальциевый канал которые опосредуют поток ионов, необходимый для нейротрансмиттер экзоцитоз при синаптической стимуляции.[26][23] Таким образом, нейрексин и нейролигин координируют морфологические и функциональные аспекты синапса, что, в свою очередь, позволяет зарождающимся незрелым контактам стабилизироваться в полноценные функциональные платформы для нейротрансмиссии.
Эфрин-Эф сигнализация

Нетрадиционные молекулы адгезии, такие как эфрины, также помогают стабилизировать синаптические контакты. Рецепторы Eph и их мембраносвязанные лиганды, эфрины, участвуют во множестве клеточных процессов во время развития и созревания, включая управление аксоном, миграция нейронов, синаптогенез, и обрезка аксонов.[27][28] в гиппокамп, дендритный позвоночник морфология может регулироваться астроциты через двунаправленную передачу сигналов эфрин / EphA.[29] Астроциты и их отростки выражают эфрин А3, тогда как рецептор EphA4 обогащен нейронами гиппокампа. Это взаимодействие, опосредованное передачей сигналов эфрина A3 / EphA4, индуцирует рекрутирование и активацию циклин-зависимая киназа 5 (Cdk5), который затем фосфорилирует фактор обмена гуанина (ГЭФ), эфексин1.[30] Затем фосфорилированный эфексин 1 может активировать малую GTPase, RhoA, что приводит к последующей активации его эффектора, Ро-киназа (ROCK), что приводит к перестройке актиновых филаментов.[30] Посредством этого механизма астроцитарные процессы способны стабилизировать отдельные дендритные выступы, а также их созревание в шипы посредством передачи сигналов эфрина / EphA. Прямая передача сигналов, включающая активацию EphA4, приводит к стабилизации синаптических белков в нервномышечное соединение.[30] Как и при EphA4 / ephrinA3-опосредованном взаимодействии нейронов с глией, этот процесс регулирует динамику актинового цитоскелета путем активации ROCK через эфексин.[30]
Передача сигналов Ephrin B / EphB также участвует в синаптической стабилизации посредством различных механизмов. Эти молекулы содержат цитоплазматические хвосты, которые взаимодействуют с белками каркаса через свои ПДЗ домены для стабилизации вновь образованных синапсов ЦНС.[28] Например, Эфрин B3 взаимодействует с адаптерным белком, взаимодействующим с глутаматным рецептором, белком 1 (GRIP-1), чтобы регулировать развитие возбуждающих синапсов дендритного вала.[28] Этот процесс, который был идентифицирован в культурах нейронов гиппокампа, показал, что обратная передача сигналов Eph / ephrin B3 рекрутирует GRIP1 на мембрану постсинаптического вала.[31] Попав в ствол мембраны, GRIP1 помогает закрепить рецепторы глутамата ниже пресинаптического терминала. Этот процесс также включает фосфорилирование остатка серина около эфрина-B. карбоксильный конец (проксимально к PDZ-связывающему мотиву), что приводит к стабилизации AMPA рецепторы в синапсах.[27]
Другой механизм, обнаруженный в нейронах гиппокампа, показал, что передача сигналов EphB может способствовать созреванию шипов путем модуляции активности Rho GTPase, как это наблюдается с EphAs.[32] Однако, в отличие от EphAs, EphB2 рецептор взаимодействует с постсинаптическим Рецепторы N-метил-D-аспартата (NMDAR) для рекрутирования GEF Tiam1 в комплекс при связывании ephrinB.[32][30][33] Фосфорилирование Tiam1 происходит в ответ на активность NMDAR, что обеспечивает приток кальция, который активирует Tiam1. Этот механизм также приводит к модуляции актинового цитоскелета. В результате этой стабилизации было обнаружено, что как прямая передача сигналов EphB2, так и обратная передача сигналов эфрина-B3 индуцируют LTP через NMDAR.[34]
Рекомендации
- ^ Rutishauser U, Jessell TM (июль 1988 г.). «Молекулы клеточной адгезии в нервном развитии позвоночных». Физиологические обзоры. 68 (3): 819–57. Дои:10.1152 / физрев.1988.68.3.819. PMID 3293093.
- ^ "Биография Джеральда М. Эдельмана". Nobelprize.org. Получено 13 марта 2018.
- ^ Бенсон Д.Л., Шнапп Л.М., Шапиро Л., Хантли Г.В. (ноябрь 2000 г.). «Создание воспоминаний: молекулы клеточной адгезии в синаптической пластичности». Тенденции в клеточной биологии. 10 (11): 473–82. Дои:10.1016 / S0962-8924 (00) 01838-9. PMID 11050419.
- ^ Букало, Елена; Дитятьев, Александр (27 декабря 2012 г.). Развитие и заболевание динамики синаптической пластичности. Достижения экспериментальной медицины и биологии. 970. Вена: Шпрингер, Вена. С. 97–128. Дои:10.1007/978-3-7091-0932-8_5. ISBN 978-3-7091-0932-8. PMID 22351053.
- ^ Бидерер, Томас; Мисслер, Маркус; Зюдхоф, Томас. «Адгезия синаптических клеток». Перспективы Колд-Спрингс-Харбор в биологии. Лабораторный пресс Колд-Спринг-Харбор. Получено 12 марта 2018.
- ^ Уошборн, Филип; Дитятьев Александр; Шайффеле, Питер; Бидерер, Томас; Weiner, Joshua A .; Кристоферсон, Карен С .; Эль-Хусейни, Алаа (20 октября 2004 г.). «Молекулы клеточной адгезии в образовании синапсов». Журнал неврологии. 24 (42): 9244–9249. Дои:10.1523 / JNEUROSCI.3339-04.2004. ЧВК 6730099. PMID 15496659.
- ^ Далва, Мэтью; Макклелланд, Эндрю; Кайзер, Мэтью (14 февраля 2007 г.). «Молекулы клеточной адгезии: сигнальные функции в синапсе». Природа. 8 (3): 206–220. Дои:10.1038 / номер 2075. ЧВК 4756920. PMID 17299456.
- ^ а б Bamji SX (июль 2005 г.). «Кадгерины: актин с цитоскелетом для образования синапсов». Нейрон. 47 (2): 175–8. Дои:10.1016 / j.neuron.2005.06.024. PMID 16039559.
- ^ а б c d е ж грамм Ариккат Дж., Райхардт Л.Ф. (сентябрь 2008 г.). «Кадгерины и катенины в синапсах: роли в синаптогенезе и синаптической пластичности». Тенденции в неврологии. 31 (9): 487–94. Дои:10.1016 / j.tins.2008.07.001. ЧВК 2623250. PMID 18684518.
- ^ а б Сеонг Э., Юань Л., Ариккат Дж. (Апрель 2015 г.). «Кадгерины и катенины в морфогенезе дендритов и синапсов». Адгезия и миграция клеток. 9 (3): 202–13. Дои:10.4161/19336918.2014.994919. ЧВК 4594442. PMID 25914083.
- ^ а б Уолли К. (октябрь 2015 г.). «Нейронное развитие: сложное соревнование за шипы». Обзоры природы. Неврология. 16 (10): 577. Дои:10.1038 / nrn4024. PMID 26307326.
- ^ а б Бянь В.Дж., Мяо В.Й., Хе С.Дж., Цю З., Ю X (август 2015 г.). «Скоординированная обрезка и созревание позвоночника, опосредованная конкуренцией между позвоночником для комплексов кадгерина / катенина». Клетка. 162 (4): 808–22. Дои:10.1016 / j.cell.2015.07.018. PMID 26255771.
- ^ Санес Д. (25 января 2011 г.). Развитие нервной системы (3-е изд.). Эльзевир. ISBN 978-0-08-092320-8.
- ^ а б Ирие К., Симидзу К., Сакисака Т., Икеда В., Такай Ю. (декабрь 2004 г.). «Роль и механизмы действия нектинов в клеточной адгезии». Семинары по клеточной биологии и биологии развития. 15 (6): 643–56. Дои:10.1016 / с1084-9521 (04) 00088-6. PMID 15561584.
- ^ Рикитаке Й, Мандай К., Такай Й (август 2012 г.). «Роль нектинов в различных типах межклеточной адгезии». Журнал клеточной науки. 125 (Пт 16): 3713–22. Дои:10.1242 / jcs.099572. PMID 23027581.
- ^ Такай Й, Симидзу К., Оцука Т. (октябрь 2003 г.). «Роль кадгеринов и нектинов в формировании межнейрональных синапсов». Текущее мнение в нейробиологии. 13 (5): 520–6. Дои:10.1016 / j.conb.2003.09.003. PMID 14630213.
- ^ Крейг А.М., Кан Й. (февраль 2007 г.). «Передача сигналов нейрексин-нейролигин в развитии синапсов». Текущее мнение в нейробиологии. 17 (1): 43–52. Дои:10.1016 / j.conb.2007.01.011. ЧВК 2820508. PMID 17275284.
- ^ Дин С., Дресбах Т. (январь 2006 г.). «Нейролигины и нейрексины: связывающие адгезию клеток, формирование синапсов и когнитивные функции». Тенденции в неврологии. 29 (1): 21–9. Дои:10.1016 / j.tins.2005.11.003. PMID 16337696.
- ^ Нам Ч.И., Чен Л. (апрель 2005 г.). «Постсинаптическая сборка, индуцированная взаимодействием нейрексин-нейролигин и нейротрансмиттером». Труды Национальной академии наук Соединенных Штатов Америки. 102 (17): 6137–42. Bibcode:2005ПНАС..102.6137Н. Дои:10.1073 / pnas.0502038102. ЧВК 1087954. PMID 15837930.
- ^ Брэди С.Т., Сигель Г.Дж., Альберс Р.В., Прайс DL (2012). Базовая нейрохимия: принципы молекулярной, клеточной и медицинской нейробиологии (Восьмое изд.). Уолтем, Массачусетс. ISBN 978-0-12-374947-5. OCLC 754167839.
- ^ а б Мисслер М., Зюдхоф ТЦ, Бидерер Т. (апрель 2012 г.). «Адгезия синаптических клеток». Перспективы Колд-Спринг-Харбор в биологии. 4 (4): a005694. Дои:10.1101 / cshperspect.a005694. ЧВК 3312681. PMID 22278667.
- ^ Хорч М (2009). «Краткая история синапса - Гольджи против Рамона-и-Кахала». В Hortsch M, Umemori H (ред.). Липкий синапс. Спрингер, Нью-Йорк, штат Нью-Йорк. С. 1–9. Дои:10.1007/978-0-387-92708-4_1. ISBN 978-0-387-92707-7.
- ^ а б Missler M, Zhang W, Rohlmann A, Kattenstroth G, Hammer RE, Gottmann K, Südhof TC (июнь 2003 г.). «Альфа-нейрексины соединяют каналы Ca2 + с экзоцитозом синаптических везикул». Природа. 423 (6943): 939–48. Bibcode:2003Натура.423..939М. Дои:10.1038 / природа01755. PMID 12827191.
- ^ а б Сквайр Л. Р. (2009). Энциклопедия неврологии. Амстердам: Academic Press. ISBN 978-0-08-096393-8. OCLC 503584095.
- ^ Чжан С., Атасой Д., Арас Д., Ян Х, Фучилло М.В., Робисон А.Дж., Ко Дж., Брюнгер А.Т., Зюдхоф ТЦ (май 2010 г.). «Нейрексины физически и функционально взаимодействуют с рецепторами ГАМК (А)». Нейрон. 66 (3): 403–16. Дои:10.1016 / j.neuron.2010.04.008. ЧВК 3243752. PMID 20471353.
- ^ Хата Ю., Давлетов Б., Петренко А.Г., Ян Р., Зюдхоф ТЦ (февраль 1993 г.). «Взаимодействие синаптотагмина с цитоплазматическими доменами нейрексинов». Нейрон. 10 (2): 307–15. Дои:10.1016 / 0896-6273 (93) 90320-Q. PMID 8439414.
- ^ а б Лизабет Э.М., Фаливелли Дж., Паскуале Э. Б. (сентябрь 2013 г.). «Передача сигналов рецептора Eph и эфрины». Перспективы Колд-Спринг-Харбор в биологии. 5 (9): a009159. Дои:10.1101 / cshperspect.a009159. ЧВК 3753714. PMID 24003208.
- ^ а б c Бьянки Л. (2018). Нейробиология развития. Нью-Йорк, Нью-Йорк: Наука о гирляндах. С. 299–302. ISBN 9780815344827.
- ^ Болтон М.М., Эроглу С. (октябрь 2009 г.). «Посмотрите, кто плетет нейронную сеть: глиальный контроль образования синапсов». Текущее мнение в нейробиологии. 19 (5): 491–7. Дои:10.1016 / j.conb.2009.09.007. PMID 19879129.
- ^ а б c d е Рубинштейн Дж (май 2013 г.). Клеточная миграция и формирование нейронных связей: комплексная нейробиология развития. Сан-Диего, Калифорния: Elsevier Science & Technology. С. 659–669. ISBN 978-0-12-397266-8.
- ^ Flannery DB (сентябрь 1988 г.). «Нерасхождение при синдроме Дауна». Американский журнал медицинской генетики. 31 (1): 181–2. Дои:10.1002 / ajmg.1320310123. PMID 2975924.
- ^ а б Лернер AM (октябрь 1990 г.). «Вирусный миокардит как случайное открытие». Госпитальная практика. 25 (10): 81–4, 87–90. Дои:10.1016 / j.brainres.2006.11.033. ЧВК 2170431. PMID 2170431.
- ^ Арванитис Д., Дэви А. (февраль 2008 г.). «Eph / ephrin сигнализация: сети». Гены и развитие. 22 (4): 416–29. Дои:10.1101 / gad.1630408. ЧВК 2731651. PMID 18281458.
- ^ Лундгрен А., Тибблинг Л., Хенрикссон Н. Г. (март 2018 г.). «DC-определяемое смещение ритма нистагма во вращательных тестах». Practica Oto-Rhino-Laryngologica. 31 (1): 54–64. Дои:10.3892 / etm.2018.5702. PMID 5795627.
