Гексакарбонил ванадия - Vanadium hexacarbonyl
 | |
| Имена | |
|---|---|
| Название ИЮПАК гексакарбонилванадий (0) | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ЧЭБИ | |
| ECHA InfoCard | 100.039.928 |
PubChem CID | |
| UNII | |
| |
| Характеристики | |
| C6О6V | |
| Молярная масса | 219,00 г / моль |
| Внешность | сине-зеленые кристаллы желтые решения |
| Плотность | 1,7 г / см3 |
| Температура плавления | разлагается |
| Точка кипения | сублимируется при 50 ° C (122 ° F, 323 K) (15 мм рт. ст.) |
| нерастворимый | |
| Растворимость в других растворителях | 5 г / л гексан; более растворим в дихлорметан |
| Структура | |
| ромбический | |
| восьмигранный | |
| 0 D | |
| Опасности | |
| Главный опасности | Источник CO |
| Родственные соединения | |
Родственные соединения | Cr (CO)6, VCl3 |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
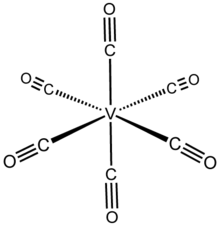
Гексакарбонил ванадия это неорганическое соединение с формула V (CO)6. Это сине-черное летучее твердое вещество. Этот высокореактивный вид заслуживает внимания с теоретической точки зрения как редкий изолируемый гомолептик карбонил металла это парамагнитно. Большинство видов с формулой MИкс(CO)у следовать Правило 18 электронов, тогда как V (CO)6 имеет 17 валентных электронов.[1]
Синтез
Традиционно V (CO)6 готовится в два этапа через посредство V (CO)−
6. На первом этапе VCl3 уменьшается металлическим натрий под 200 атм CO при 160 ° C. Растворителем для этого восстановления обычно является диглим, CH3ОСН2CH2ОСН2CH2ОСН3. Это триэфир растворяет соли натрия, аналогично поведению краун-эфир:
- 4 Na + VCl3 + 6 CO + 2 диглима → [Na (диглим)2] [V (CO)6] + 3 NaCl
Образовавшийся анион окисляется кислотой:[2]
- 2 V (CO)−
6 + 2 часа3PO4 → 2 В (CO)6 + H2 + 2 ЧАС
2PO−
4
Реакции
Гексакарбонил ванадия термически нестабилен. Его первичная реакция - восстановление до моноаниона. V (CO)−
6, соли которых хорошо изучены. Он также подвержен замещению третичным фосфиновые лиганды, часто приводя к непропорциональность.
V (CO)6 реагирует с источниками циклопентадиенил анион, чтобы дать апельсину комплекс четвероногих стульев для фортепиано (C5ЧАС5) V (СО)4 (т.пл.136 ° C). Как и многие металлоорганические соединения с нейтральным зарядом, этот полусэндвич летучий. В исходном препарате этого вида C5ЧАС5HgCl использовался в качестве источника C
5ЧАС−
5.
Структура
V (CO)6 принимает восьмигранный координационная геометрия и изоструктурна с гексакарбонил хрома, даже несмотря на то, что они имеют разное количество валентных электронов. Рентгеновская кристаллография высокого разрешения показывает, что молекула слегка искажена двумя (осевой) более короткие расстояния V – C 1,993 (2) Å по сравнению с четырьмя (экваториальными) 2,005 (2) Å. Несмотря на то, что V (−I) более крупный ион, чем V (0), расстояния V – C в V (CO)−
6 на 0,07 Å короче, чем в нейтральном предшественнике.[3]
Рекомендации
- ^ Elschenbroich, C .; Зальцер, А. (1992). Металлоорганические соединения: краткое введение (2-е изд.). Вайнхайм: Wiley-VCH. ISBN 3-527-28165-7.
- ^ Лю, X .; Эллис, Дж. Э. (2004). «Гексакарбонильванадат (1-) и гексакарбонильванадий (0)». Неорг. Синтезатор. 34: 96–103. Дои:10.1002 / 0471653683.ch3. ISBN 0-471-64750-0.
- ^ Bellard, S .; Рубинсон, К. А .; Шелдрик, Г. М. (1979). «Кристаллическая и молекулярная структура гексакарбонила ванадия». Acta Crystallographica. B35: 271–274. Дои:10.1107 / S0567740879003332.
дальнейшее чтение
- Оригинальный синтез: Ercoli, R .; Calderazzo, F .; Альберола, А. (1960). «Синтез гексакарбонила ванадия». Варенье. Chem. Soc. 81: 2966–2967. Дои:10.1021 / ja01496a073.
