Асимметричный гидролиз сложного эфира эстеразой свиной печени - Asymmetric ester hydrolysis with pig-liver esterase
Асимметричный гидролиз сложного эфира эстеразой печени свиньи это энантиоселективное преобразование из сложный эфир к карбоновая кислота через действие фермент свиная печень эстераза (EC 3.1.1.1). Асимметричный эфир гидролиз включает избирательную реакцию одного из пары либо энантиотопный (внутри той же молекулы и связаны плоскость симметрии молекулы) или энантиоморфный (в энантиомерных молекулах и связанных как зеркальные отражения) сложноэфирные группы.[1]
Вступление
Ферменты, в состав которых входят хиральный аминокислоты, катализируют химические реакции с высоким стереоселективность. В частности, ферменты эстеразы катализируют гидролиз сложных эфиров до карбоновые кислоты. Это преобразование может быть выполнено асимметричный если в субстрате существуют две группы энантиотопного сложного эфира или если рацемическая смесь хиральных эфиров. В первом случае (десимметризация ) хиральное окружение активного центра фермента приводит к селективному гидролизу сложного эфира, который ближе к каталитически активному. серин остаток, когда субстрат связан с ферментом. В последнем случае (кинетическое разрешение ), один из энантиомеров гидролизуется быстрее, чем другой, что приводит к избытку гидролизованного продукта одного энантиомера. Обе стратегии основаны на том факте, что переходные состояния для гидролиза энантиотопных или энантиоморфных сложноэфирных групп хиральным ферментом являются диастереомерный.[2]
Эстераза печени свиньи (PLE) - широко используемый фермент для гидролиза асимметричного сложного эфира. Хотя первоначально он использовался для десимметричного гидролиза сложных эфиров глутарата,[3] PLE также гидролизует малонаты, циклические диэфиры, моноэфиры, и другие подложки. Для объяснения избирательности PLE были усовершенствованы модели активных сайтов.[4]
(1)

Механизм и стереохимия
Преобладающий механизм
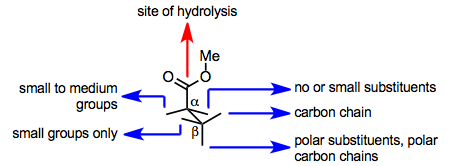
Активный центр PLE способствует как связыванию субстрата, так и гидролизу. Ключевой остаток серина в активном центре способствует гидролизу, но субстрат должен представлять сложноэфирную группу этому остатку после связывания с активным центром фермента, чтобы произошел гидролиз. Способен ли субстрат представлять сложноэфирную группу каталитическому сериновому остатку, зависит от его связанной конформации в активном центре, которая определяется аминокислотой. боковые цепи на активном сайте. Таким образом, модели активного центра PLE были разработаны с целью прогнозирования по структуре субстрата, какая из двух групп энантиотопного сложного эфира будет гидролизоваться (или будет ли гидролиз вообще происходить).
Простая модель конформации связывания сложного эфира в активном центре PLE показана ниже. Эта модель точно предсказывает конфигурацию гидролизованных глутаратов и подобных субстратов.
(2)
Объем и ограничения
Хотя субстратный диапазон PLE широк, энантиоселективность варьируется в зависимости от структуры субстрата. В этом разделе описаны субстраты, которые гидролизуются PLE с наивысшей энантиоселективностью, а также чувствительные субстраты, которые могут гидролизоваться до ахиральный карбоновые кислоты с высоким выходом без побочных реакций.
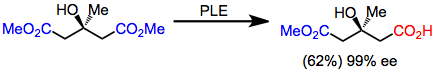
Глутараты были первыми субстратами, которые подверглись гидролизу с помощью PLE с высокой энантиоселективностью. Хотя выходы умеренные, энантиоселективность чрезвычайно высока.[5]
(3)
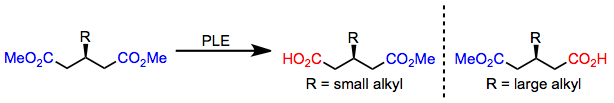
3-Алкилглутараты с небольшими алкильными заместителями гидролизуются до (р) -моноэфир; однако, когда присутствует большой алкильный заместитель, (S) -моноэфирные формы.[6] Это переключение энантиоселективности точно предсказывается моделью активного сайта, приведенной выше.
(4)
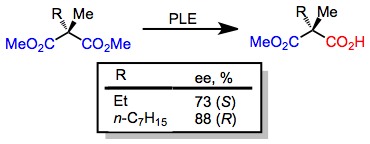
Противоположная тенденция наблюдается при десимметричных гидролизах 2-метилмалонаты, которые предоставляют (S) энантиомер, когда другой заместитель на C-2 небольшой, и (р) энантиомер, когда другой заместитель C-2 является большим.[7]
(5)
Номер мезо диэфиры, отличные от субстратов, описанных выше, могут быть гидролизованы PLE с высокой энантиоселективностью. Циклический мезо сложные диэфиры имеют тенденцию к более селективному гидролизу, чем ациклические диэфиры.[8] Преобладающий энантиомер продукта зависит от размера кольца.[9][10]
(6)

7-оксабицикло [2.2.1] гептан-2,3-дикарбоксилаты представляют собой интересный класс диэфиров, которые гидролизуются PLE с высокой энантиоселективностью.[11] Эти субстраты были использованы для энантиоселективного конструирования биологически релевантных сахаров (см. Ниже синтетические применения).
(7)
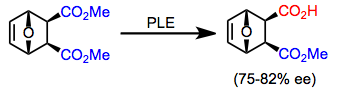
Рацемические смеси всех субстратов, описанных выше, а также дополнительных хиральных сложных диэфиров (таких как эпоксидный эфир в уравнении (8)) могут быть разделены с использованием PLE для кинетического разрешения.[12] Существенным недостатком кинетического разрешения является максимальный выход гидролизованного продукта 50%. Однако если наряду с гидролизом происходит быстрая рацемизация (пример динамическое кинетическое разрешение ) возможна максимальная доходность 100%.[13]
(8)
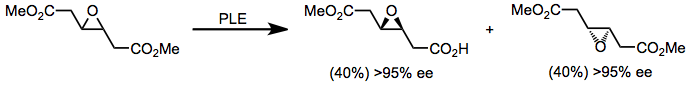
Ферменты эстеразы также можно использовать для гидролиза сложных моноэфиров, чувствительных к основанию. PLE применялся для синтеза простагландинов для селективного гидролиза сложного эфира без разрушения фрагмента β-гидроксикетона.[14]
(9)

Синтетические приложения
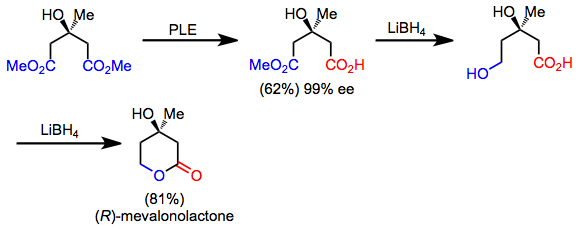
Ряд синтетических мишеней обладают скрытой симметрией, которую можно обнаружить, применив ретросинтетическое «симметризующее» преобразование. В прямом направлении эта операция соответствует реакции десимметризации. Например, мевалонолактон можно быстро синтезировать из симметричного сложного диэфира посредством десимметричного гидролиза, хемоселективного восстановления и лактонизации.[5] Хотя сам продукт является асимметричным, десимметризация и манипуляции с функциональными группами позволяют его синтезировать из ахирального исходного материала.
(10)
Энантиоселективный гидролиз конъюгированного сложного диэфира с последующим озонолизом дает скелет рибозы. Полученные сахара затем используются для синтеза нуклеозидов.[15]
(11)

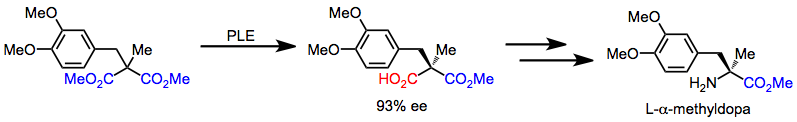
L-α-Метилдопа может быть быстро синтезирован из ахирального малоната через последовательность, начинающуюся с десимметризации. Последующие хемоселективные превращения превращают карбоновую кислоту в амин.[16]
(12)
Сравнение с другими методами
Другие ферменты, которые можно использовать для гидролиза асимметричного сложного эфира, включают ацетилхолинэстеразу электрического угря,[17] химотрипсин,[3] и пекарские дрожжи.[18] Объем субстратов этих ферментов отличается от PLE, и в некоторых случаях они могут давать гидролизованные продукты с более высоким выходом или энантиоселективностью, чем PLE. Микроорганизмы также может быть использован для энантиоселективного гидролиза;[19] однако трудности, связанные с обращением с микроорганизмами, сделали эти методы непопулярными для органического синтеза.
В неферментативных методах дифференциации энантиотопных групп используются хиральные катализаторы или вспомогательные вещества. Например, введение хиральной уходящей группы в обе группы карбоновой кислоты мезо двухосновная кислота приводит к избирательной атаке ахиральным нуклеофилом на одну из (теперь уже) диастереотопных карбонильных групп.[20]
(13)
Условия и методика экспериментов
Типичные условия
Ферментативные реакции ограничены необходимостью использования водного растворителя и условий реакции, близких к нейтральным. Гидролиз PLE обычно проводят с фосфатным буфером для поддержания pH от 7 до 8. Поскольку растворимость субстрата в водной среде имеет решающее значение, небольшое количество полярного органического сорастворителя иногда добавляют к водному раствору фермент. Коммерчески доступный PLE имеет достаточную чистоту для большинства приложений.
Рекомендации
- ^ Оно, М .; Оцука, М. Орг. Реагировать. 1989, 37, 1. Дои:10.1002 / 0471264180.or037.01
- ^ Rétey, J .; Робинсон, Дж. Стереоспецифичность в органической химии и энзимологии, Verlag Chemie, Weinheim, 1982.
- ^ а б Cohen, S .; Хедоури, Э. Варенье. Chem. Soc. 1961, 83, 1093.
- ^ Zemlicka, J .; Craine, L .; Heeg, M.-J .; Оливер, Дж. J. Org. Chem. 1988, 53, 937.
- ^ а б Huang, F.-C .; Lee, L. F. H .; Mittal, R. S. D .; Ravikumar, P. R .; Chan, J. A .; Sih, C.J .; Capsi, E .; Экк, К. Варенье. Chem. Soc. 1975, 97, 4144.
- ^ Lam, L.K.P .; Hui, R.A.H.F .; Джонс, Дж. Б. J. Org. Chem. 1986, 51, 2047.
- ^ Björkling, F .; Boutelje, J .; Gatenbeck, S .; Hult, K .; Норин, Т .; Шмулик, П. Тетраэдр 1985, 41, 1347.
- ^ Mohr, P .; Waespe-Sarevi, N .; Тамм, Ц .; Gawronska, K .; Гавронски, Я. Helv. Чим. Acta 1983, 66, 2501.
- ^ Sabbioni, G .; Shea, M. L .; Джонс, Дж. Б. J. Chem. Soc., Chem. Commun. 1984, 236.
- ^ Schneider, M .; Энгель, Н .; Hönicke, P .; Heinemann, G .; Гериш, Х. Энгью. Chem. Int. Эд. Англ. 1984, 23, 67.
- ^ Guanti, G .; Banfi, L .; Narisano, E .; Riva, R .; Теа, С. Tetrahedron Lett. 1986, 27, 4639.
- ^ Mohr, P .; Rösslein, L .; Тамм, К. Helv. Чим. Acta 1987, 70, 142.
- ^ Allen, J .; Уильямс, Дж. Tetrahedron Lett. 1996, 37, 1859.
- ^ Hazato, A .; Танака, Т .; Тору, Т .; Okamura, N .; Bannai, K .; Sugiura, S .; Manabe, K .; Куродзуми, С. Ниппон Кагаку Кайси 1983, 9, 1390 [C.A., 100, 120720q (1984)].
- ^ Оно, М .; Кобаяши, С .; Адачи, К. в Ферменты как катализаторы органического синтеза, Schneider, M. P. Ed., D. Reidel Publishing, Dordrecht, 1986, стр. 123–142.
- ^ Björkling, F .; Boutelje, J .; Gatenbeck, S .; Hult, K .; Норин, Т. Tetrahedron Lett. 1985, 26, 4957.
- ^ Deardorff, D. R .; Matthews, A.J .; McMeekin, D. S .; Крэйни, К. Tetrahedron Lett. 1986, 27, 1255.
- ^ Кершер, В .; Крейзер, В. Tetrahedron Lett. 1987, 28, 531.
- ^ Kotani, H .; Kuze, Y .; Uchida, S .; Miyabe, T .; Иимори, Т .; Окано, К .; Кобаяши, С .; Оно, М .; Agric. Биол. Chem. 1983, 47, 1363.
- ^ Nagao, Y .; Икеда, Т .; Яги, М .; Fujita, E .; Широ, М. Варенье. Chem. Soc. 1982, 104, 2079.
