Гексаборид кальция - Calcium hexaboride
 | |
| Имена | |
|---|---|
| Название ИЮПАК Гексаборид кальция | |
| Другие имена Борид кальция | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ChemSpider | |
| ECHA InfoCard | 100.031.374 |
| Номер ЕС |
|
PubChem CID | |
| |
| |
| Характеристики | |
| Такси6 | |
| Молярная масса | 104,94 г / моль |
| Внешность | черный порошок |
| Плотность | 2,45 г / см3 |
| Температура плавления | 2235 ° С (4055 ° F, 2508 К) |
| нерастворимый | |
| Структура | |
| Кубический | |
| пм3м ; Очас[1] | |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Гексаборид кальция (иногда борид кальция) представляет собой соединение кальций и бор с химической формулой CaB6. Это важный материал из-за его высокой электрическая проводимость, твердость, химическая стабильность и температура плавления. Это черный, блестящий, химически инертный порошок с низкой плотностью. Он имеет кубическую структуру, типичную для гексаборидов металлов, с октаэдрическими звеньями из 6 атомов бора в сочетании с атомами кальция.[2] Такси6 и лантан -допированный CaB6 оба показывают слабые ферромагнитный свойств, что является замечательным фактом, поскольку кальций и бор не являются магнитными и не имеют внутренних 3d- или 4f-электронных оболочек, которые обычно требуются для ферромагнетизма.
Характеристики
Такси6 был исследован в прошлом из-за множества специфических физических свойств, таких как сверхпроводимость, колебание валентности и Кондо эффекты.[3] Однако самое замечательное свойство CaB6 это его ферромагнетизм. Это происходит при неожиданно высокой температуре (600 К) и малом магнитном моменте (ниже 0,07 К). на атом). Источником этого высокотемпературного ферромагнетизма является ферромагнитная фаза разбавленного электронного газа, связь с предполагаемым экситонным состоянием в бориде кальция или внешние примеси на поверхности образца. Примеси могут включать утюг и никель, вероятно, из-за примесей бора, использованного для приготовления образца.[4]
Такси6 не растворяется в H2O, MeOH (метанол) и EtOH (этанол) и медленно растворяется в кислотах.[5] Его микротвердость 27 ГПа, Твердость по Кнупу 2600 кг / мм2), Модуль Юнга составляет 379 ГПа, а удельное электрическое сопротивление больше 2 · 1010 Ом · м для чистых кристаллов.[6][7] Такси6 представляет собой полупроводник с шириной запрещенной зоны, равной 1,0 эВ. Низкая полуметаллическая проводимость многих CaB6 образцы можно объяснить непреднамеренным легированием из-за примесей и возможной нестехиометрии.[8]
Структурная информация
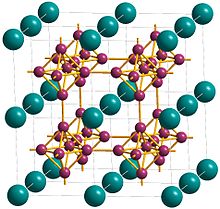
Кристаллическая структура гексаборида кальция представляет собой кубическую решетку с кальцием в центре ячейки и компактными правильными октаэдрами атомов бора, связанными в вершинах связями B-B, образуя трехмерную сетку бора.[5] Каждый кальций имеет 24 ближайших соседних атома бора.[1] Атомы кальция расположены в простой кубической упаковке, так что между группами из восьми атомов кальция, расположенными в вершинах куба, есть дыры.[9] Простая кубическая структура расширяется за счет введения октаэдрической B6 группы, и структура представляет собой CsCl-подобную упаковку групп кальция и гексаборида.[9] Другой способ описания гексаборида кальция - наличие металла и B62− октаэдрические полимерные анионы в структуре типа CsCl, где атомы кальция занимают позиции Cs, а B6 октаэдры в узлах Cl.[10] Длина связи Ca-B составляет 3,05 Å, а длина связи B-B составляет 1,7 Å.[9]
43Данные Ca ЯМР содержат δвершина горы при -56,0 частей на миллион и δiso при -41,3 частей на миллион, где δiso принята ширина пика max +0,85, отрицательный сдвиг обусловлен высоким координационным числом.[10]
Рамановские данные: гексаборид кальция имеет три рамановских пика при 754,3, 1121,8 и 1246,9 см.−1 за счет активных режимов A1 г, Eграмм, и т2 г соответственно.[1]
Наблюдаемые частоты колебаний см−1 : 1270 (сильный) от A1 г растяжка, 1154 (мед.) и 1125 (плечо) от Eграмм stretch, 526, 520, 485 и 470 от F1 г вращение, 775 (сильное) и 762 (плечо) от F2 г изгиб, 1125 (сильный) и 1095 (слабый) от F1U изгиб, 330 и 250 от F1U перевод, а также 880 (мед.) и 779 из F2u сгибать.[1]
Подготовка
- Одна из основных реакций промышленного производства:[6]
- CaO + 3 В2О3 + 10 мг → CaB6 + 10 MgO
Другие методы получения CaB6 порошок включает:
- Прямая реакция кальция или оксид кальция и бор при 1000 ° С;
- Ca + 6B → CaB6
- Реагируя на Ca (OH)2 с бором в вакууме примерно при 1700 ° C (карботермическое восстановление );[11]
- Са (ОН)2 + 7B → CaB6 + BO (г) + H2O (г)
- Реагируя карбонат кальция с карбид бора в вакууме при температуре выше 1400 ° C (карботермическое восстановление)
- Реакция CaO и H3BO3 и Mg до 1100 ° C.[5]
- Низкотемпературный (500 ° C) синтез
- CaCl2 + 6NaBH4 → CaB6 + 2NaCl + 12H2 + 4Na
приводит к относительно низкому качеству материала.[12]
- Для производства чистого CaB6 монокристаллы, например, для использования в качестве катодного материала, полученный таким образом CaB6 порошок далее перекристаллизовывается и очищается зона плавки техника. Типичная скорость роста составляет 30 см / ч, а размер кристаллов ~ 1х10 см.[11]
- Монокристалл CaB6 Нанопровода (диаметр 15–40 нм, длина 1–10 мкм) может быть получен пиролизом диборан (B2ЧАС6) над порошками оксида кальция (CaO) при 860–900 ° C в присутствии никелевого катализатора.[7]
Использует
Гексаборид кальция используется в производстве бора.легированный стали [5] и как раскисление агент по производству бескислородная медь. Последнее приводит к более высокой проводимости, чем обычно раскисленная фосфором медь, из-за низкой растворимости бора в меди.[6] Такси6 также может служить высокотемпературным материалом, защитой поверхности, абразивы, инструменты и износостойкий материал.
Такси6 обладает высокой проводимостью, имеет низкий рабочая функция, и поэтому может использоваться как горячий катод материал. При использовании при повышенной температуре гексаборид кальция окисляется, ухудшая его свойства и сокращая срок его службы.[13]
Такси6 также является многообещающим кандидатом в n-тип термоэлектрический материалов, поскольку его коэффициент мощности больше или сопоставим с коэффициентом мощности обычных термоэлектрических материалов Bi2Te3 и PbTe.[7]
СаВ также может использоваться в качестве антиоксиданта в огнеупорах на углеродной связке.
Меры предосторожности
Гексаборид кальция раздражает глаза, кожу и дыхательную систему. При работе с этим продуктом необходимо использовать соответствующие защитные очки и одежду. Никогда не сливайте гексаборид кальция в канализацию и не добавляйте в него воду.
Смотрите также
Рекомендации
- ^ а б c d Yahia, S .; Turrell, S .; Turrell, G .; Меркурио, Дж. П. (1990). «Инфракрасный и рамановский спектры гексаборидов: расчеты силового поля и изотопические эффекты». J. Mol. Struct. 224 (1–2): 303–312. Bibcode:1990JMoSt.224..303Y. Дои:10.1016 / 0022-2860 (90) 87025-С.
- ^ Маткович, В. И. (1977). Бор и тугоплавкие бориды. Берлин: Springer-Verlag. ISBN 0-387-08181-X.
- ^ Ж. Этурно; П. Хагенмюллер (1985). «Строение и физические особенности боридов редкоземельных элементов». Филос. Mag. B. 52 (3): 589. Bibcode:1985PMagB..52..589E. Дои:10.1080/13642818508240625..
- ^ Янг, Д. П.; и другие. (1999). «Высокотемпературный слабый ферромагнетизм в газе свободных электронов низкой плотности». Природа. 397 (6718): 412–414. Bibcode:1999Натура.397..412л. Дои:10.1038/17081. PMID 29667965. S2CID 204991033.
- ^ а б c d «Борид кальция - словарь неорганических соединений». Университетское издательство. Кембридж. 1. 1992.
- ^ а б c «Бориды: химия твердого тела». Энциклопедия неорганической химии. 1. Западный Сассекс, Англия: John Wiley & Sons. 1994 г.
- ^ а б c Терри Т. Сюй; Цзянь-Го Чжэн; Алан В. Николлс; Саша Станкович; Ричард Д. Пайнер; Родни С. Руофф (2004). "Монокристаллические нанопроволоки гексаборида кальция: синтез и характеристика". Nano Lett. 4 (10): 2051–2055. Bibcode:2004NanoL ... 4.2051X. Дои:10.1021 / nl0486620.
- ^ С. Сума; и другие. (2003). «Электронная зонная структура и поверхность Ферми CaB.6 Изучено методом фотоэмиссионной спектроскопии с угловым разрешением ». Phys. Rev. Lett. 90 (2): 027202. Bibcode:2003ПхРвЛ..90б7202С. Дои:10.1103 / PhysRevLett.90.027202. PMID 12570575.
- ^ а б c Уэллс, А. Ф. (1984). Структурная неорганическая химия. Оксфорд: Clarendon Press. С. 1055–1056. ISBN 0-19-855125-8.
- ^ а б Zhongijie, L .; Smith, M.E .; Sowrey, F.E .; Ньюпорт, Р. Дж. (2004). «Исследование локального структурного окружения кальция с помощью твердотельного ЯМР 43Ca в естественных условиях» (PDF). Физический обзор B. 69 (22): 224107. Bibcode:2004PhRvB..69v4107L. Дои:10.1103 / PhysRevB.69.224107.
- ^ а б С. Отани (1998). «Приготовление CaB6 кристаллы методом плавающей зоны ». Журнал роста кристаллов. 192 (1–2): 346–349. Bibcode:1998JCrGr.192..346O. Дои:10.1016 / S0022-0248 (98) 00444-8.
- ^ Shi, L .; и другие. (2003). «Низкотемпературный синтез и характеристика кубического CaB6 Ультратонкие порошки ». Chem. Латыш. 32 (10): 958. Дои:10.1246 / класс 2003.958.
- ^ Чжиган Р. Ли; Хун Мэн (2006). Органические светоизлучающие материалы и устройства. CRC Press. п. 516. ISBN 1-57444-574-X.
дальнейшее чтение
- Гринвуд, Норман Н.; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн. ISBN 978-0-08-037941-8.

