ДНК аденин метилаза - DNA adenine methylase
| Сайт-специфическая ДНК-метилтрансфераза (аденин-специфическая) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Номер ЕС | 2.1.1.72 | ||||||||
| Количество CAS | 69553-52-2 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||
ДНК аденин метилаза, (Дамметилаза)[1] (также сайт-специфическая ДНК-метилтрансфераза (аденин-специфическая), EC 2.1.1.72, модификация метилазы, система ограничения-модификации) является фермент что добавляет метильная группа к аденин последовательности 5'-GATC-3 'во вновь синтезированном ДНК.[2][3] Незамедлительно после Синтез ДНК, дочерняя цепь непродолжительное время остается неметилированной.[4] Это орфанная метилтрансфераза, которая не является частью системы рестрикции-модификации и регулирует экспрессию генов.[5][6][7][8] Этот фермент катализирует следующее химическая реакция
- S-аденозил-L-метионин + ДНК аденин S-аденозил-L-гомоцистеин + ДНК 6-метиламинопурин
Это большая группа ферментов, уникальных для прокариот и бактериофагов.[9]
В Кишечная палочка Фермент ДНК-аденинметилтрансфераза (Dam) широко используется для профилирования хроматина, DamID. В котором Dam сливается с представляющим интерес ДНК-связывающим белком и экспрессируется в виде трансгена в генетически поддающемся трактовке модельном организме для идентификации сайтов связывания белка.[10]
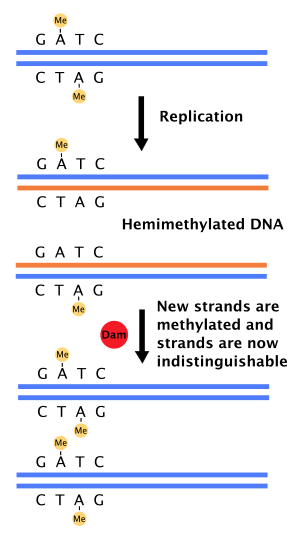
Роль в восстановлении несоответствия ДНК
Когда ДНК-полимераза делает ошибку, приводящую к несовпадению пары оснований или небольшой вставке или удалению во время Синтез ДНК, то клетка буду восстановить ДНК тропой, называемой ремонт несоответствия. Однако клетка должна иметь возможность различать цепочку-матрицу и вновь синтезированную цепь. В некоторых бактерии, Нити ДНК метилированы метилазой Dam, и, следовательно, немедленно после репликация, ДНК будет гемиметилирована.[4] Фермент восстановления, MutS, связывается с несовпадениями в ДНК и рекрутирует MutL, который впоследствии активирует эндонуклеаза MutH. MutH связывает гемиметилированные сайты GATC и при активации избирательно расщепляет неметилированную дочернюю цепь, позволяя геликаза и экзонуклеазы для вырезания формирующейся цепи в области, окружающей несовпадение.[4][11] Затем нить повторно синтезируется ДНК-полимераза III.
Роль в регуляции репликации
Стрельба из начало репликации (oriC) в клетках бактерий строго контролируется, чтобы репликация ДНК происходила только один раз во время каждого деления клетки. Частично это можно объяснить медленным гидролизом АТФ с помощью DnaA, белка, который связывается с повторами в oriC, чтобы инициировать репликацию. Метилаза Dam также играет роль, потому что oriC имеет 11 5'-GATC-3 'последовательностей (в Кишечная палочка). Сразу после репликации ДНК oriC гемиметилируется и на некоторое время изолируется. Только после этого oriC высвобождается и должен быть полностью метилирован Dam-метилазой до того, как произойдет связывание DnaA.
Роль в регуляции экспрессии белка
Дамба также играет роль в продвижении и подавлении Транскрипция РНК. В Кишечная палочка нижестоящие последовательности GATC метилированный, способствуя транскрипции. Например, пиелонефрит -ассоциированный пили (ПАП) изменение фазы в уропатогенный Кишечная палочка контролируется Dam через метилирование двух сайтов GATC проксимальнее и дистальнее PAP промоутер.[12] Учитывая его роль в регуляции белков в Кишечная палочкаген метилазы Dam несущественен, поскольку нокаут этого гена по-прежнему оставляет бактерии жизнеспособными.[13] Сохранение жизнеспособности несмотря на плотина нокаут гена также наблюдается в Сальмонелла и Aggregatibacter actinomycetemcomitans.[14][15] Однако у организмов типа Холерный вибрион и Иерсиний псевдотуберкулез, то плотина ген необходим для жизнеспособности.[16] Нокаут плотина ген в Aggregatibacter actinomycetemcomitans привело к нарушению регуляции уровня белка, лейкотоксина, а также снизило способность микробов проникать в эпителиальные клетки полости рта.[15] Кроме того, исследование дефицита метилазы дам Streptococcus mutans, стоматологический патоген, выявил нарушение регуляции 103 генов, некоторые из которых обладают кариесогенным потенциалом.[16]
Конструктивные особенности
Сходство каталитических доменов C5-цитозинметилтрансфераз и N6- и N4-аденинметилтрансфераз вызвало большой интерес в понимании основ функциональных сходств и различий. Метилтрансферазы или метилазы классифицируются на три группы (группы α, β и γ) на основе последовательного порядка определенных 9 мотивов и домена распознавания мишени (TRD).[17] Мотив I состоит из трипептида Gly-X-Gly и называется G-петлей, и он участвует в связывании S-аденозил метионин кофактор.[18] Мотив II является высококонсервативным среди N4- и N6-аденин-метилаз и содержит отрицательно заряженную аминокислоту, за которой следует гидрофобная боковая цепь в последних положениях β2-цепи для связывания AdoMet.[17] Мотив III также участвует в связывании Adomet. Мотив IV особенно важен и хорошо известен при характеристике метилазы. Он состоит из дипролильного компонента и является высококонсервативным среди N6-аденинметилтрансфераз в качестве мотива DPPY, однако этот мотив может различаться для N4-аденин- и C5-цитозинметилтрансфераз. Было обнаружено, что мотив DPPY является важным для связывания AdoMet.[19] Мотивы IV-VIII играют роль в каталитической активности, тогда как мотивы 1-III и X играют роль в связывании кофактора. Для N6-аденинметилаз последовательный порядок этих мотивов такой: N-концевой - X - I - II - III - TRD - IV - V - VI - VII - VIII - C-концевой и E. кишечная палочка Дам-метилаза следует этой структурной последовательности.[17] Кристаллографический эксперимент 2015 года показал, что E. кишечная палочка Метилаза Dam была способна связывать не-GATC ДНК с той же последовательностью мотивов, о которой говорилось; Авторы полагают, что полученная структура может служить основанием для репрессии транскрипции, не основанной на метилировании.[20]
Орфанные бактериальные и бактериофаговые метилазы
Дам-метилаза представляет собой орфан-метилтрансферазу, которая не является частью системы рестрикции-модификации, но действует независимо, регулируя экспрессию генов, репарацию несоответствий и репликацию бактерий среди многих других функций. Это не единственный пример орфанной метилтрансферазы, поскольку существует Метилтрансфераза, регулируемая клеточным циклом (CcrM), который метилирует полуметилированную ДНК 5'-GANTC-'3 для контроля жизненного цикла Caulobacter crescentus и другие родственные виды.[21]
В отличие от своих бактериальных аналогов, метилтрансферазы фаговых орфанов также существуют, особенно в T2, T4 и других T-четных бактериофагах, которые инфицируют E. coli.[5] В ходе исследования было выявлено, что, несмотря на общую гомологию последовательностей, Кишечная палочка и аминокислотные последовательности метилазы T4 Dam имеют идентичность последовательностей до 64% в четырех областях длиной от 11 до 33 остатков, что указывает на общее эволюционное происхождение генов бактериальной и фаговой метилазы.[22] Метилазы Т2 и Т4 отличаются от Э. coli Dam не только в их способности метилировать 5-гидроксиметилцитозин, но и метилировать неканонические участки ДНК. Несмотря на обширные in vitro характеристика этих избранных фаговых орфанных метилтрансфераз, их биологическое назначение до сих пор неясно.[5]
Смотрите также
Рекомендации
- ^ Браун, Теренс (2002). «Глава 14: Мутация, восстановление и рекомбинация. Раздел 2.3». Геномы. Наука о гирляндах. ISBN 0-471-25046-5.
- ^ Маринус М.Г., Моррис Н.Р. (июнь 1973 г.). «Выделение мутантов метилазы дезоксирибонуклеиновой кислоты Escherichia coli K-12». Журнал бактериологии. 114 (3): 1143–50. Дои:10.1128 / JB.114.3.1143-1150.1973. ЧВК 285375. PMID 4576399.
- ^ Гейер Г.Е., Модрич П. (февраль 1979 г.). «Последовательность распознавания метилазы dam из Escherichia coli K12 и способ расщепления эндонуклеазой Dpn I». Журнал биологической химии. 254 (4): 1408–13. PMID 368070.
- ^ а б c Баррас Ф., Маринус М.Г. (1989). «Великий GATC: метилирование ДНК в E. coli». Тенденции в генетике. 5 (5): 139–143. Дои:10.1016/0168-9525(89)90054-1. PMID 2667217.
- ^ а б c Мерфи Дж., Махони Дж., Эйнсворт С., Наута А., ван Синдерен Д. (декабрь 2013 г.). «Бактериофаги-орфанные ДНК-метилтрансферазы: сведения об их бактериальном происхождении, функции и возникновении». Прикладная и экологическая микробиология. 79 (24): 7547–55. Дои:10.1128 / aem.02229-13. ЧВК 3837797. PMID 24123737.
- ^ Кесслер C, Манта V (август 1990 г.). «Специфичность рестрикционных эндонуклеаз и модификации ДНК метилтрансфераз - обзор (издание 3)». Ген. 92 (1–2): 1–248. Дои:10.1016 / 0378-1119 (90) 90486-Б. PMID 2172084.
- ^ Робертс Р.Дж. (апрель 1990 г.). «Рестрикционные ферменты и их изошизомеры». Исследования нуклеиновых кислот. 18 Дополнение: 2331–65. Дои:10.1093 / nar / 18.suppl.2331. ЧВК 331877. PMID 2159140.
- ^ Юань Р. (1981). «Структура и механизм многофункциональных эндонуклеаз рестрикции». Ежегодный обзор биохимии. 50: 285–319. Дои:10.1146 / annurev.bi.50.070181.001441. PMID 6267988.
- ^ Робертс Р.Дж., Маселис Д. (ред.). «База данных рестрикционных ферментов». REBASE. Получено 22 февраля 2020.
- ^ Огхи Г. Н., Саутхолл ТД (январь 2016 г.). «Черт возьми, это хорошо! DamID-профили взаимодействия белок-ДНК». Междисциплинарные обзоры Wiley. Биология развития. 5 (1): 25–37. Дои:10.1002 / wdev.205. ЧВК 4737221. PMID 26383089.
- ^ Лёбнер-Олесен А., Сковгаард О., Маринус М.Г. (апрель 2005 г.). «Метилирование плотины: координация клеточных процессов». Текущее мнение в микробиологии. 8 (2): 154–60. Дои:10.1016 / j.mib.2005.02.009. PMID 15802246.
- ^ Casadesús J, Low D (сентябрь 2006 г.). «Эпигенетическая регуляция генов в бактериальном мире». Обзоры микробиологии и молекулярной биологии. 70 (3): 830–56. Дои:10.1128 / MMBR.00016-06. ЧВК 1594586. PMID 16959970.
- ^ Бэйл А., д'Аларкао М., Маринус М.Г. (февраль 1979 г.). «Характеристика мутантов по метилированию аденина ДНК Escherichia coli K12». Мутационные исследования. 59 (2): 157–65. Дои:10.1016/0027-5107(79)90153-2. PMID 375073.
- ^ Николсон Б., Low D (февраль 2000 г.). «Зависимая от метилирования ДНК регуляция экспрессии pef в Salmonella typhimurium». Молекулярная микробиология. 35 (4): 728–42. Дои:10.1046 / j.1365-2958.2000.01743.x. PMID 10692151.
- ^ а б Ву Х, Липпманн Дж. Э., Оза Дж. П., Цзэн М., Файвс-Тейлор П., Райх NO (август 2006 г.). «Инактивация ДНК-аденинметилтрансферазы изменяет факторы вирулентности Actinobacillus actinomycetemcomitans». Микробиология и иммунология полости рта. 21 (4): 238–44. Дои:10.1111 / j.1399-302x.2006.00284.x. PMID 16842508.
- ^ а б Хулио С.М., Хейтофф Д.М., Провенцано Д., Клозе К.Э., Синсхаймер Р.Л., Низкий Д.А., Махан М.Дж. (декабрь 2001 г.). «ДНК-аденинметилаза необходима для жизнеспособности и играет роль в патогенезе Yersinia pseudotuberculosis и Vibrio cholerae». Инфекция и иммунитет. 69 (12): 7610–5. Дои:10.1128 / iai.69.12.7610-7615.2001. ЧВК 98854. PMID 11705940.
- ^ а б c Мэлоун Т., Блюменталь Р.М., Ченг Х (ноябрь 1995 г.). «Структурный анализ выявляет девять мотивов последовательности, законсервированных среди ДНК-аминометилтрансфераз, и предлагает каталитический механизм для этих ферментов». Журнал молекулярной биологии. 253 (4): 618–32. Дои:10.1006 / jmbi.1995.0577. PMID 7473738.
- ^ Schluckebier G, O'Gara M, Saenger W, Cheng X (март 1995 г.). «Универсальная каталитическая доменная структура AdoMet-зависимых метилтрансфераз». Журнал молекулярной биологии. 247 (1): 16–20. Дои:10.1006 / jmbi.1994.0117. PMID 7897657.
- ^ Косых В.Г., Шлагман С.Л., Хаттман С. (июль 1993 г.). «Консервативный мотив последовательности DPPY в области IV ДНК- [N-аденин] -метилтрансферазы Dam T4 фага важен для связывания S-аденозил-L-метионина». Исследования нуклеиновых кислот. 21 (15): 3563–6. Дои:10.1093 / nar / 21.15.3563. ЧВК 331459. PMID 16617501.
- ^ Хортон-младший, Чжан X, Блюменталь RM, Ченг X (апрель 2015 г.). «Структуры ДНК-аденинметилтрансферазы (Dam) Escherichia coli в комплексе с последовательностью, не являющейся GATC: потенциальные последствия для независимой от метилирования репрессии транскрипции». Исследования нуклеиновых кислот. 43 (8): 4296–308. Дои:10.1093 / нар / gkv251. ЧВК 4417163. PMID 25845600.
- ^ Цвейгер Г., Марчинский Г., Шапиро Л. (январь 1994 г.). «Метилтрансфераза ДНК Caulobacter, которая функционирует только в предделенной клетке». Журнал молекулярной биологии. 235 (2): 472–85. Дои:10.1006 / jmbi.1994.1007. PMID 8289276.
- ^ Хаттман С., Уилкинсон Дж., Суинтон Д., Шлагман С., Макдональд П.М., Мозиг Г. (ноябрь 1985 г.). «Общее эволюционное происхождение генов ДНК-аденинметилтрансферазы плотины фага Т4 и хозяина Escherichia coli dam». Журнал бактериологии. 164 (2): 932–7. Дои:10.1128 / JB.164.2.932-937.1985. ЧВК 214344. PMID 3902803.

