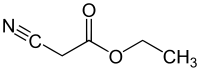
Этил цианоацетат - Ethyl cyanoacetate
 | |
| Идентификаторы | |
|---|---|
3D модель (JSmol ) | |
| ChemSpider | |
| ECHA InfoCard | 100.003.009 |
| Номер ЕС |
|
PubChem CID | |
| UNII | |
| Номер ООН | 3276 2666 |
| |
| |
| Характеристики | |
| C5ЧАС7NО2 | |
| Молярная масса | 113.116 г · моль−1 |
| -67.3·10−6 см3/ моль | |
| Опасности | |
| Пиктограммы GHS |  |
| Сигнальное слово GHS | Предупреждение |
| H302, H312, H319, H332 | |
| P261, P264, P270, P271, P280, P301 + 312, P302 + 352, P304 + 312, P304 + 340, P305 + 351 + 338, P312, P322, P330, P337 + 313, P363, P501 | |
| NFPA 704 (огненный алмаз) | |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Этил цианоацетат является органическое соединение который содержит карбоксилатный эфир и нитрил. Это бесцветный[1] жидкость с приятным запахом. Этот материал используется в качестве исходного материала для синтеза из-за его разнообразия функциональных групп и химической активности.
Производство
Этилцианоацетат можно получить различными способами:
- Синтез нитрила Кольбе с помощью этилхлорацетат и цианид натрия.[2]
- Этерификация Фишера из цианоуксусная кислота с этиловый спирт при наличии сильного минеральные кислоты (например, концентрированный серная кислота ). Цианоуксусная кислота может быть получена синтезом нитрила Кольбе с использованием хлорацетата натрия и цианида натрия.[2]
- Реакция цианоацетата натрия с этилбромид в водно-органической двухфазной системе в присутствии катализатор межфазного переноса.[3]
- Окисление 3-этоксипропионитрила, эфир, с кислородом под давлением в присутствии ацетат кобальта (II) тетрагидрат в качестве катализатора и N-гидроксифталимид как радикальный генератор.[4]
Характеристики
Физические свойства

Этилцианоацетат - бесцветная жидкость, кипит при атмосферное давление при 209 ° С.[5] Давление пара следует за Уравнение антуана бревно10(P) = A− (B / (T + C)) (P в барах, T в K) с A = 7,46724, B = 3693,663 и C = 16,138 в диапазоне температур от 341 до 479 K[6] В твердой фазе два полиморфные формы может случиться.[7][требуется полная цитата ] Ниже -111 ° C кристаллическая форма II является доминирующей.[7] Выше этой температуры образуется кристаллическая форма I, плавящаяся при -22 ° C.[5] В теплоемкость при 25 ° C составляет 220,22 Дж · К−1 моль−1.[7]
Химические свойства
С его тремя различными реакционными центрами - нитрильным, сложноэфирным, кислотным. метилен сайт-этилцианоацетат - это универсальный синтетический строительный блок для множества функциональных и фармакологически активных веществ. Он содержит кислотную метиленовую группу, окруженную как нитрилом, так и карбонил, и поэтому может использоваться в реакциях конденсации, таких как Конденсация Кневенагеля или Майкл дополнение. Эта реактивность аналогична реактивности сложные эфиры из малоновая кислота. В качестве примера реакционной способности нитрила: диэтилмалонат получают из этилового эфира цианоуксусной кислоты реакцией с этанолом в присутствии сильные кислоты.[2] Обогрев при наличии этоксид натрия формирует димерный 3-амино-2-циано-2-пентендиациддиэфир.[8]
Использовать
Из-за своего функциональность цианоацетат реагирует:
- На нитрильная группа различными способами:
- Нуклеофильная атака на сложноэфирная группа, как часть ацильного замещения: реакция с аммиаком приводит к цианоацетамиду, который может быть преобразован дегидратацией с PCl5 или POCl3 к малононитрилу.[10]
- Через кислотный метиленовая группа как нуклеофил
Этилцианоацетат является строительным блоком для синтеза гетероциклы которые используются, например, в качестве лекарств:
- Аллопуринол, используемый для лечения хронической подагры, можно синтезировать, начиная с конденсации Кневенагеля с триэтилортоформиат; продукт конденсации подвергается циклизации с гидразином с образованием замещенного пиразола, а затем с формамидом до аллопуринола, замещенного пиразолопиримидина.[11]
- Производные пурина теофиллин, кофеин и мочевая кислота синтетически доступны из этилцианоацетата и N, N '-диметилмочевина.[12]
- В птеридин производная фолиевая кислота закреплен за комплекс витаминов группы B; этилцианоацетат и гуанидин может использоваться в качестве исходного материала в многоступенчатом конвергентный синтез.
- В пиррол этосуксимид используется для лечения эпилепсия, его можно получить из этилцианоацетата и бутанон в многоступенчатом синтезе.
- В пиримидин производная триметоприм используется как ко-тримоксазол в фиксированной комбинации с сульфаметоксазол используется в качестве бактериостатический агент и синтезируется из этилцианоацетата и 3,4,5-триметоксибензальдегид или его бензилхлорид.
Также многие другие функциональные гетероциклы с хорошими выходами доступны из этилцианоацетата, такие как 3-замещенные производные кумарина.[13]
Нециклические продукты из этого исходного материала включают:
- В противосудорожное средство вальпроевая кислота
- Этил цианоакрилат, используемый как суперклей, в результате реакции с формальдегид
Этилцианоацетат также используется для получения 3,3-дифенилпропан-1-амина, который является предшественником, используемым в синтезе Прениламин & Дропрениламин.
Безопасность
Этилцианоацетат имеет LD50 2820 мг / кг (перорально, крыса).[14]
использованная литература
- ^ Вход на Cyanessigsäureester. в: Römpp Online. Георг Тиме Верлаг, получено 15 июня 2016 г.
- ^ а б c Дж. К. Х. Инглис. «Этилцианоацетат». Органический синтез. Дои:10.15227 / orgsyn.008.0074.
- ^ Заявка на Европейский патент 1028105, Hanselmann, Paul & Hildebrand, Stefan, "Процесс получения цианоуксусных эфиров", опубликовано 16 августа 2000 г., передано Lonza AG.
- ^ Патент EP 1208081, Hanselmann, Paul & Hildebrand, Stefan, "Способ получения сложных эфиров цианоуксусной кислоты", опубликованный 14 апреля 2004 г., передан Lonza AG.
- ^ а б Запись CAS RN 105-56-6 в базе данных веществ GESTIS Институт охраны труда и здоровья, доступ 3 марта 2011 г.
- ^ Стулл, Д. (1947). «Давление паров чистых веществ органических соединений». Ind. Eng. Chem. 39 (4): 517–540. Дои:10.1021 / ie50448a022.
- ^ а б c Ходжаева, М.Г .; Бугаков, Ю.В .; Исмаилов, Т.С .: Теплоемкость и термодинамические функции этилцианоацетата в Хим.-Фарм. Жур. 21 (1987) 760-762, DOI: 10.1007 / BF00872889.
- ^ Дорохов, В. А .; Баранин, С. В .; Диб, А .; Богданов, В. С. (1992). "'Кодимеры N- (пирид-2-ил) амиды и этилцианоацетат ». Русь. Chem. Бюллетень. 41 (2): 287–291. Дои:10.1007 / bf00869516.
- ^ Чжэн, Шуянь; Ю, Чуньхуэй; Шен, Чжэнву (2012). «Этилцианоацетат: новый агент цианирования для катализируемого палладием цианирования арилгалогенидов». Орг. Латыш. 14 (14): 3644–3647. Дои:10.1021 / ol3014914.
- ^ Мэри Иглсон: Краткая энциклопедия химии, Вальтер де Грюйтер, Берлин - Нью-Йорк 1994, ISBN 3-11-011451-8.
- ^ Аксель Климанн, Юрген Энгель: "Pharmazeutische Wirkstoffe", 2. Aufl., Georg Thieme, Штутгарт - Нью-Йорк 1982, ISBN 3-13-558402-X.
- ^ Байер-Вальтер: "Lehrbuch der Organischen Chemie", 24. Aufl., S. Hirzel, Stuttgart - Leipzig 2004.
- ^ Аветисян, А. А .; Ванян Э. V .; Дангян, М. Т. (1980). «Синтез функционально замещенных кумаринов». Chem. Гетероцикл. Соединения. 15 (9): 959–960. Дои:10.1007 / BF00473834.
- ^ Харальд Стритматтер, Стефан Хильдбранд и Питер Поллак «Малоновая кислота и производные» в Энциклопедии промышленной химии Ульмана 2007, Wiley-VCH, Weinheim. Дои: 10.1002 / 14356007.a16_063.pub2

