Разочарованная пара Льюиса - Frustrated Lewis pair
В химии разочарованная пара Льюиса (ФЛП) представляет собой соединение или смесь, содержащую Кислота Льюиса и База Льюиса это из-за стерическое препятствие, не может сочетаться, чтобы сформировать классический аддукт.[1] Было разработано много видов FLP, и многие простые субстраты проявляют активацию.[2][3]
Открытие того, что некоторые ФЛП разделяют H2[4] вызвало стремительный рост исследований в области FLP. Из-за своей «непогашенной» реакционной способности такие системы реагируют по отношению к субстратам, которые могут подвергаться гетеролиз. Например, многие ФЛП раскололись молекулы водорода. Таким образом, смесь трициклогексилфосфин (PCy3) и трис (пентафторфенил) боран реагирует с водородом, давая соответствующий фосфоний и борат ионы:
Эта реакционная способность была использована для производства FLP, которые катализируют гидрирование реакции.[5]
Активация малых молекул
Было показано, что расстроенные пары Льюиса активируют многие небольшие молекулы либо за счет гетеролиза, либо за счет координации.
Водород
Открытие того, что некоторые FLP способны расщеплять и, следовательно, активировать H2[4] вызвало стремительный рост исследований в этой области. Активация и, следовательно, использование H2 важен для многих химических и биологических превращений. Использование FLP для высвобождения H2 не содержит металлов, это выгодно из-за стоимости и ограниченного предложения некоторых переходных металлов, обычно используемых для активации H2 (Ni, Pd, Pt).[6] Системы FLP реагируют на субстраты, которые могут подвергаться гетеролиз (например, водород) из-за «непогашенной» реакционной способности таких систем. Например, ранее было показано, что смесь трициклогексилфосфин (PCy3) и трис (пентафторфенил) боран реагирует с H2 дать соответствующие фосфоний и борат ионы:
В этой реакции PCy3 (База Льюиса) и B (C6F5)3 (кислота Льюиса) не может образовывать аддукт из-за стерических затруднений со стороны объемных циклогексильных и пентафторфенильных групп. Протон фосфора и гидрид из бората теперь «активированы» и впоследствии могут быть «доставлены» к органическому субстрату, что приводит к гидрирование.
Механизм активации дигидрогена ФЛП
Механизм активации H2 by FLPs обсуждается как для межмолекулярных, так и для внутримолекулярных случаев. В межмолекулярных ФЛП основание Льюиса является отдельной молекулой по отношению к кислоте Льюиса; считается, что эти отдельные молекулы взаимодействуют посредством вторичных дисперсионных взаимодействий Лондона, чтобы объединить основание Льюиса и кислоту (предварительный эффект), при этом небольшие молекулы могут затем взаимодействовать с ФЛП. Экспериментальные доказательства этого типа взаимодействия на молекулярном уровне неясны. Однако есть подтверждающие доказательства этого типа взаимодействия, основанные на компьютерных исследованиях DFT (Density Functional Theory). Внутримолекулярные FLP - это места, где кислота Льюиса и основание Льюиса объединены в одну молекулу ковалентным линкером. Несмотря на улучшенные «предорганизационные эффекты», считается, что жесткие внутримолекулярные каркасы FLP имеют пониженную реактивность по отношению к небольшим молекулам из-за снижения гибкости.
Пример активации дигидрогена
Активация H2 об использовании FLP впервые было сообщено в 2006 году.[4] В этом отчете наблюдалось, что борат фосфония претерпевает тепловую потерю H2 молекула, чтобы произвести фосфин и боран. Борат фосфония 1 был приготовлен из B (C6F5)3 и (C6ЧАС2Мне3)2PH, из-за стерических требований обеих этих молекул, традиционный аддукт не мог образоваться, и был получен цвиттерионный фосфоноборонат [Рис. 1]. «Обмен H-на-F» был проведен, чтобы дать 2 устойчивый к влаге и воздуху. Эта соль будет выделять молекулярный H2 при нагревании выше 100 ° C изменение цвета также наблюдалось от бесцветного 2 к оранжево-красному 3 (оба в THF). Эта реакция обращена реагированием 3 с H2 при 25 ℃, где изменение цвета обратное и 2 реформируется. Реакция H2 с 3 был успешным при температурах до 25 ℃. Перекристаллизация 3 из ТГФ получили бесцветные кристаллы аддукта 4.

Другие низкомолекулярные субстраты
FLP также реактивны по отношению ко многим ненасыщенным субстратам за пределами H2. Некоторые ФЛП реагируют с CO2, особенно при деоксигенационном восстановлении CO2 к метану.[7]
Этилен также реагирует с ФЛП:[8]
Чтобы пары кислота-основание вели себя как нуклеофильно, так и электрофильно одновременно, предлагается метод раскрытия цикла циклических простых эфиров, таких как ТГФ, 2,5-дигидрофуран, кумаран и диоксан.[9]
Использование в катализе
Гидрирование имина, нитрила и азиридина

Сокращение имины, нитрилы, и азиридины на первичный и вторичный амины традиционно осуществляется реагентами на основе гидридов металлов, например литийалюминийгидрид и цианоборгидрид натрия. Гидрирование этих ненасыщенных субстратов может осуществляться с помощью реакций, катализируемых металлами. Безметалловое каталитическое гидрирование проводили с использованием катализатора борат фосфония (R2PH) (C6F4) BH (C6F5)2 (R = 2,4,6-Me3C6ЧАС2) 1. Этот тип безметаллового гидрирования может заменить дорогостоящий металлический катализатор.
Предполагается, что механизм восстановления имина включает протонирование по азоту с образованием иминиевой соли. Основность азотного центра определяет скорость реакции. Имины с большим количеством электронов восстанавливаются с большей скоростью, чем имины с низким содержанием электронов. Образовавшийся иминиевый центр подвергается нуклеофильная атака боргидрид-анионом с образованием амина. Небольшие амины связываются с бораном, гася дальнейшие реакции. Эту проблему можно преодолеть различными способами: 1) Применение повышенных температур 2) Использование стерически объемные иминные заместители 3) Защита имина с помощью B (C6F5)3группа, которая также служит промотором кислоты Льюиса.[10]
Энантиоселективное гидрирование имина
Хиральный боронат Кислота Льюиса получено из (1р)-(+) -камфоры образуют разочарованную пару Льюиса с тБу3P, который выделяется в виде соли. Этот ФЛП катализирует энантиоселективный гидрирование некоторых арилиминов с высоким выходом, но умеренным ее (до 83%).

Хотя этот протокол интересен концептуально, он не является универсальным. Было обнаружено, что увеличение стерического объема я добываю заместители приводят к снижению выхода и ее из амин товар. метокси-замещенный имины демонстрируют превосходную урожайность и ее 'с.[10]
Асимметричные гидросилиляции
Группа катализаторов, фрустрированные пары Льюиса хиральных алкенилборанов и фосфинов, полезны для асимметричного гидросилилирования типа Пирса 1,2-дикарбонильных соединений и альфа-кетоэфиров, приводя к продуктам с высокой энантиоселективностью. Однако, по сравнению с обычным гидросилированием типа Пирса, асимметричные гидросилирование типа Пирса развиты не так хорошо.
В следующем примере хиральный алкенилборан образуется in situ из хирального диина и HB (C6F5)2. Гетеролитический разрыв связи Si-H от PhMe2SiH на катализаторе FLP образует ионный комплекс силилия и гидридобората.[11]
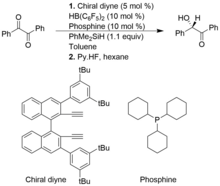
Гидрирование алкинов
Безметалловое гидрирование неактивированных внутренних алкинов до СНГ-алкены легко получить с использованием катализаторов на основе FLP.[12] Условия для этой реакции были относительно мягкими с использованием 2 бар H2. С точки зрения механизма, алкиновый материал является первым. гидроборированный и затем образующийся FLP на основе винилборана может активировать дигидроген. Шаг протодеборилирования высвобождает СНГ-алкеновый продукт, который получается за счет син-процесс гидроборилирования и регенерация катализатора. Хотя катализаторы на основе FLP активны для гидрирования алкинов, они не способствуют гидрированию алкенов в алканы.

Реакция представляет собой син-гидроборирование, и в результате наблюдается высокая цис-селективность. На заключительной стадии каталитического цикла C6F5 группа отщепляется легче, чем алкильная группа, вызывая разложение катализатора, а не высвобождение алкана. Каталитический цикл состоит из трех этапов:
- Связывание субстрата (гидроборирование алкина)
- ЧАС2 расщепление винилбораном с последующим внутримолекулярным протодеборилированием винильного заместителя с выделением N, N-диметил-2 - [(пентафторфенил) борил] анилина
- Высвобождение цис-алкена
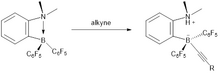
С внутренними алкинами происходит конкурентная реакция, когда протон, связанный с азотом, может быть добавлен к фторбензолам. Следовательно, это добавление не так интенсивно, образование алкена кажется благоприятным.
Но терминальные алкины не связываются с бором посредством гидроборирования, а скорее посредством активации C-H. Таким образом, добавление протона к алкину приведет к получению исходного концевого алкина. Следовательно, этот процесс гидрирования не подходит для концевых алкинов и дает только пентафторбензол.
Безметалловое гидрирование концевых алкинов до соответствующих алкенов было недавно достигнуто с использованием системы на основе пиридонборана.[13] Эта система легко активирует водород при комнатной температуре с образованием комплекса пиридонборана.[14] Диссоциация этого комплекса делает возможным гидроборирование алкина свободным бораном. При протодеборилировании свободным пиридоном СНГ образуется алкен. С помощью этой системы возможно гидрирование концевых алкинов, поскольку активация C-H обратима и конкурирует с активацией водородом.
Борилирование
Аминоборановые ФЛП катализируют борилирование электронно-богатых ароматических гетероциклов (схема 1).[15] Реакция вызвана высвобождением водорода посредством активации C-H с помощью FLP. Ароматические борилирования часто используются в фармацевтических разработках, в частности из-за большого количества, низкой стоимости и низкой токсичности соединений бора по сравнению с благородными металлами.,

Субстрат для реакции имеет два основных требования, тесно связанных с механизмом борилирования. Во-первых, субстрат должен быть богатым электронами, примером чего может служить отсутствие реакции с тиофеном, тогда как его более богатые электронами производные - метокситиофен и 3,4-этилендиокситиофен - может вступать в реакцию с амино-бораном. Кроме того, замещение 1-метилпиррола (который может реагировать) с сильно электроноакцепторным третбутилоксикарбонил (Boc) группа в положении 2 полностью подавляет реакцию. Второе требование - отсутствие в субстрате основных аминогрупп, которые в противном случае образовали бы нежелательный аддукт. Это можно проиллюстрировать отсутствием реакции с пирролом, в то время как производные 1-метила и N-бензилпиррола способны реагировать.
Дальнейшая работа тех же авторов показала, что просто пиперидин в качестве группы амина R (в отличие от тетраметилпиперидина, изображенного выше) ускоряет скорость реакции. С помощью кинетических исследований и исследований методом DFT авторы предположили, что стадия активации C-H была более простой, чем при использовании более крупных заместителей.[16]
Диароматизация также может быть достигнута в аналогичных условиях, но с использованием N-тозилиндолов. Syn-гидоборилированные индолины.[17]
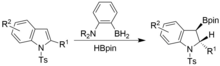
Также наблюдали борилирование S-H-связей в тиолах в процессе дегидрирования. Спирты и амины, такие как трет-бутанол и трет-бутиламин, образуют стабильные продукты, которые предотвращают катализ из-за сильной π-связи между неподеленной парой атома N / O и бором, в то время как это не относится к тиолам, что позволяет проводить успешный катализ. . Кроме того, было достигнуто успешное борилирование связей Se-H. Во всех случаях образование H2 газ является сильной движущей силой реакций.[18]
Улавливание углерода
Химия FLP концептуально актуальна для улавливание углерода.[19] Как межмолекулярный (схема 1), так и внутримолекулярный (схема 2) ФЛП, состоящий из фосфина и борана, использовали для селективного захвата и высвобождения диоксида углерода. Когда раствор ФЛП был покрыт атмосферой CO2 при комнатной температуре FLP-CO2 соединение немедленно осаждается в виде белого твердого вещества.[19][20]

Нагрев межмолекулярного ФЛП-СО2 соединение в бромбензоле при 80 ° C под вакуумом в течение 5 часов вызывало высвобождение примерно половины CO2 и регенерацию двух составляющих компонентов FLP. После еще нескольких часов сидения при комнатной температуре под вакуумом полное высвобождение CO2 и произошла регенерация FLP.[19]
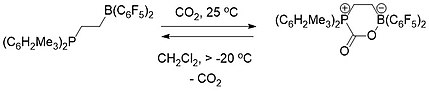
Внутримолекулярный FLP-CO2 соединение, напротив, было стабильным в виде твердого вещества при комнатной температуре, но полностью разлагалось при температуре выше -20 ° C в виде раствора в дихлорметане с выделением CO.2 и регенерируют молекулу FLP.[19]
Этот метод улавливания углерода FLP может быть адаптирован для работы в проточных химических системах.[21]
Рекомендации
- ^ Стефан, Дуглас (В) (2008). «Разочарованные пары Льюиса: концепция новой реактивности и катализа». Орг. Biomol. Chem. 6 (9): 1535–1539. Дои:10.1039 / b802575b. PMID 18421382.

- ^ Стефан, Дуглас В .; Эркер, Герхард (2010). «Разочарованные пары Льюиса: безметалловая активация водорода и многое другое». Angewandte Chemie International Edition. 49 (1): 46–76. Дои:10.1002 / anie.200903708. ISSN 1433-7851. PMID 20025001.

- ^ Стефан, Дуглас В .; Эркер, Герхард (2017). "Расстроенная парная химия Льюиса". Философские труды Королевского общества A: математические, физические и инженерные науки. 375 (2101): 20170239. Bibcode:2017RSPTA.37570239S. Дои:10.1098 / rsta.2017.0239. ISSN 1364-503X. ЧВК 5540845. PMID 28739971.

- ^ а б c Уэлч, Грегори С.; Хуан, Ронан Р. Сан; Масуда, Джейсон Д .; Стефан, Дуглас В. (2006). «Обратимая безметалловая водородная активация». Наука. 314 (5802): 1124–1126. Bibcode:2006Научный ... 314.1124W. Дои:10.1126 / science.1134230. ISSN 0036-8075. PMID 17110572.

- ^ Лам, Джоли; Szkop, Kevin M .; Мосафери, Элиар; Стефан, Дуглас В. (2018). «Катализ ФЛП: гидрогенизация основной группы органических ненасыщенных субстратов». Обзоры химического общества. 41 (13): 3592–3612. Дои:10.1039 / C8CS00277K. PMID 30178796.
- ^ Уэлч, Грегори С.; Хуан, Ронан Р. Сан; Масуда, Джейсон Д .; Стефан, Дуглас В. (17 ноября 2006 г.). «Обратимая безметалловая водородная активация». Наука. 314 (5802): 1124–1126. Bibcode:2006Научный ... 314.1124W. Дои:10.1126 / science.1134230. ISSN 0036-8075. PMID 17110572.
- ^ Беркефельд, Андреас; Пирс, Уоррен Э .; Парвез, Масуд (11 августа 2010 г.). "Тандемная фрустрированная пара Льюиса / трис (пентафторфенил) боран-катализируемое дезоксигенированное гидросилилирование диоксида углерода". Журнал Американского химического общества. 132 (31): 10660–10661. Дои:10.1021 / ja105320c. ISSN 0002-7863. PMID 20681691.
- ^ Стефан, Д.В. (2009). ""Разочарованные пары Льюиса ": Новая стратегия активации малых молекул и гидрогенизационного катализа". Дальтон Транс (17): 3129–3136. Дои:10.1039 / b819621d. PMID 19421613.

- ^ Tochertermam, W. (1966). «Строения и реакции органических комплексов». Энгью. Chem. Int. Эд. 5 (4): 351–171. Дои:10.1002 / anie.196603511.
- ^ а б Чен, Дяньцзюнь; Ван, Юйтянь; Кланкермайер, Юрген (03.12.2010). «Энантиоселективное гидрирование с хиральными фрустрированными парами Льюиса». Angewandte Chemie International Edition. 49 (49): 9475–9478. Дои:10.1002 / anie.201004525. ISSN 1521-3773. PMID 21031385.
- ^ Рен, Сяоюй; Ду, Хайфэн (2016-01-15). «Хиральные фрустрированные пары Льюиса, катализирующие высокоэнантиоселективные гидросилилирование 1,2-дикарбонильных соединений». Журнал Американского химического общества. 138 (3): 810–813. Дои:10.1021 / jacs.5b13104. ISSN 0002-7863. PMID 26750998.
- ^ Черниченко, Константин; Мадарас, Адам; Папай, Имре; Нигер, Мартин; Лескеля, Маркку; Репо, Тимо (2013). «Подход с использованием фрустрированной пары Льюиса к каталитическому восстановлению алкинов до цис-алкенов» (PDF). Химия природы. 5 (8): 718–723. Bibcode:2013НатЧ ... 5..718С. Дои:10.1038 / nchem.1693. PMID 23881505.

- ^ Вех, Феликс; Хазенбек, Макс; Геллрих, Урс (18 сентября 2020 г.). «Полугидрирование алкинов, катализируемое пиридон-борановым комплексом: нарушение реакционной способности пар Льюиса и сотрудничество бор-лиганд в согласовании». Химия - Европейский журнал: chem.202001276. Дои:10.1002 / chem.202001276. ISSN 0947-6539.
- ^ Геллрих, Урс (2018). «Обратимая активация водорода комплексом пиридонат борана: сочетание фрустрированной реакционной способности пары Льюиса с взаимодействием бор-лиганд». Angewandte Chemie International Edition. 57 (17): 4779–4782. Дои:10.1002 / anie.201713119. ISSN 1521-3773.
- ^ Légaré, Marc A .; Courtmanche, Marc A .; Рошетт, Этьен; Фонтен, Фредерик Г. (30.07.2015). «Безметалловая каталитическая активация связи C-H и борилирование гетероаренов». Наука. 349 (6247): 513–516. Bibcode:2015Научный ... 349..513L. Дои:10.1126 / science.aab3591. HDL:20.500.11794/30087. ISSN 0036-8075. PMID 26228143.

- ^ Легаре Лавернь, Жюльен; Джаяраман, Арумугам; Мисаль Кастро, Луис К.; Рошетт, Этьен; Фонтен, Фредерик-Жорж (2017-10-06). "Безметалловое борилирование гетероаренов с использованием амбифильных аминоборанов: о важности стериков в фрустрированной парной активации связи C – H Льюиса". Журнал Американского химического общества. 139 (41): 14714–14723. Дои:10.1021 / jacs.7b08143. HDL:20.500.11794/30144. ISSN 0002-7863. PMID 28901757.
- ^ Джаяраман, Арумугам; Мисаль Кастро, Луис К.; Дерозье, Винсент; Фонтен, Фредерик-Жорж (2018). «Безметалловая борилирующая деароматизация индолов: изучение дивергентной реакционной способности аминоборановых катализаторов C – H-борилирования». Химическая наука. 9 (22): 5057–5063. Дои:10.1039 / c8sc01093e. ISSN 2041-6520. ЧВК 5994747. PMID 29938036.
- ^ Рошетт, Этьен; Бутин, Хьюго; Фонтен, Фредерик-Жорж (30.06.2017). "Разочарованная пара Льюиса, катализируемая борилированием связи S – H". Металлоорганические соединения. 36 (15): 2870–2876. Дои:10.1021 / acs.organomet.7b00346. HDL:20.500.11794/30088. ISSN 0276-7333.
- ^ а б c d Mömming, Cornelia M .; Оттен, Эдвин; Кер, Джеральд; Фрёлих, Роланд; Гримме, Стефан; Стефан, Дуглас В .; Эркер, Герхард (24 августа 2009 г.). «Обратимое безметалловое связывание диоксида углерода разочарованными парами Льюиса» (PDF). Angewandte Chemie International Edition. 48 (36): 6643–6646. Дои:10.1002 / anie.200901636. ISSN 1433-7851. PMID 19569151.
- ^ Стефан, Дуглас В .; Эркер, Герхард (2015-05-14). "Разочарованная парная химия Льюиса: развитие и перспективы". Angewandte Chemie International Edition. 54 (22): 6400–6441. Дои:10.1002 / anie.201409800. ISSN 1433-7851. PMID 25974714.
- ^ Аболхасани, Милад; Гюнтер, Аксель; Кумачева, Евгения (24.06.2014). «Микрофлюидные исследования углекислого газа». Angewandte Chemie International Edition. 53 (31): 7992–8002. Дои:10.1002 / anie.201403719. ISSN 1433-7851. PMID 24961230.

![{displaystyle {ce {PCy3 + B (C6F5) 3 + H2 -> [HPCy3] + [HB (C6F5) 3] -}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3c7ea46199d1f74478288c7affc7bdd1fc964071)
