Итаконовый ангидрид - Itaconic anhydride
 | |
| Имена | |
|---|---|
| Название ИЮПАК 3-метилиденоксолан-2,5-дион | |
| Другие имена Метилен янтарный ангидрид | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ЧЭМБЛ | |
| ChemSpider | |
| ECHA InfoCard | 100.016.835 |
| Номер ЕС |
|
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| C5ЧАС4О3 | |
| Молярная масса | 112,09 г ·[моль−1 |
| Внешность | бесцветное кристаллическое твердое вещество[1] |
| Температура плавления | 70–72 ° С (158–162 ° F, 343–345 К)[3] |
| растворим в ацетон и хлороформ, мало растворим в Диэтиловый эфир,[2] реагирует с водой | |
| Опасности | |
| Пиктограммы GHS |  |
| Сигнальное слово GHS | Предупреждение |
| H302, H315, H319, H335 | |
| P261, P264, P270, P271, P280, P301 + 312, P302 + 352, P304 + 340, P305 + 351 + 338, P312, P321, P330, P332 + 313, P337 + 313, P362, P403 + 233, P405, P501 | |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Итаконовый ангидрид циклический ангидрид из итаконовая кислота (ненасыщенный, дикарбоновая кислота ) и получается пиролиз из лимонная кислота. Ангидрид итаконовой кислоты (как производное так называемого химического вещества на основе биоразлагаемых платформ).[4] итаконовая кислота[5]) размножается как универсальный мономер и структурный элемент из-за его легкой доступности из недорогого возобновляемого сырья; однако эти ожидания еще не оправдались.[6]
Производство
Еще в 1836 году при перегонке лимонной кислоты одним из полученных продуктов был так называемый "пироцитрический кислота »(« Brenzcitronensäure »), а точнее итаконовый ангидрид.[7]
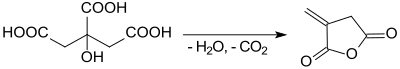
Согласно протоколу органического синтеза,[8] итаконовый ангидрид получают при быстром нагревании моногидрата лимонной кислоты с умеренным выходом (37-47%). Побочный продукт термодинамически более стабилен. цитраконовый ангидрид.[9]
Также при нагревании безводной лимонной кислоты до 260 ° C в вакууме смесь итаконового и цитраконового ангидрида достигается «с хорошим выходом».[10]
Намного более продуктивными являются процессы, основанные на легко доступных биотехнологиях. итаконовая кислота,[11] который производит исключительно итаконовый ангидрид с выходом до 98% при температурах 165–180 ° C и давлении 10–30 мм рт. ст. в присутствии каталитических количеств сильных кислот, таких как концентрированная серная кислота.[12]

Во избежание перегрева и, как следствие, увеличения содержания цитраконового ангидрида, реакция дегидратации может также проводиться в высококипящих ароматических растворителях, таких как толуол или же ксилол в присутствии кислого монтмориллонит[13] или в кумол в присутствии метансульфоновая кислота.[14] В обоих вариантах достигается выход итаконового ангидрида 95-97%.
Более свежий процесс циклизации дикарбоновые кислоты с диэтилкарбонат в присутствии хром-саленового комплекса с µ-нитридо-бис (трифенилфосфан) хлорид в качестве сокатализатора количественно обеспечивает итаконовый ангидрид, загрязненный цитраконовым ангидридом (18%) уже при 40 ° C в 1 миллимолярных препаратах. Однако реакция технически неинтересна из-за дорогих катализаторов.[15]
Характеристики
Ангидрид итаконовой кислоты представляет собой бесцветное кристаллическое твердое вещество, которое растворяется во многих полярных органических растворителях и гидролизуется с водой с образованием итаконовой кислоты.[8] Вещество рекомендуется хранить в сухой инертной атмосфере. При температурах выше точки плавления итаконовый ангидрид превращается в цитраконовый ангидрид.[12] Даже при значительно более низких температурах, таких как кипящий хлороформ, это изомеризация может иметь место при наличии третичные амины.[16]
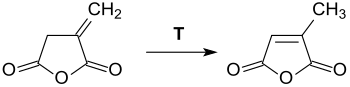
Изменение значений указанных температур плавления связано с неизбежным на практике загрязнением продукта цитраконовый ангидрид.
Использовать
Путем реакции итаконового ангидрида с пентахлорид фосфора (PCl5) дихлорид итаконовой кислоты (итаконилхлорид) получают:[17]

откуда полиамиды с реактивным винилиденовые группы может быть сформирован с диамины.[18]
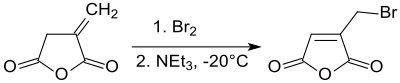
Бромирование итаконового ангидрида при -20 ° C и последующее дегидробромирование дает 2-бромметилмалеиновый ангидрид с выходом 70% за счет сдвига двойной связи в пятичленное кольцо.[19]
Отто Дильс и Курт Алдер уже описал дополнение (Реакция Дильса-Альдера ) из диенофил итаконовый ангидрид диен циклопентадиен в 1928 г.[20] Также фурфуриловый спирт, который доступен из возобновляемых сырьевых материалов, реагирует как диен с образованием аддукта Дильса-Альдера, в котором реакция спиртовой группы со структурой циклического ангидрида образует лактон и группу карбоновой кислоты, то есть циклический полуэфир итаконовой кислоты. кислота.[21]

Ангидрид итаконовой кислоты может реагировать с ароматическими соединениями, такими как бензол через Ацилирование Фриделя-Крафтса. Это всегда происходит таким образом, что раскрытие кольца происходит в карбонильной группе, которая находится дальше от метиленовая группа (3 позиции).[22]
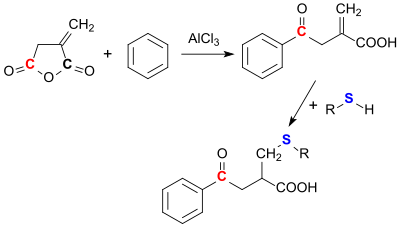
Нуклеофилов Такие как тиолы легко может быть добавлен к метиленовой группе. С другими нуклеофилами, такими как спирты, аммиак,[23] аминов и гидроксиламина, итаконовый ангидрид региоселективно реагирует в положении 3 с соответствующими сложными эфирами, амидами и гидроксамовые кислоты.

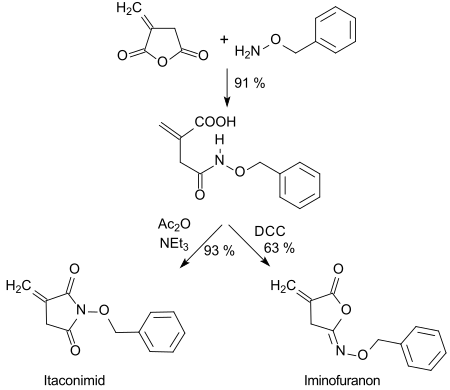
В гидроксамовая кислота сформированный с О-бензилгидроксиламин можно циклизовать с высоким выходом дициклогексилкарбодиимид (DCC) до пятичленных изоимидов (иминофуранонов) или с ацетангидридом (Ac2O) к имиды.[24]
Предлагаемая замена малеинового ангидрида итаконовым ангидридом в алкенилянтарные ангидриды (часто используется для проклейки бумаги) технически еще не реализован.
Также ряд пяти-, шести- и семичленных гетероциклы (такие как бензотиазепины) могут быть получены из итаконового ангидрида с полезными выходами.[25]

Полимеры итаконового ангидрида
Как ненасыщенный циклический ангидрид, итаконовый ангидрид может быть полимеризован посредством радикальная полимеризация[26] и через поликонденсация с диолами или диаминами. Две реакции также можно проводить последовательно - сначала радикальная полимеризация, затем поликонденсация или наоборот.[27][28]
Полученные радикально полимеры и сополимеры итаконового ангидрида могут быть подвергнуты щелочному гидролизу до полиитаконовых кислот при раскрытии цикла или преобразованы в амиды или сложные эфиры полимерных кислот после полимеризации.[29]

Полученные сополимеры обладают свойствами, которые предполагают потенциальное использование в качестве биоматериалов для терапевтических систем и протезы.[30]
Элегантный способ получения функциональных полимеров исключительно из биогенных мономеров - это полимеризация метатезиса с раскрытием кольца (ROMP) оксанорборненового эфира, полученного из итаконового ангидрида и фурфуриловый спирт лактонизации Дильса-Альдера с использованием Катализатор Граббса II.[31]

Рекомендации
- ^ Сигма-Олдрич Ко., продукт не. {{{я бы}}}.
- ^ Вход из Итаконовый ангидрид из TCI Europe, получено {{{Date}}}
- ^ J.L. Belletire, R.J. Раух (2001), «Итаконовый ангидрид», Энциклопедия реагентов для органического синтеза e-EROS, Дои:10.1002 / 047084289X.ri086
- ^ Б. Камм (2007 г.), "Produktion von Plattformchemikalien und Synthesegas aus Biomasse", Энгью. Chem. (на немецком), 119 (27), стр. 5146–5149, Дои:10.1002 / ange.200604514j
- ^ Биргит Камм (14 апреля 2008 г.). "Das Konzept der Bioraffinerie - Schlüssel für Ressourceneffizienz". GDCh Aktuelle Wochenschau. Получено 2018-10-01.
- ^ Джим Лейн (30 апреля 2015 г.). «12 лучших молекул на биологической основе Министерства энергетики - что с ними стало?». Биотопливо. Получено 2018-10-01.
- ^ С. Бауп (1836), "Ueber eine neue Pyrogen-Citronensäure, und ueber Benennung der Pyrogen-Säuren überhaupt", Justus Liebigs Ann. Chem. (на немецком), 19 (1), стр. 29–38, Дои:10.1002 / jlac.18360190107
- ^ а б «Итаконовый ангидрид и итаконовая кислота». Органический синтез. Дои:10.15227 / orgsyn.011.0070.
- ^ «Цитраконовый ангидрид и цитраконовая кислота». Органический синтез. Дои:10.15227 / orgsyn.011.0028.
- ^ США 2258947, Дж. Crowell, "Производство итаконовых и цитраконовых ангидридов", выпущенный 1941-10-14, передан National Aniline & Chemical Co.
- ^ Novamont SpA (26.07.2018). «Резюме окончательного отчета - BIO-QED (Quod Erat Demonstrandum: крупномасштабная демонстрация сыпучих химикатов на биологической основе BDO и IA с целью снижения затрат и повышения устойчивости)». КОРДИС. Получено 2018-10-01.
- ^ а б ГБ 854999, "Способ производства итаконового ангидрида", выпущенный 1960-11-23, присвоенный Chas. Pfizer & Co., Inc.
- ^ США 5260456, М. Увы, М. Губельманн, Ж.-М. Popa, "Процесс производства итаконового ангидрида", выпущенный 1993-11-9, передан Rhone-Poulenc Chimie
- ^ WO 9506026, A.G. Talma, A.G. Bovenkamp-Bouwman, H.P. Verlaanhooft, «Дегидратация итаконовой кислоты», выпущенный 1995-3-2, передан компании Akzo Nobel N.V.
- ^ К. Роберт, Ф. де Монтиньи, К.М. Томас (2011 г.), «Тандемный синтез чередующихся полиэфиров из возобновляемых источников», Nature Communications, 2, стр. 1–6, Дои:10.1038 / ncomms1596CS1 maint: несколько имен: список авторов (связь)
- ^ M.C. Галанти, А. Галанти (1982), «Кинетическое исследование изомеризации итаконового ангидрида в цитраконовый ангидрид», J. Org. Chem., 47 (8), стр. 1572–1574, Дои:10.1021 / jo00347a041
- ^ В. Петри (1881 г.), "Beiträge zur Kenntnis der Itaconsäure, Mesaconsäure und Citraconsäure", Бер. Dtsch. Chem. Ges. (на немецком), 14 (2), стр. 1634–1637, Дои:10.1002 / cber.18810140213
- ^ C. Wang, X. Wang, Z. Wie, X. Zeng (2018), «Синтез и характеристика поли (п-фениленитаконамида)», Polym. Mater. Sci. Англ., 34 (6), стр. 9–15, Дои:10.16865 / j.cnki.1000-7555.2018.06.002CS1 maint: несколько имен: список авторов (связь)
- ^ Дж. Ноками, Т. Тамаока, Х. Огава, С. Вакабаяси (1986), «Легкий синтез 2-метилен-4-бутиролактонов», Chem. Lett., 15 (4), стр. 541–544, Дои:10.1246 / класс.1986.541CS1 maint: несколько имен: список авторов (связь)
- ^ О. Дильс, К. Альдер (1928), "Synthesen in der hydroaromatischen Reihe", Justus Liebigs Ann. Chem. (на немецком), 460 (1), стр. 98–122, Дои:10.1002 / jlac.19284600106
- ^ А.Д. Пехере, С. Сюй, С.К. Томпсон, М.А.Хиллмайер, Т. Hoye (2016), «Реакции Дильса-Альдера фуранов с итаконовым ангидридом: преодоление неблагоприятной термодинамики», Орг. Lett., 18 (11), стр. 2584–2587, Дои:10.1021 / acs.orglett.6b00929CS1 maint: несколько имен: список авторов (связь)
- ^ К. Камео, К. Огава, К. Такешита, С. Накайке, К. Томисава, К. Сато (1988), "Исследования противоревматических средств: производные 3-бензоилпропионовой кислоты", Chem. Pharm. Бык., 36 (6), стр. 2050–2060, Дои:10.1248 / cpb.36.2050CS1 maint: несколько имен: список авторов (связь)
- ^ Х. Такеда, Т. Тачинами, С. Хосокава, М. Абуратани, К. Иногути, К. Ачива (1991), «Эффективное получение оптически активного (S) - (-) - 3-метил-γ-бутиролактона каталитическим методом. Асимметричное гидрирование с использованием хиральных N-замещенных пирролидинбисфосфин-родиевых комплексов », Chem. Pharm. Бык., 39 (10), с. 2706–2708, Дои:10.1248 / cpb.39.2706CS1 maint: несколько имен: список авторов (связь)
- ^ М. Акияма, К. Симидзу, С. Айба, Ф. Банба (1980), «Синтез N-гидроксималеимида и N-гидрокситаконимида и их родственных производных», J. Chem. Soc. Перкин I, 0, стр. 2122–2125, Дои:10.1039 / P19800002122CS1 maint: несколько имен: список авторов (связь)
- ^ ЯВЛЯЮСЬ. Медуэй, Дж. Сперри (2014), «Конструирование гетероцикла с использованием строительного блока из биомассы итаконовой кислоты», Green Chem., 16, стр. 2084–2101, Дои:10.1039 / c4gc00014e
- ^ Д. Ставски, С. Половинский (2005), «Полимеризация итаконовой кислоты», Полимеры, 50 (2), стр. 118–122
- ^ Ф. Х. Исикгор, К. Р. Бесер (2015), «Лигноцеллюлозная биомасса: устойчивая платформа для производства химикатов и полимеров на биологической основе», Polym. Chem., 6, стр. 4497–4559, Дои:10.1039 / c5py00263j
- ^ Т. Окуда, К. Ишимото, Х. Охара, С. Кобаяши (2012), «Возобновляемые полимерные материалы на биологической основе: простой синтез сополимеров на основе итаконового ангидрида с привитыми поли (L-молочной кислотой)», Макромолекулы, 45 (10), стр. 4166–4174, Дои:10.1021 / ma300387jCS1 maint: несколько имен: список авторов (связь)
- ^ Т. Оцу, Ж.-З. Ян (1991), "Радикальная полимеризация итаконового ангидрида и реакции образующихся полимеров с аминами и спиртами", Polymer Int., 25 (4), стр. 245–251, Дои:10.1002 / pi.4990250408
- ^ С. Шанг, С.Дж. Хуанг, Р.А. Weiss (2011), «Гребнеобразные иономеры из устойчивых ресурсов: сополимеры итаконового ангидрида и со-стеарилметакрилата», Полимер, 52 (13), стр. 2764–2771, Дои:10.1016 / j.polymer.2011.04.025CS1 maint: несколько имен: список авторов (связь)
- ^ Я. Бай, Дж. Х. Кларк, T.J. Фермер, I.D.V. Инграм, М. Норт (2017), «Полностью получаемые из биомассы устойчивые полимеры путем метатезисной полимеризации с раскрытием цикла мономеров, полученных из фурфурилового спирта и итаконового ангидрида», Polymer Chem., 8 (20), стр. 3074–3081, Дои:10.1039 / C7PY00486ACS1 maint: несколько имен: список авторов (связь)
