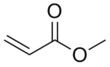
Метилакрилат - Methyl acrylate - Wikipedia
| |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК Метил проп-2-еноат[1] | |||
| Другие имена | |||
| Идентификаторы | |||
3D модель (JSmol ) | |||
| ЧЭМБЛ | |||
| ChemSpider | |||
| ECHA InfoCard | 100.002.274 | ||
| КЕГГ | |||
PubChem CID | |||
| UNII | |||
| |||
| |||
| Характеристики | |||
| C4ЧАС6О2 | |||
| Молярная масса | 86.090 г · моль−1 | ||
| Внешность | Бесцветная жидкость | ||
| Запах | Едкий[2] | ||
| Плотность | 0,95 г / см3[3] | ||
| Температура плавления | -74 ° С (-101 ° F, 199 К)[3] | ||
| Точка кипения | 80 ° С (176 ° F, 353 К)[3] | ||
| 5 г / 100 мл | |||
| Давление газа | 65 мм рт. Ст. (20 ° C)[2] | ||
| Опасности | |||
| Главный опасности | Вреден (Xn); Легковоспламеняющийся (F +) | ||
| Паспорт безопасности | Оксфордский паспорт безопасности материалов | ||
| точка возгорания | -3 ° С (27 ° F, 270 К)[3] | ||
| Пределы взрываемости | 2.8–25%[2] | ||
| Смертельная доза или концентрация (LD, LC): | |||
LC50 (средняя концентрация ) | 3575 частей на миллион (мышь) 1350 частей на миллион (крыса, 4 часа) 1000 частей на миллион (крыса, 4 часа) 2522 частей на миллион (кролик, 1 час)[4] | ||
| NIOSH (Пределы воздействия на здоровье в США): | |||
PEL (Допустимо) | TWA 10 частей на миллион (35 мг / м3) [кожа][2] | ||
REL (Рекомендуемые) | TWA 10 частей на миллион (35 мг / м3) [кожа][2] | ||
IDLH (Непосредственная опасность) | 250 частей на миллион[2] | ||
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Метилакрилат является органическое соединение, точнее метиловый эфир из акриловая кислота. Это бесцветная жидкость с характерным едким запахом. В основном он производится для акрилат волокно, из которого ткут синтетические ковры.[5] Это также реагент в синтезе различных фармацевтических полупродуктов.
Производство
Стандартная промышленная реакция получения метилакрилата: этерификация с метанол при кислотном катализе (серная кислота, п-толуолсульфоновая кислота или кислотные ионообменники.[6]). Переэтерификация облегчается, поскольку метанол и метилакрилат образуют низкокипящий азеотроп (точка кипения 62–63 ° С).[7]
Патентная литература[8] описывает однореакторный способ, включающий парофазное окисление пропена или 2-пропеналя кислородом в присутствии метанола.
Другие методы
Метилакрилат может быть получен дебромирование метил 2,3-дибромпропаноата с цинк.[9] Метилакрилат образуется в хорошем урожай на пиролиз из метиллактат в присутствии этенон (кетене).[10] Метиллактат является возобновляемым "зеленый химикат ". Другой патент[11] описывает обезвоживание метиллактата над цеолиты.
Катализируемый тетракарбонилом никеля гидрокарбоксилирование ацетилена с монооксидом углерода в присутствии метанола также дает метилакрилат.[12] Реакция метилформиата с ацетиленом в присутствии катализаторов переходных металлов также приводит к метилакрилату.[13] И алкоголиз пропиолактона метанолом, и метанолиз акрилонитрила через промежуточно образованный сульфат акриламида.[14] также проверенные, но устаревшие процессы.
Использовать
Метилакрилат после бутилакрилат и этилакрилат третий по важности сложный эфир акриловой кислоты с мировым годовым объемом производства около 200 000 тонн в год.[15]
Метилакрилат реагирует, катализируемая Базы Льюиса в Майкл дополнение с амины с высокими выходами для производных -аланина, которые обеспечивают амфотерные поверхностно-активные вещества, когда используются длинноцепочечные амины и впоследствии гидролизуется сложноэфирная функция.

Метилакрилат используется для приготовления 2-диметиламиноэтилакрилат путем переэтерификации с диметиламиноэтанол в значительных количествах более 50 000 тонн / год.[16]
Метилакрилат используется в качестве сомономера при полимеризации с различными акриловыми и виниловые мономеры. При этом он имеет такой же диапазон применения, как и этилакрилат.[17] При использовании метилакрилата в качестве сомономера акриловые краски тверже и тверже. хрупкий чем с гомологичными акрилатами. Сополимеризация метилакрилата с акрилонитрилом улучшает их способность к переработке в расплаве с получением волокон, которые могут использоваться в качестве предшественников углеродных волокон.[18]
Акрилаты также используются при приготовлении поли (амидоамин) (ПАМАМ) дендримеры обычно Майклом добавляется к основному амин.
Метилакрилат является предшественником волокон, из которых ткут ковры.
Из-за тенденции к полимеризации образцы обычно содержат ингибитор, такой как гидрохинон.
Реакции
Метилакрилат является классическим акцептором Михаэля, что означает, что он добавляет нуклеофилы на своем конце. Например, в присутствии основного катализатора он добавляет сероводород, чтобы получить тиоэфир:[19]
- 2 канала2CHCO2CH3 + H2S → S (CH2CH2CO2CH3)2
Это тоже хорошо диенофил.
Безопасность
Это острый токсин с LD50 (крысы, перорально) 300 мг / кг и TLV 10 частей на миллион.
Рекомендации
- ^ а б «Метилакрилат - Резюме соединения». PubChem. Получено 30 июня, 2012.
- ^ а б c d е ж Карманный справочник NIOSH по химической опасности. "#0394". Национальный институт охраны труда и здоровья (NIOSH).
- ^ а б c d Записывать в базе данных веществ GESTIS Институт охраны труда и здоровья
- ^ «Метилакрилат». Немедленно опасные для жизни и здоровья концентрации (IDLH). Национальный институт охраны труда и здоровья (NIOSH).
- ^ Такаши Охара, Такахиса Сато, Нобору Симидзу, Гюнтер Прешер, Гельмут Швинд, Отто Вайберг, Клаус Мартен, Гельмут Грейм (2003). «Акриловая кислота и производные». Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a01_161.pub2. ISBN 3527306730.CS1 maint: использует параметр авторов (связь)
- ^ «Этерификация: сложные эфиры акрилата (MA, EA, BA, MMA, 2-EHA)». amberlyst.com. Получено 2013-02-21.
- ^ Чесси Э. Реберг (1955). «н-бутилакрилат». Органический синтез. 26: 18.; Коллективный объем, 3, п. 146
- ^ США 3925463, Натале Ферлаццо и Буззи Джан Фаусто, Гирга Марчелло, «Процесс производства метилакрилата», опубликовано 9 декабря 1975 года, передано Societá Italiana Resine S.I.R., S.p.A.
- ^ Ф. Байльштейн: Handbuch der Organischen Chemie, 3. Auflage, 1. Band. Verlag Leopold Voss, 1893, с. 501. Volltext.
- ^ США 2417748, Хью Дж. Хагемейер, «Получение метилакрилата», опубликовано 18 марта 1947 г., передан компании Eastman Kodak Company.
- ^ США 5250729, Takafumi Abe, Shinichi Hieda, «Процесс получения ненасыщенной карбоновой кислоты или ее сложного эфира», переданный Митсубиси Газохимическая Компания
- ^ W. Reppe, J. Liebigs Ann. Chem., 582 (1), 116-132 (1953)
- ^ США 6022990, Zhao-Tie Liu, Jia-Qi Zhang, Xian-Gui Yang, «Метод синтеза метилакрилата», опубликовано 8 февраля 2000 г., поручено Институту органической химии Чэнду.
- ^ Х.-Ж. Арпе, Industrielle Organische Chemie, 6. Aufl., Wiley-VCH Verlag, Weinheim, 2007, ISBN 978-3-527-31540-6.
- ^ Отчет CEH о маркетинговых исследованиях Акриловая кислота и сложные эфиры, SRI Consulting, июль 2007 г.
- ^ 2010136696, Жан-Мишель Поль, Борис Тоннелье, Фрэнсис Огюстен, «Состав, включающий оксид диалкилолова и его использование в качестве катализатора переэтерификации для синтеза (мет) акриловых эфиров», опубликовано 02 декабря 2010 г., передано Аркема Франция
- ^ DOW Метилакрилат, Оценка безопасности продукта
- ^ В. А. Бхану; и другие. (2002), «Синтез и характеристика статистических сополимеров акрилонитрилметилакрилата как предшественников углеродного волокна, перерабатываемых в расплаве» (PDF), Полимер (на немецком), 43 (18), стр. 4841–4850, Дои:10.1016 / S0032-3861 (02) 00330-0
- ^ Эдвард А. Фенель и Марвин Кармак (1950). «Метил-β-дипропионат». Органический синтез. 30: 65.; Коллективный объем, 4, п. 669