Нервная пластинка - Neural plate
| Нервная пластинка | |
|---|---|
 Neural Crest | |
| Подробности | |
| Этап Карнеги | 9 |
| Дней | 19 |
| Предшественник | эктодерма |
| Дает начало | нервные складки |
| Система | Нервная система |
| Идентификаторы | |
| латинский | lamina neuralis |
| MeSH | D054258 |
| TE | E5.13.1.0.1.0.1 |
| Анатомическая терминология | |
В нервная пластинка это ключевая структура развития, которая служит основой нервной системы. Напротив примитивная полоса у эмбриона эктодермальная ткань утолщается и уплощается, становясь нервной пластинкой. Область перед примитивный узел обычно называют нервной пластинкой. Клетки приобретают столбчатый вид в процессе, поскольку они продолжают удлиняться и сужаться. Концы нервной пластинки, известные как нервные складки, сдвиньте концы пластины вверх и вместе, загибая в нервная трубка, структура критически важна для развития головного и спинного мозга. Этот процесс в целом называется первичная нейруляция.[1]
Сигнальные белки также важны для развития нервной пластинки и помогают дифференцировать ткань, которая должна стать нервной пластинкой. Примеры таких белков включают костные морфогенетические белки и кадгерины. Экспрессия этих белков важна для складывания нервной пластинки и последующего нервная трубка формирование.
Участие в первичной нейруляции
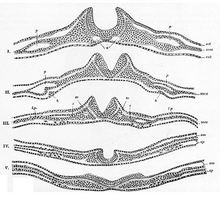
Обычно делится на четыре, процесс первичной нейруляции вовлекает нервную пластинку на первых трех этапах. Формирование и складывание нервной пластинки - это первый шаг в первичной нейруляции. Затем следует уточнение и рост клеток нервной пластинки. Третий этап первичной нейруляции включает не нервную пластинку как таковую, а скорее края нервной пластинки, которые сходятся вместе, превращая пластинку в начало нервная трубка. Когда нервная пластинка свернулась в трубку, нервные складки собраться вместе, чтобы завершить слияние нервной трубки. Этот процесс показан на рисунке справа, где нервная пластинка показана фиолетовым цветом. Лаймово-зеленый цвет отмечает края нервной пластинки, которые становятся нервными складками, участвующими в складывании пластинки, чтобы создать нервную трубку. На рисунке показано развитие нервной пластинки в нервную трубку, где находится нервный гребень клетки также происходят из.[1]
При первичной нейруляции слой эктодерма делится на три набора клеток: нервная трубка (будущий головной и спинной мозг), эпидермис (кожа) и клетки нервного гребня (соединяют эпидермис и нервную трубку и будут мигрировать, чтобы нейроны, глия, пигментация клеток кожи).[1]
Разработка
На стадии формирования нервной пластинки зародыш состоит из трех слоев клеток: эктодерма который в конечном итоге формирует кожу и нервные ткани, мезодерма который формирует мышцы и кости, а энтодерма которые сформируют клетки, выстилающие пищеварительный и дыхательный тракты. Клетки-предшественники, которые составляют предшественники нервных тканей в нервной пластинке, называются нейроэпителиальные клетки.
Растянутый над нотохорда, эктодермальные клетки на дорсальной части эмбриона в конечном итоге являются теми, которые формируют нервную пластинку. Приблизительно половина этих клеток останется эктодермой, а другая половина будет формировать нервную пластинку.[2][3]
Существует четыре стадии формирования нервной пластинки и нервной трубки: формирование, изгиб, конвергенция и закрытие. Формирование нервной пластинки начинается, когда дорсальная мезодерма дает сигнал эктодермальным клеткам над ней, чтобы они удлинялись в столбчатые клетки нервной пластинки.[4] Эта другая форма отличает клетки презумптивной нервной пластинки от других преэпидермальных клеток. Если нервная пластинка отделяется сама по себе, она все равно будет развиваться, чтобы стать более тонкой, но не нервной трубкой. Если область, содержащая презумптивный эпидермис и ткань нервной пластинки, изолирована, небольшие нервные складки сформируется. Удлинение, которое происходит во время формирования нервной пластинки и закрытия нервная трубка жизненно важно; закрытие областей нервная трубка видно, что они имеют очень повышенную активность удлинения в средней линии по сравнению с уже закрытыми областями, когда пластина начинала формировать себя в трубку.[5]

При изгибе нервной пластинки образуются шарниры, в которых нервная пластинка соединяется с окружающими тканями. Средняя линия нервной пластинки относится к средней точке шарнира (MHP). Клетки в этой области, известные как клетки средней точки шарнира из-за их участия в этой структуре, стабилизируются и соединяются с хордой. Они происходят из области нервной пластинки перед примитивным узлом. Хорда начнет изменение формы в клетках MHP. Эти клетки уменьшатся в высоте и станут клиновидными. Другой тип шарнирной точки происходит в дорсально-латеральном направлении и называется дорсально-боковой шарнирной точкой (DLHP). Эти области бороздчатые и изменяют форму так же, как клетки MHP перед соединением вместе, чтобы сформировать нервную трубку. В эксперименте было замечено, что без хорды характеристики MHP не развивались правильно, поэтому формирование нервной пластинки и нервной трубки не происходило должным образом.[6] Связь между нервной пластинкой и нотохорда важен для будущей индукции и формирования нервной трубки.
Закрытие нервной трубки завершается, когда нервные складки сводятся вместе, прилегая друг к другу. В то время как клетки, которые остаются в виде нервной трубки, образуют головной и спинной мозг, другие клетки, которые были частью нервной пластинки, мигрируют из трубки в виде клеток нервного гребня. После эпителиально-мезенхимальный переход эти клетки образуют автономная нервная система и некоторые ячейки периферическая нервная система.[7]
Передача сигналов клетки и основные белки
Решающим фактором для правильного складывания и функции нервной пластинки является N-кадгерин, тип кадгерин белок, связанный с нервной системой. N-кадгерин важен для удержания вместе клеток нервной пластинки. Кроме того, клетки, которым суждено стать клетками нервной пластинки, экспрессируют молекулу адгезии нервных клеток (NCAM) для дальнейшего сцепления нервной пластинки. Другой кадгерин, Е-кадгерин, экспрессируется эктодермальными клетками в процессе развития нервной пластинки.[1]

Костный морфогенетический белок 4, или BMP4, является трансформирующим фактором роста, который заставляет клетки эктодермы дифференцироваться в клетки кожи. Без BMP4 клетки эктодермы развились бы в нервные клетки. Осевой клетки мезодермы под эктодермой секретируют тормозные сигналы, называемые хордин, голова и фоллистатин. Эти ингибирующие сигналы предотвращают действие BMP4, который в норме делает клетки эктодермой; в результате вышележащие клетки принимают нормальное русло и развиваются в нервные клетки. Клетки эктодермы, которые ограничивают эти нервные клетки, не получают сигналов ингибиторов BMP4, и в результате BMP4 индуцирует развитие этих клеток в клетки кожи.[8]
Спецификаторы границ нервной пластинки индуцируются как набор факторов транскрипции. Дисталлесс-5, PAX3 и PAX7 предотвратить превращение пограничной области в нервную пластинку или эпидермис.[1] Они вызывают второй набор факторов транскрипции, называемых спецификаторами нервного гребня, которые заставляют клетки становиться клетки нервного гребня.
Во вновь сформированной нервной пластинке мРНК PAX3, MSX1 мРНК и белки MSX1 / MSX2 экспрессируются медиолатерально.[9] Когда нервная пластинка начинает складываться, ростральные области нервной пластинки не экспрессируют белки Pax3 и MSX. Области каудальнее нервная трубка закрытие имеют экспрессию PAX3 и MSX, ограниченную латеральными областями нервных складок.[9] Эти колебания в экспрессии мРНК и белка указывают на то, как они играют роль в дифференцировке клеток нервной пластинки.
Низкие уровни pSMAD 1, 5, 8 обеспечивают большую подвижность в средней точке шарнира, чем в латеральных клетках нервной пластинки.[10] Эта гибкость позволяет поворачиваться и поворачиваться, что позволяет изгибать и поднимать нервную пластину при форматировании нервная трубка. Нервная пластинка должна быть достаточно жесткой, чтобы происходили морфогенные движения, и при этом должна быть достаточно гибкой, чтобы претерпевать изменения формы и положения для преобразования в нервная трубка.
Другие животные
Нервная трубка закрывается по-разному у разных видов, причем различия между людьми и цыплятами являются одними из наиболее изученных. У людей нервная трубка сливается из центральной области эмбриона и движется наружу. У цыплят нервная трубка закрытие начинается в будущей области среднего мозга и закрывается в обоих направлениях.[1] У птиц и млекопитающих закрытие не происходит одновременно.
У эмбрионов тритона и амфибий в целом клеточное деление не играет решающей роли в морфогенезе. Клетки эмбриона тритона намного крупнее и демонстрируют пигментацию яиц, чтобы отличать клетки друг от друга. Нервная пластинка тритона удваивается в длину, уменьшается в апикальной ширине и увеличивается в толщине.[5] Края пластинки поднимаются дорсально и загибаются к средней линии, образуя нервную трубку. Площадь апикальной поверхности уменьшается.
У куриных эмбрионов, в то время как длина нервной пластинки увеличивается, а ширина на вершине уменьшается, толщина пластинки существенно не изменяется. По мере продвижения нервной пластинки через Этапы Гамбург-Гамильтон пластинка утолщается примерно до HH6-7, когда нервная пластинка начинает складываться в форму трубки. Площадь апикальной поверхности увеличивается во время нейруляции, в отличие от эмбрионов амфибий.[5] У эмбрионов мыши есть большая выпуклая кривая с каждой стороны от середины пластины. Эта кривая должна быть изменена, поскольку пластина скатывается вместе, образуя нервную трубку.[5]
Исследование
Исследования нервной пластинки начались всерьез с изучения определения эктодермы и ее приверженности нейрональному пути. С развитием исследований и лабораторных методов были достигнуты большие успехи в изучении нейруляции, а также развития и роли нервной пластинки в растущем эмбрионе. Использование таких методов зависит от стадии разработки и общих целей исследования, но включает такие методы, как мечение клеток и прививка.[11]
Маркировка клеток
Процесс гибридизация in situ (ISH) следует за разметкой ДНК или же РНК последовательность, служащая антисмысловой мРНК зонд, комплементарный последовательности мРНК внутри эмбриона. Маркировка флуоресцентным красителем или радиоактивной меткой позволяет визуализировать зонд и его местоположение внутри эмбриона. Этот метод полезен, поскольку он выявляет определенные области экспрессии генов в ткани, а также во всем эмбрионе посредством гибридизации in situ целиком.[12] Этот метод часто используется для определения экспрессии генов, необходимых для правильного развития эмбриона. Маркировка определенных генов в развивающемся эмбрионе позволяет определить точное время и место, в котором ген активируется, предлагая информацию о роли конкретного гена в развитии.
Подобно процессу гибридизации in situ, иммунофлуоресценция (IF) также позволяет определять роли конкретных клеточных элементов в развитии. Однако, в отличие от гибридизации in situ, иммунофлуоресценция использует флуорофор, присоединенный к антителу с биомолекулярной мишенью, такой как белки, а не последовательности ДНК и РНК. Позволяет визуализировать биомолекулярные элементы клетки. При изучении эмбриогенеза иммунофлуоресценция может использоваться для целей, аналогичных гибридизации, для отслеживания белков, которые участвуют в развитии эмбриона, а также их конкретного времени и места производства и использования.[13] Текущие исследования расширили метод иммунофлуоресценции, чтобы объединить его с методами гибридизации in situ, флуоресцентными или радиоактивными. Считается, что эта комбинация увеличивает специфичность и устраняет ограничения каждой отдельной техники. Например, это метод с усилением контрастного окрашивания в ткани и множественной маркировкой белков.[12]
Трансплантация клеток
Пересадка клеток на ранних стадиях развития эмбриона предоставила важную информацию о клеточные судьбы и процессы определения. Трансплантация на определенных стадиях нейруляции продвинула исследования передачи сигналов, необходимых для правильного развития нервной пластинки и других структур. Пересадка эктодермы и нервных структур является очень специализированной и деликатной процедурой, требующей удаления и маркировки желаемой группы клеток с последующей их трансплантацией, например, в новую область эмбриона.[14]
Эксперименты по прививке, проведенные в Xenopus и куриные эмбрионы демонстрируют способность нервной пластинки индуцировать другие области клеток, включая предплакодальную область, группу эктодермальных клеток, важных для функции органов чувств.[15]
Смотрите также
Рекомендации
Эта статья включает текст в всеобщее достояние из 20-го издания Анатомия Грея (1918)
- ^ а б c d е ж Гилберт, Скотт Ф. (2010). Биология развития (9-е изд.). Сандерленд, Массачусетс: Sinauer Associates. С. 333–338. ISBN 978-0878933846.
- ^ Браудер, Леон (1980). Биология развития. Филадельфия: Колледж Сондерса. п.457. ISBN 0-03-056748-3.
- ^ Эмбриология человека, Модуль 7, Раздел 7.2, http://www.embryology.ch/anglais/hdisqueembry/triderm10.html.
- ^ Келлер, Рэй; Ши, Джон; Сатер, Эми К. (1 марта 1992 г.). «Планарная индукция конвергенции и расширения нервной пластинки организатором Xenopus». Динамика развития. 193 (3): 218–234. Дои:10.1002 / aja.1001930303. PMID 1600241.
- ^ а б c d Якобсон, Антоний Г. (1991). «Экспериментальный анализ формирования нервной пластинки и трубки». Американский зоолог. 31 (4): 628–643. Дои:10.1093 / icb / 31.4.628. JSTOR 3883562.
- ^ Smith, Jodi L .; Шенвольф, Гэри К. (1 апреля 1989 г.). «Нотохордальная индукция заклинивания клеток в нервной пластинке курицы и ее роль в формировании нервной трубки». Журнал экспериментальной зоологии. 250 (1): 49–62. Дои:10.1002 / jez.1402500107. PMID 2723610.
- ^ Вольперт, Льюис (1998). Принципы развития. Лондон: современная биология. п. 345. ISBN 0-19-850263-X.
- ^ Уилсон, Пенсильвания; Лагна, G; Сузуки, А; Хеммати-Бриванлу, А. (август 1997 г.). «Зависимое от концентрации формирование паттерна эктодермы Xenopus с помощью BMP4 и его сигнального преобразователя Smad1». Разработка. 124 (16): 3177–84. PMID 9272958.
- ^ а б Лием, Карел Ф; Tremml, Габи; Ролинк, Хенк; Джессел, Томас М (1 сентября 1995 г.). «Дорсальная дифференцировка клеток нервной пластинки, индуцированная BMP-опосредованными сигналами от эпидермальной эктодермы». Клетка. 82 (6): 969–979. Дои:10.1016/0092-8674(95)90276-7. PMID 7553857.
- ^ Eom, Dae S; Амарнатх, Смита; Агарвала, Сима (20 декабря 2012 г.). «Апикобазальная полярность и закрытие нервной трубки». Развитие, рост и дифференциация. 55 (1): 164–172. Дои:10.1111 / dgd.12030. ЧВК 3540145. PMID 23277919.
- ^ де Веллис Дж, Карпентер Э. Общее развитие нервной системы. В: Siegel GJ, Agranoff BW, Albers RW и др., Редакторы. Основы нейрохимии: молекулярные, клеточные и медицинские аспекты. 6-е издание. Филадельфия: Липпинкотт-Рэйвен; 1999. Доступно с: https://www.ncbi.nlm.nih.gov/books/NBK28253/
- ^ а б Пино, Изабель (2006). «Новый метод множественной маркировки, сочетающий гибридизацию in situ с иммунофлуоресценцией». Журнал гистохимии и цитохимии. 54 (11): 1303–1313. Дои:10.1369 / jhc.6a7022.2006. PMID 16899759.
- ^ Сэдлер, Т. (1986). «Потенциальная роль спектрина во время нейруляции». Дж. Эмбриол. 94 (1): 73–82. Получено 27 апреля 2013.
- ^ Тан, СС (1986). «Анализ миграции клеток краниального нервного гребня и ранние судьбы постимплантационных химер крыс». Дж. Эмбриол. 98 (1): 21–58. Получено 27 апреля 2013.
- ^ Бейли, Эндрю П .; Андреа Штрайт (2006). «Сенсорные органы: создание и разрушение предплакодальной области». Актуальные темы биологии развития. 72: 177. Дои:10.1016 / с0070-2153 (05) 72003-2. ISBN 9780121531720. PMID 16564335.
