Сканирующая ионно-проводящая микроскопия - Scanning ion-conductance microscopy

Сканирующая ионно-проводящая микроскопия (SICM) это сканирующая зондовая микроскопия техника, которая использует электрод как наконечник зонда.[1] SICM позволяет определять топографию поверхности микрометрового и даже нанометрового диапазона.[2] структуры в водных средах, проводящих электролиты. Образцы могут быть твердыми или мягкими, как правило, непроводящими, а неразрушающий характер измерения позволяет наблюдать за живыми тканями и клетками, а также за биологическими образцами в целом.
Он способен обнаруживать резкие изменения профиля в образцах.[3] и может быть использован для отображения жесткости живой клетки[4] в тандеме с его подробной топографией или для определения подвижности клеток во время их миграции.[5]
Принцип работы
Сканирующая микроскопия ионной проводимости - это метод, использующий увеличение сопротивления доступа микропипетки в водной среде, содержащей электролит, когда она приближается к плохо проводящей поверхности. Он контролирует ионный ток, протекающий в микро / нанопипетку и из нее, что затруднено, если наконечник находится очень близко к поверхности образца, поскольку зазор, через который могут проходить ионы, уменьшается в размере.
Установка SICM обычно выглядит следующим образом: напряжение прикладывается между двумя электродами Ag / AgCl, один из которых находится в стеклянной микропипетке, а другой - в объеме раствора. Напряжение будет генерировать ионный ток между двумя электродами, втекающий в микропипетку и выходящий из нее. Проводимость между двумя электродами измеряется и зависит от потока ионов.
Движения пипетки регулируются через пьезоэлектрики.
Микропипетка опускается все ближе и ближе к образцу, пока ионный поток не начнет ограничиваться. Тогда проводимость системы снизится (а сопротивление увеличится). Когда это сопротивление достигает определенного порога, наконечник останавливается и положение записывается. Затем наконечник перемещается (по-разному в зависимости от используемого режима, см. Ниже), и другое измерение выполняется в другом месте и так далее. В конце концов, сравнение положений всех измерений дает подробный профиль высоты образца.
Важно отметить, что наконечник останавливается перед контактом с образцом, поэтому он не сгибает и не повреждает наблюдаемую поверхность, что является одним из основных преимуществ SICM.
Эквивалентная схема

Общее сопротивление установки (Rtot) - это сумма трех сопротивлений: Rb, Rm и Rt. Rb - сопротивление раствора электролита между кончиком микропипетки и электродом в объеме раствора. Rm - сопротивление раствора электролита между электродом микропипетки и наконечником. Rt - сопротивление току, протекающему через наконечник.
Rb и Rm зависят от проводимости электролита, а также от положения и формы электродов Ag / AgCl. Rt зависит от размера и формы отверстия, а также от расстояния между зондом и образцом.
Все параметры, за исключением расстояния между зондом и образцом, являются постоянными в рамках данной установки SICM, поэтому для определения топографии образца будет использоваться изменение Rt с расстоянием до образца.
Обычными приближениями являются: 1) падение напряжения на поверхности электродов Ag / AgCl не учитывается, предполагается, что оно незначительно по сравнению с падением напряжения на наконечнике и является постоянным; 2) тот факт, что объемное сопротивление является функцией d пренебрегают, так как она зависит от расстояния между острием и электродом в объеме.
Сравнение с другими методами сканирующей зондовой микроскопии
SICM имеет худшее разрешение, чем AFM или же СТМ, которые обычно могут достигать разрешения около 0,1 нм. Разрешение измерения SICM ограничено 1,5-кратным диаметром отверстия наконечника.[7] теоретически, но измерения, проведенные с диаметром отверстия 13 нм, позволили получить разрешение около 3–6 нм.[8]
SICM можно использовать для изображения плохо проводящих или непроводящих поверхностей,[6] что невозможно с СТМ.
При измерениях методом SICM кончик микропипетки не касается поверхности образца; что позволяет визуализировать мягкие образцы (клетки, биологические образцы, клеточные ворсинки)[9][10][11] без деформации.
SICM используется в растворе, содержащем электролит, поэтому может использоваться в физиологических средах и отображать живые клетки и ткани, а также контролировать биологические процессы, пока они происходят.[11]
В скачкообразном режиме он умеет правильно определять профили с крутыми склонами и канавками.
Режимы визуализации
В SICM есть четыре основных режима визуализации: режим постоянного z, режим постоянного тока (постоянное расстояние), режим переменного тока и режим прыжка / обратного шага / приближения стоя.
Постоянный режим z
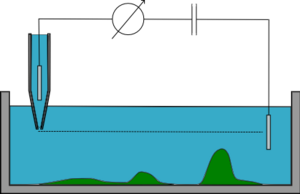
В режиме постоянного z микропипетка поддерживается на постоянном z (высоте), в то время как она перемещается в боковом направлении и контролируется сопротивление, его изменения позволяют воссоздать топографию образца. Этот режим быстрый, но почти не используется, поскольку работает только с очень плоскими сэмплами. Если образец имеет неровную поверхность, пипетка либо врежется в него, либо окажется слишком далеко для визуализации большей части образца.
Режим постоянного тока
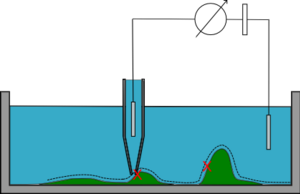
В режиме постоянного тока (DC) (режим постоянного расстояния) микропипетка опускается к образцу до тех пор, пока не будет достигнуто заранее заданное сопротивление. Затем пипетка перемещается в сторону, и петля обратной связи поддерживает расстояние до образца (через значение сопротивления). Положение пипетки по оси Z определяет топографию образца. В этом режиме не обнаруживаются крутые уклоны образца, в таких случаях он может контактировать с образцом и склонен к смещению электродов.
Режим переменного тока

В режиме переменного тока (AC) микропипетка совершает вертикальные колебания в дополнение к своему обычному движению. Пока пипетка все еще находится далеко от поверхности, ионный ток и сопротивление стабильны, поэтому пипетка опускается. Как только сопротивление начинает колебаться, амплитуда служит обратной связью для модуляции положения, пока не будет достигнута заданная амплитуда.[9][10]
Отклик компонента переменного тока увеличивается намного круче, чем отклик постоянного тока, и позволяет записывать более сложные образцы.
Режим прыжка

В режиме прыжка (/ шаг назад / подход стоя) микропипетка опускается к образцу до достижения заданного сопротивления и регистрируется высота. Затем пипетка оттягивается назад, перемещается в сторону и выполняется еще одно измерение, и процесс повторяется. Затем можно восстановить топографию образца.
Прыжковый режим работает медленнее, чем другие, но позволяет отображать сложную топографию и даже целые ячейки без искажения поверхности образца.[12] · .[13]
Комбинации с другими методами и альтернативное использование
SICM использовался для изображения живой нервной клетки из мозга крысы,[5] определить жизненный цикл микроворсинок,[9] наблюдать движение белковых комплексов в сперматозоидах.[2]
SICM сочетается с флуоресцентной микроскопией[2] и резонансный перенос энергии Фёрстера.[14]
SICM использовался в технике «умного патч-зажима», когда пипетка прижималась к поверхности клетки путем всасывания, а затем отслеживалась активность натриевых каналов в клеточной мембране.[15]
Комбинация АСМ и SICM позволила получить изображения синтетических мембран в ионных растворах с высоким разрешением.[16]
Сканирующая ближнепольная оптическая микроскопия использовался с SICM; Измерение SICM позволило поместить кончик пипетки очень близко к поверхности образца. Флуоресцентные частицы, выходящие изнутри микропипетки, обеспечивают источник света для СБОМ, который постоянно обновляется, и предотвращают фотообесцвечивание.[17][18]
FSICM[19] (Fast SICM), значительно улучшающий скорость скачкообразного режима.
Рекомендации
- ^ Хансма П.К., Дрейк Б., Марти О., Гулд С.А., Пратер С.Б. (1989). «Сканирующий микроскоп ионной проводимости». Наука. 243 (4891): 641–3. Bibcode:1989Sci ... 243..641H. Дои:10.1126 / science.2464851. PMID 2464851.
- ^ а б c Шевчук А.И., Фроленков Г.И., Санчес Д., Джеймс П.С., Фридман Н., Лаборатория М.Дж., Джонс Р., Кленерман Д., Корчев Ю.Е. (2006). «Визуализация белков в мембранах живых клеток с помощью сканирующей ионной проводимости с высоким разрешением». Энгью. Chem. Int. Эд. Англ.. 45 (14): 2212–2216. Дои:10.1002 / anie.200503915. PMID 16506257.
- ^ Rheinlaender J, Geisse NA, Proksch R, Schäffer TE (2011). «Сравнение сканирующей микроскопии ионной проводимости с атомно-силовой микроскопией для визуализации клеток». Langmuir. 27 (2): 697–704. Дои:10.1021 / la103275y. PMID 21158392.
- ^ Кларк Р.В., Новак П., Жуков А., Тайлер Э.Дж., Кано-Хаймес М., Дрюс А., Ричардс О., Волынски К., Бишоп С., Кленерман Д. (2016). «Микроскопия субклеточной жесткости с низкой ионной проводимостью». Мягкая материя. 12 (38): 7953–8. Bibcode:2016SMat ... 12.7953C. Дои:10.1039 / c6sm01106c. ЧВК 5166566. PMID 27604678.
- ^ а б Happel, P .; Wehner, F .; Дитцель, И. Сканирующая микроскопия ионной проводимости - инструмент для исследования границ раздела электролит-непроводник. В современных исследованиях и образовательных темах в микроскопии; FORMATEX: Бадахос, Испания, 2007 г .; С. 968–975.
- ^ а б Chen CC, Zhou Y, Baker LA (2012). «Сканирующая микроскопия ионной проводимости». Ежегодный обзор аналитической химии. 5: 207–228. Bibcode:2012ARAC .... 5..207C. Дои:10.1146 / annurev-anchem-062011-143203. PMID 22524219.
- ^ Rheinlaender J, Schäffer TE (2009). «Формирование изображения, разрешение и измерение высоты в сканирующей микроскопии ионной проводимости». J. Appl. Phys. 105 (9): 094905. Дои:10.1063/1.3122007.
- ^ Шевчук А.И., Фроленков Г.И., Санчес Д., Джеймс П.С., Фридман Н., Лаборатория М.Дж., Джонс Р., Кленерман Д., Корчев Ю.Е. (2006). «Визуализация белков в мембранах живых клеток с помощью сканирующей ионной проводимости с высоким разрешением». Энгью. Chem. Int. Эд. Англ.. 45 (14): 2212–2216. Дои:10.1002 / anie.200503915. PMID 16506257.
- ^ а б c Горелик Дж., Шевчук А.И., Фроленков Г.И., Дьяконов И.А., Лаборатория М.Дж., Крос С.Дж., Ричардсон Г.П., Водяной И., Эдвардс К.Р., Кленерман Д. и др. (2003). «Динамическая сборка поверхностных структур в живых клетках». Proc. Natl. Акад. Sci. Соединенные Штаты Америки. 100 (10): 5819–5822. Дои:10.1073 / pnas.1030502100. ЧВК 156284. PMID 12721367.
- ^ а б Горелик Дж, Чжан Й, Шевчук А.И., Фроленков Г.И., Санчес Д., Лаб М.Дж., Водяной И., Эдвардс К.Р., Кленерман Д., Корчев Ю.Е. (2004). «Использование сканирующей микроскопии ионной проводимости для изображения клеток A6». Мол. Клеточный эндокринол. 217 (1–2): 101–108. Дои:10.1016 / j.mce.2003.10.015. PMID 15134807.
- ^ а б Zhang Y, Gorelik J, Sanchez D, Shevchuk A, Lab M, Vodyanoy I, Klenerman D, Edwards C, Korchev Y (2005). «Сканирующая микроскопия ионной проводимости показывает, как функциональный монослой почечного эпителия сохраняет свою целостность». Почка Int. 68 (3): 1071–1077. Дои:10.1111 / j.1523-1755.2005.00499.x. PMID 16105037.
- ^ Манн С.А., Хоффманн Г., Хенгстенберг А., Шуманн В., Дитцель И.Д. (2002). «Импульсная сканирующая микроскопия ионной проводимости - метод исследования культивируемых клеток гиппокампа». J. Neurosci. Методы. 116 (2): 113–117. Дои:10.1016 / s0165-0270 (02) 00023-7. PMID 12044660.
- ^ Новак П., Ли С., Шевчук А.И., Степанян Р., Колдуэлл М., Хьюз С., Смарт Т.Г., Горелик Дж., Останин В.П., Лаборатория М.Дж. и др. (2009). «Наноразмерная визуализация живых клеток с использованием микроскопии прыжковой ионной проводимости». Nat. Методы. 6 (4): 279–281. Дои:10.1038 / nmeth.1306. ЧВК 2702483. PMID 19252505.
- ^ Николаев В.О., Мошков А., Лион А.Р., Мираголи М., Новак П., Паур Х., Лозе М.Дж., Корчев Ю.Е., Хардинг С.Е., Горелик Дж. (2010). «Перераспределение бета2-адренорецепторов при сердечной недостаточности изменяет компартментацию цАМФ». Наука. 327 (5973): 1653–1657. Дои:10.1126 / science.1185988. PMID 20185685.
- ^ Duclohier H (2005). «Нейрональные натриевые каналы в клетках желудочков сердца локализуются вблизи отверстий Т-канальцев». Biochem. Биофиз. Res. Сообщество. 334 (4): 1135–1140. Дои:10.1016 / j.bbrc.2005.06.203. PMID 16038878.
- ^ Прокш Р., Лал Р., Хансма П. К., Морс Д., Стаки Г. (1996). «Визуализация внутренней и внешней пористой структуры мембран в жидкости: сканирующая ионная проводимость в режиме TappingMode». Биофизический журнал. 71 (4): 2155–7. Дои:10.1016 / с0006-3495 (96) 79416-х. ЧВК 1233683. PMID 8889191.
- ^ Bruckbauer A, Ying L, Rothery AM, Korchev YE, Klenerman D (2002). "Характеристика нового источника света для одновременной оптической и сканирующей микроскопии ионной проводимости". Аналитическая химия. 74 (11): 2612. Дои:10.1021 / ac011257y. PMID 12069246.
- ^ Ротери AM, Горелик Дж., Брукбауэр А., Корчев Ю.Е., Кленерманн Д. (2003). «Новый источник света для SICM-SNOM живых клеток». Журнал микроскопии. 209 (2): 94–101. Дои:10.1046 / j.1365-2818.2003.01122.x. PMID 12588526.
- ^ Жуков А, Ричардс О, Останин В, Корчев Ю, Кленерман Д (2012). «Гибридный режим сканирования для получения изображений с помощью быстрой сканирующей ионной проводимости (SICM)». Ультрамикроскопия. 121C: 1–7. Дои:10.1016 / j.ultramic.2012.06.015. ЧВК 3462995. PMID 22902298.

