Химическая силовая микроскопия - Chemical force microscopy

Химическая силовая микроскопия (CFM) является разновидностью атомно-силовая микроскопия (AFM), который стал универсальным инструментом для определения характеристик поверхностей материалов. С помощью АСМ структурная морфология исследуется с использованием простых режимов постукивания или контакта, которые используют Ван-дер-Ваальсовы взаимодействия между зондом и образцом для поддержания постоянной амплитуды отклонения зонда (режим постоянной силы) или поддержания высоты при измерении отклонения зонда (режим постоянной высоты). CFM, с другой стороны, использует химические взаимодействия между функционализированным наконечником зонда и образцом. Выбор химического состава обычно заключается в покрытии наконечника и поверхности золотом R-SH. тиолы прилагается, R обозначает представляющие интерес функциональные группы. CFM позволяет определять химическую природу поверхностей, независимо от их конкретной морфологии, а также облегчает изучение основной энтальпии химической связи и поверхностной энергии. Обычно CFM ограничивается тепловыми колебаниями внутри кантилевера, удерживающего зонд. Это ограничивает разрешение измерения силы до ~ 1 пН, что все еще очень подходит, учитывая слабые COOH / CH.3 взаимодействия составляют ~ 20 пН на пару.[1][2] Гидрофобность используется в качестве основного примера при рассмотрении CFM, но, безусловно, с помощью этого метода можно исследовать любой тип связывания.
Новаторская работа
CFM в первую очередь была разработана Чарльз Либер в Гарвардском университете в 1994 году.[1] Метод был продемонстрирован с использованием гидрофобности, при которой полярные молекулы (например, COOH), как правило, имеют наиболее сильное связывание друг с другом, а затем неполярные (например, CH3-CH3) связь, и комбинация является самой слабой. Наконечники зондов функционализированы, а субстраты имеют рисунок с этими молекулами. Были протестированы все комбинации функционализации, как путем контакта кончика, так и путем удаления, а также пространственного картирования субстратов с рисунком обоих фрагментов и наблюдения за комплементарностью в контрасте изображения. Оба эти метода обсуждаются ниже. Используемый прибор АСМ аналогичен показанному на рисунке 1.
Сила адгезии (испытание на растяжение)
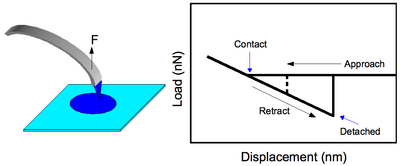
Это более простой режим работы CFM, когда функционализированный наконечник приводится в контакт с поверхностью и тянется, чтобы наблюдать силу, при которой происходит разделение, Fобъявление (см. рисунок 2). Теория механики адгезии Джонсона-Кендалла-Робертса (JKR) предсказывает это значение как [1][2]
(1)
где WSMT = γSM+ γTM-γST где R - радиус иглы, а γ - различные поверхностные энергии между зондом, образцом и средой, в которой каждый находится (жидкости, обсуждаемые ниже). R обычно получают из SEM и γSM и γTM из измерений угла смачивания на подложках с данными фрагментами. Когда используются те же функциональные группы, γSM = γTM и γST = 0, что приводит к Fобъявление = 3πRγСМ, ТМ. Выполнение этого дважды с двумя разными частями (например, COOH и CH3) дает значения γSM и γTM, оба из которых могут использоваться вместе в одном эксперименте для определения γST. Следовательно, Fобъявление может быть рассчитан для любой комбинации функций для сравнения с определенными значениями CFM.
Для иглы и поверхности с аналогичными функциональными возможностями при отрыве острия теория JKR также предсказывает радиус контакта[2]
(2)
с «эффективным» Модуль для младших острия K = (2/3) (E / (1-ν2)) полученный из фактического значения E и коэффициент Пуассона ν. Если известна эффективная площадь отдельной функциональной группы, AFG (например, из моделирования квантовой химии), общее количество лигандов, участвующих в напряжении, можно оценить как . Как указывалось ранее, разрешение по силе CFM действительно позволяет исследовать отдельные связи даже самых слабых разновидностей, но кривизна кончика обычно предотвращает это. Используя уравнение 2, радиус кривизны R <10 нм был определен как требование для проведения испытаний на растяжение отдельных линейных фрагментов.[2]
Следует отметить, что работа, соответствующая гистерезису в профиле силы (рис. 2), не коррелирует с энергией связи. Работа, выполняемая при втягивании наконечника, , аппроксимируемая за счет линейного поведения деформации с FМаксимум - сила, а Δx - смещение непосредственно перед выпуском. Используя результаты Frisbie et al.,[1] нормированные на предполагаемые 50 функциональных групп в контакте, значения работы оцениваются как 39 эВ, 0,25 эВ и 4,3 эВ для COOH / COOH, COOH / CH3, а CH3/ CH3 взаимодействия соответственно. Грубо говоря, энергии межмолекулярных связей можно рассчитать по формуле: Eсвязь= kTB, ТB температура кипения. Согласно этому, Eсвязь = 32,5 мэВ для Муравьиная кислота, HCOOH и 9,73 мэВ для метан, CH4, каждое значение примерно на 3 порядка меньше, чем можно было бы предположить в эксперименте. Даже если рассматривать пассивацию поверхности EtOH (обсуждается ниже), большая ошибка кажется невосполнимой. Энергия самых сильных водородных связей не превышает ~ 1 эВ.[3] Это в значительной степени означает, что кантилевер имеет силовую константу, меньшую или порядка таковой для взаимодействий связей, и, следовательно, его нельзя рассматривать как абсолютно жесткий. Это действительно открывает путь для увеличения полезности CFM, если можно использовать более жесткие консоли, сохраняя при этом разрешение силы.
Картирование силы трения
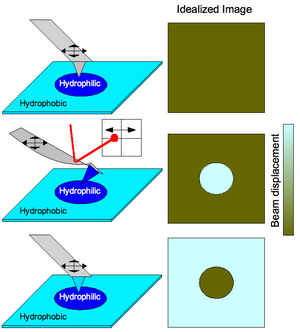
Химические взаимодействия могут также использоваться для картирования предварительно подготовленных субстратов с различными функциональными возможностями (см. Рисунок 3). Сканирование поверхности, имеющей переменную гидрофобность, с помощью наконечника, не имеющего прикрепленных функциональных групп, привело бы к получению изображения без контраста, поскольку поверхность морфологически лишена особенностей (простая операция АСМ). Приведение кончика к гидрофильным функциям приведет к изгибу кантилевера, когда кончик сканирует гидрофильные части субстрата из-за сильного взаимодействия кончика с субстратом. Это обнаруживается по отклонению лазера в позиционно-чувствительный детектор Таким образом создается изображение химического профиля поверхности. Как правило, более светлая область соответствует большей амплитуде отклонения, поэтому более сильное соединение соответствует более светлым участкам карты изображения CFM. Когда функционализация кантилевера переключается так, что наконечник изгибается при встрече с гидрофобными областями подложки, наблюдается дополнительное изображение.
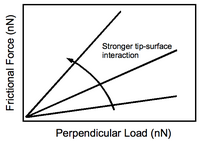
Реакция силы трения на величину перпендикулярной нагрузки, прикладываемой наконечником к подложке, показана на рисунке 4. Увеличение взаимодействий наконечник-подложка приводит к более крутому наклону, как и следовало ожидать. Экспериментальное значение имеет тот факт, что контраст между различными функциональными элементами на поверхности можно усилить за счет приложения большей перпендикулярной силы. Конечно, это происходит за счет возможного повреждения основания.
Окружающий: измерения в жидкостях
Капиллярная сила представляет собой серьезную проблему при измерении силы растяжения, поскольку она эффективно усиливает взаимодействие зонд-поверхность. Обычно это вызвано влагой, адсорбированной на поверхности из окружающей среды. Чтобы устранить эту дополнительную силу, можно проводить измерения в жидкостях. Если наконечник с X-концом и подложка в жидкости L, добавка к Fобъявление рассчитывается по формуле 1 с WXLX = 2γLL; то есть дополнительная сила возникает из-за притяжения молекул жидкости друг к другу. Это ~ 10 пН для EtOH, что все еще позволяет наблюдать даже самые слабые полярные / неполярные взаимодействия (~ 20 пН).[2] Выбор жидкости зависит от того, какие взаимодействия представляют интерес. Когда растворитель не смешивается с функциональными группами, существует большая связь между наконечником и поверхностью, чем обычно. Следовательно, органические растворители подходят для изучения Ван-дер-Ваальса и водородных связей, тогда как электролиты лучше всего подходят для исследования гидрофобных и электростатических сил.
Приложения в нанонауке

Биологическая реализация CFM на наноразмерном уровне - это разворачивание белков с функционализированными кончиком и поверхностью (см. Рисунок 5).[4] Из-за увеличенной площади контакта кончик и поверхность действуют как якоря, удерживающие связки белков, пока они разделяются. По мере раскручивания сила требовала скачков, указывающих на различные стадии разматывания: (1) разделение на пучки, (2) разделение пучка на домены кристаллического белка, удерживаемые вместе силами Ван-дер-Ваальса, и (3) линеаризация белка после преодоления вторичное склеивание. С помощью этого метода можно получить информацию о внутренней структуре этих сложных белков, а также лучше понять взаимодействия компонентов.
Второе соображение - это то, что использует преимущества уникальных наноразмерных свойств материалов. Высота соотношение сторон из углеродные нанотрубки (легко> 1000) используется для изображения поверхностей с глубокими особенностями.[5] Использование углеродного материала расширяет химию функционализации, поскольку существует бесчисленное множество способов химической модификации боковых стенок нанотрубок (например, диазонием, простыми алкилами, водородом, озоном / кислородом и аминами). Многослойные нанотрубки обычно используются из-за их жесткости. Из-за того, что их концы приблизительно плоские, можно оценить количество функциональных групп, которые контактируют с подложкой, зная диаметр трубки и количество стенок, которые помогают в определении свойств растяжения отдельного фрагмента. Конечно, этот метод имеет очевидное применение в трибология также.
Рекомендации
- ^ а б c d Frisbie, C.D .; Розняй, Л. Ф .; Ной, А .; Wrighton, M. S .; Либер, К. М. (1994). "Функциональная групповая визуализация с помощью химической силовой микроскопии". Наука. 265 (5181): 2071–4. Bibcode:1994Наука ... 265.2071F. Дои:10.1126 / science.265.5181.2071. PMID 17811409.
- ^ а б c d е Ной, А .; Везенов, Д. В .; Либер, К. М. (1997). «Химическая силовая микроскопия». Анну. Rev. Mater. Наука. 27: 381. Bibcode:1997AnRMS..27..381N. Дои:10.1146 / annurev.matsci.27.1.381. S2CID 53075854.
- ^ Эмсли (1980). «Очень сильная водородная связь». Обзоры химического общества. 9: 91. Дои:10.1039 / cs9800900091.
- ^ Златанова, J .; Lindsay, S.M .; Леуба, С. Х. (2000). «Силовая спектроскопия одиночных молекул с использованием атомно-силового микроскопа». Прог. Биофиз. Мол. Биол. 74 (1–2): 37–61. Дои:10.1016 / S0079-6107 (00) 00014-6. PMID 11106806.
- ^ Wong, S. S .; Йоселевич, Э .; Вулли, А. Т .; Cheung, C.L .; Либер, К. М. (1998). «Ковалентно функционализированные нанотрубки как зонды нанометрового размера в химии и биологии». Природа. 394 (6688): 52–5. Bibcode:1998 Натур 394 ... 52 Вт. Дои:10.1038/27873. PMID 9665127.





