Трет-бутилпероксибензоат - Tert-Butyl peroxybenzoate
 | |
| Имена | |
|---|---|
| Название ИЮПАК терт-Бутилбензолкарбопероксоат | |
| Другие имена терт-Бутилпербензоат | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ChemSpider | |
| ECHA InfoCard | 100.009.440 |
PubChem CID | |
| UNII | |
| |
| |
| Свойства | |
| C11ЧАС14О3 | |
| Молярная масса | 194.230 г · моль−1 |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
терт-Бутилпероксибензоат (TBPB) химическое соединение из группы Peresters (соединения, содержащие общую структуру R1-C (O) OO-R2) который содержит фенильная группа как R1 и терт-бутильная группа как R2. Часто используется как радикальный инициатор в реакции полимеризации, например, производство LDPE от этилен, и для сшивание, например, для ненасыщенных полиэфирных смол.
Свойства
TBPB представляет собой прозрачную светло-желтую жидкость, которая плохо растворяется в воде, но хорошо во многих органических растворителях, таких как этанол или фталат.[1]
В качестве пероксосоединения TBPB содержит около 8,16 вес% активного кислорода и имеет температура самоускоряющегося разложения (ТСУР) около 60 ° C. ТСУР - это самая низкая температура, при которой самоускоряющееся разложение транспортной упаковки может происходить в течение недели, и которую нельзя превышать при хранении или транспортировке.[2] Поэтому TBPB следует хранить при температуре не менее 10 ° C (ниже затвердевание ) и максимум 50 ° C. Разбавление высококипящий растворитель увеличивает ТСУР. Период полураспада TBPB, в котором разлагается 50% сложного пероксиэфира, составляет 10 часов при 104 ° C, один час при 124 ° C и одну минуту при 165 ° C. Амины, ионы металлов, сильные кислоты и базы, а также сильный сокращение и окислители ускорить разложение TBPB даже в низких концентрациях.[2] Однако TBPB - один из самых безопасных в обращении сложных пероксидов или органических пероксидов.[3] Основные продукты разложения терт-бутилпероксибензоат являются углекислый газ, ацетон, метан, терт-бутанол, бензойная кислота и бензол.[4]
Производство
Стандартная процедура приготовления перстеров - это ацилирование из терт-бутилгидропероксид с участием бензоилхлорид.[5] В реакции большой избыток терт-бутилгидропероксид и хлористый водород сформировано удалено в вакууме посредством чего практически количественный Уступать получается.

Приложения
Приложения в химии полимеров
В первую очередь, TBPB используется как радикальный инициатор, либо при полимеризации, например, этилен (до LDPE), винилхлорид, стирол или сложные эфиры акриловой кислоты или так называемые ненасыщенные полиэфирные смолы (смолы UP).[1] Количество, используемое для отверждения смол UP, составляет около 1-2%.[1]
Недостатком, особенно при производстве полимеров для применения в пищевой или косметической промышленности, является возможное образование бензола в качестве продукта разложения, который может диффундировать из полимера (например, из упаковочной пленки LDPE).
Приложения в органической химии
В защитная группа 2-триметилсилилэтансульфонилхлорид (SES-Cl) для первичного и вторичного аминогруппы доступен по реакции винилтриметилсилан с участием гидрогенсульфит натрия и TBPB с натриевой солью триметилсилилэтансульфоновой кислоты и последующей реакцией с тионилхлоридом до соответствующего сульфонилхлорида.[3]

TBPB может использоваться для введения бензоилокси группа в аллильном положении непредельных углеводородов.[6]

Из циклогексена 3-бензоилоксициклогексен образуется с TBPB в присутствии каталитических количеств бромида меди (I) с выходом от 71 до 80%.
Это аллильное окисление алкенов, также известное как Хараша-Сосновского окисления, генерирует рацемический аллиловые бензоаты в присутствии каталитических количеств бромид меди (I).[7]
Модификация реакции использует трифторметансульфонат меди (II) как катализатор и DBN или DBU в качестве оснований для достижения выходов до 80% в реакции ациклических олефинов с TBPB до аллильных бензоатов.[8]
Заменен оксазолины и тиазолины может быть окислен до соответствующего оксазолы и тиазолы в модифицированном окислении Хараша-Сосновского TBPB и смесью солей Cu (I) и Cu (II) с подходящими выходами.[9]

Карбоалкоксигруппа в положении C-4 важна для успешной реакции.
Бензол и фураны может быть алкенилирован олефинами в результате окислительного сочетания при катализе солями палладия с TBPB в качестве акцептора водорода.[10]
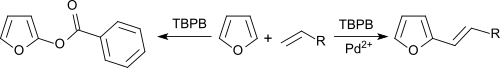
В отсутствие Pd2+ соли, ароматические углеводороды бензоксилированы.
использованная литература
- ^ а б c Объединенные инициаторы, Technisches Datenblatt, TBPB
- ^ а б Производители органических пероксидов Отдел безопасности, БЕЗОПАСНОСТЬ И ОБРАЩЕНИЕ С ОРГАНИЧЕСКИМИ ПЕРОКСИДАМИ Общество индустрии пластмасс, издание 2012 г. В архиве 2016-04-01 на Wayback Machine
- ^ а б «2-Триметилсилилэтансульфонилхлорид (SES-Cl)». Органический синтез. Дои:10.15227 / orgsyn.075.0161.
- ^ ПЕРГАН ГмбХ: Organische Peroxide für die полимеризация
- ^ Н.А. Милас, Д.Г. Орфанос, Р.Дж. Кляйн (1964), "Сольволиз хлорангидридов трет-алкилгидропероксидами", J. Org. Chem., 29 (10), стр. 3099–3100, Дои:10.1021 / jo01033a525CS1 maint: несколько имен: список авторов (ссылка на сайт)
- ^ «3-Бензоилоксициклогексен». Органический синтез. Дои:10.15227 / orgsyn.048.0018.
- ^ РС. Хараш, Г. Сосновский (1958), «Реакции трет-бутилпербензоата и олефинов - стереоспецифическая реакция», Варенье. Chem. Soc., 80 (3), стр. 756–756, Дои:10.1021 / ja01536a062
- ^ Г. Сакар, А. ДаттаГупта, В.К. Сингх (1996), «Комплекс Cu (OTf) 2 - DBN / DBU как эффективный катализатор аллильного окисления олефинов с терт-бутилпербензоат », Tetrahedron Lett., 37 (46), стр. 8435–8436, Дои:10.1016/0040-4039(96)01911-9CS1 maint: несколько имен: список авторов (ссылка на сайт)
- ^ А.И. Мейерс, Ф. Таварес (1996), "Окисление оксазолинов и тиазолинов до оксазолов и тиазолов. Применение реакции Хараша-Сосновского", J. Org. Chem., 61 (23), стр. 8207–8215, Дои:10.1021 / jo9613491
- ^ Дж. Цуджи, Х. Нагашима (1984), «Катализируемое палладием окислительное сочетание ароматических соединений с олефинами с использованием трет-бутилпербензоата в качестве акцептора водорода», Тетраэдр, 40 (14), стр. 2699–2702, Дои:10.1016 / S0040-4020 (01) 96888-7
