Сплайсосомная РНК U2 - U2 spliceosomal RNA
| Сплайсосомная РНК U2 | |
|---|---|
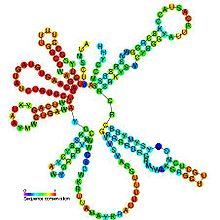 Предсказанный вторичная структура и сохранение последовательности U2 | |
| Идентификаторы | |
| Символ | U2 |
| Рфам | RF00004 |
| Прочие данные | |
| РНК тип | Ген; мяРНК; сращивание |
| Домен (ы) | Эукариоты |
| ИДТИ | Термин GO должен начинаться с GO: Термин GO должен начинаться с GO: Термин GO должен начинаться с GO: |
| ТАК | ТАК: 0000392 |
| PDB структуры | PDBe |
U2-сплайсосомные мяРНК являются разновидностью малая ядерная РНК (мяРНК ) молекулы, обнаруженные в основном сплайсосомном (Sm) аппарате практически всех эукариотических организмов. В естественных условиях, U2 мяРНК вместе с ассоциированными с ней полипептидами собираются с образованием U2 малый ядерный рибонуклеопротеин (snRNP ), важный компонент основного сплайсосомального комплекса.[1] Основной путь сплайсосомного сплайсинга иногда называют зависимым от U2 на основании класса Sm интрон - обнаружены в первичных транскриптах мРНК - которые распознаются исключительно U2 snRNP на ранних стадиях сплайсосомной сборки.[2] В дополнение к U2-зависимому распознаванию интронов, U2 snRNA, как предполагается, играет каталитическую роль в химии сплайсинга пре-РНК.[3][4] Похожий на рибосомные РНК (рРНК ), Sm snRNAs д. Опосредовать как РНК: РНК, так и РНК: белковые контакты и, следовательно, эволюционировали специализированные, высококонсервативные, первичные и вторичные структурные элементы, способствующие этим типам взаимодействий.[5][6]
Вскоре после открытия, что мРНК первичные транскрипты содержат длинные некодирующие промежуточные последовательности (интроны ) к Острый и Робертс,[7][8] Джоан Стейтц начали работу по характеристике биохимического механизма вырезания интронов.[9] Любопытное наблюдение, что последовательность, обнаруженная в 5´ области мяРНК U1, демонстрирует обширную комплементарность спаривания оснований с консервативными последовательностями через 5´ сплайсинговые соединения в hnRNA Транскрипты вызвали предположение, что определенные мяРНК могут участвовать в распознавании границ сайтов сплайсинга через контакты РНК: РНК.[9] Только недавно атомные кристаллические структуры продемонстрировали, что первоначальная гипотеза действительно верна, даже если сложность этих взаимодействий не была полностью осознана в то время.[5][6][10]
Элементы распознавания мяРНК U2
В Saccharomyces cerevisiae U2 мяРНК связана с 18 полипептиды, семь из которых являются структурными белками, общими для всех snRNP класса Sm.[11] Эти неспецифические структурные белки связываются с Sm snRNA через высококонсервативную последовательность узнавания (AUпГРАММ,п = 4-6), расположенные внутри РНК, называемые сайтами связывания Sm.[12] Два других белка, A´ и B´´, являются U2-специфичными и нуждаются в структурных элементах, уникальных для U2 snRNA - в частности, двух петлях 3´ ствола - для сборки snRNP.[11] Белковые комплексы из трех субъединиц SF3a и из шести субъединиц SF3b также связываются с мяРНК U2.[13].
U2 snRNA участвует в распознавании интрона через 7-12 нуклеотидную последовательность между 18-40 нуклеотидами выше 3´ сайта сплайсинга, известного как последовательность точки ветвления (BPS).[1][2] В дрожжи, консенсусный BPS имеет длину 7 нуклеотидных остатков, а комплементарная последовательность распознавания в U2 snRNA составляет 6 нуклеотидов. Образование дуплекса между этими двумя последовательностями приводит к выпучиванию консервативной аденозин остаток в положении 5 BPS. Выпуклый остаток аденозина принимает конформацию C3´-эндо.[14] что с помощью факторов сплайсинга Cwc25, Yju2 и Isy1 выравнивает 2´ OH для встроенной атаки фосфор атом в месте соединения 5´[15]. Нуклеофильная атака инициирует первую из двух последовательных переэтерификация реакции, которые сплайсируют интрон - через необычный 2´-5´-3´ связанный интермедиат лариата, где вторая переэтерификация включает лигирование двух фланкирующих экзонов.
Первичная и вторичная структура
Хотя длина последовательности мяРНК U2 может варьироваться на порядок во всех эукариотический У организмов все мяРНК U2 содержат множество филогенетически константных участков, особенно в пределах первых 80 нуклеотидов ниже 5´ конца, где 85% положений консервативны.[16] Более того, некоторые вторичные структурные элементы также сохраняются, включая стержневые петли I, II, III, IV и некоторые одноцепочечные области, связывающие эти домены.[16][17] Стеблевая петля II в дрожжевой мяРНК U2 содержит необычную пару оснований GA с разрезом, ведущую в характерный мотив петли с U-образным поворотом, который имеет геометрическую конформацию, аналогичную конформации тРНК антикодоновые петли.[5] Все мяРНК U2 имеют концевой стержень петля (IV) со спиралью из 10-16 пар оснований и консервативной петлей из 11 нуклеотидов с консенсусной последовательностью 5´-UYGCANUURYN-3´.[16]
МнРНК U2 являются наиболее модифицированными из всех малых ядерных РНК.[18] Хотя точное местонахождение этих посттранскрипционные модификации может варьироваться от организма к организму, новые данные свидетельствуют о том, что существует сильная корреляция между модификацией U2 мяРНК и биологической функцией.[18] Модификации включают конверсию некоторых уридин остатки псевдоуридин, 2´-O-метилирование, метилирование азотистых оснований и превращение 5´-монометилированного гуанозинового кэпа в 2,2,7-триметилированный гуанозиновый кэп.[18] Многие из этих модификаций находятся в 27-нуклеотидной области на 5´ конце молекулы.[18]
Конформационная динамика
В сплайсосома представляет собой динамическую молекулярную машину, которая претерпевает несколько конформационных перестроек в процессе сборки и сплайсинга. Хотя многие из биохимических деталей, окружающих сплайсосомные перестройки, остаются неясными, недавние исследования визуализировали образование критического складчатого комплекса между U2 и U6 snRNAs, немедленно переходящего к первой стадии реакции сплайсинга.[19][6] Это событие сворачивания способствует образованию четырехспирального соединения, которое, как полагают, обеспечивает каркас для критических компонентов активного сайта, включая выравнивание сайта сплайсинга 5´ с аденозином в точке ветвления для встроенной атаки 2´ OH и координацию двух Mg2+ ионы для стабилизации образования отрицательного заряда на следующих этапах.[19]
Эволюционное происхождение
Примечательной характеристикой складки U2-U6 является ее структурное сходство со структурой домена V при самосплайсинге. интроны группы II.[6][3] Триада AGC, обнаруженная в мяРНК U6, консервативна в интронах группы II и, как было обнаружено, также способствует тем же взаимодействиям третичного стэкинга.[6] Образование пары колебаний GU на ранней стадии события сворачивания U2-U6 также наблюдается при образовании каталитического ядра интронов группы II.[19] Наконец, вполне вероятно, что сплайсосома использует тот же механизм двух ионов металлов, что и интроны группы II, учитывая структурную сохранность сайтов связывания металлов, обнаруженных в пределах U2-U6 складки.[3] Степень сохранения как вторичной, так и третичной структуры между интронами группы II и складкой U2-U6 в активном центре сплайсосомы убедительно указывает на то, что интроны группы II и сплайсосома имеют общее эволюционное происхождение.
Смотрите также
Рекомендации
- ^ а б Альбертс Б., Джонсон А., Льюис Дж., Рафф М., Робертс К., Уолтер П. (2002). Молекулярная биология клетки (4-е изд.). Наука о гирляндах. ISBN 978-0815332183.
- ^ а б Нельсон Д.Л., Кокс М.М., Ленингер А.Л. (2013). Принципы биохимии Ленингера (6-е изд.). Нью-Йорк: W.H. Фримен и компания. ISBN 9781429234146. OCLC 824794893.
- ^ а б c Fica SM, Tuttle N, Novak T., Li NS, Lu J, Koodathingal P, Dai Q, Staley JP, Piccirilli JA (ноябрь 2013 г.). «РНК катализирует сплайсинг ядерной пре-мРНК». Природа. 503 (7475): 229–34. Bibcode:2013Натура.503..229F. Дои:10.1038 / природа12734. ЧВК 4666680. PMID 24196718.
- ^ Ши И (август 2017 г.). "Сплайсосома: белковый металлорибозим". Журнал молекулярной биологии. 429 (17): 2640–2653. Дои:10.1016 / j.jmb.2017.07.010. PMID 28733144.
- ^ а б c Столлингс, Сара С; Мур, Питер Б. (1997). «Структура важного элемента сплайсинга: петля ствола IIa из дрожжевой мРНК U2». Структура. 5 (9): 1173–1185. Дои:10.1016 / s0969-2126 (97) 00268-2. ISSN 0969-2126. PMID 9331416.
- ^ а б c d е Берк Дж. Э., Сашитал Д. Г., Цзо X, Ван YX, Мясник С. Е. (апрель 2012 г.). «Структура дрожжевого комплекса U2 / U6 мяРНК». РНК. 18 (4): 673–83. Дои:10.1261 / rna.031138.111. ЧВК 3312555. PMID 22328579.
- ^ Бергет С.М., Мур С., Шарп П.А. (август 1977 г.). «Сплайсированные сегменты на 5'-конце поздней мРНК аденовируса 2». Труды Национальной академии наук Соединенных Штатов Америки. 74 (8): 3171–5. Bibcode:1977ПНАС ... 74.3171Б. Дои:10.1073 / pnas.74.8.3171. ЧВК 431482. PMID 269380.
- ^ Чоу LT, Гелинас Р.Э., Брокер Т.Р., Робертс Р.Дж. (сентябрь 1977 г.). «Удивительное расположение последовательностей на 5'-концах матричной РНК аденовируса 2». Клетка. 12 (1): 1–8. Дои:10.1016/0092-8674(77)90180-5. PMID 902310.
- ^ а б Лернер М. Р., Бойл Дж. А., Маунт С. М., Волин С. Л., Стейтц Дж. А. (январь 1980 г.). «Участвуют ли snRNP в сплайсинге?». Природа. 283 (5743): 220–4. Дои:10.1038 / 283220a0. PMID 7350545.
- ^ Перриман Р., Арес М. (май 2010 г.). «Инвариантные нуклеотиды мяРНК U2 образуют стеблевую петлю для распознавания интрона на ранней стадии сплайсинга». Молекулярная клетка. 38 (3): 416–27. Дои:10.1016 / j.molcel.2010.02.036. ЧВК 2872779. PMID 20471947.
- ^ а б Пан ZQ, Prives C (декабрь 1989 г.). «Последовательности мяРНК U2, которые связывают U2-специфические белки, незаменимы для функции мяРНП U2 при сплайсинге». Гены и развитие. 3 (12A): 1887–98. Дои:10.1101 / gad.3.12a.1887. PMID 2559872.
- ^ Маттай И. В., Хабетс В. Дж., Ван Венроой В. Дж. (Май 1986 г.). «Моноспецифические антитела раскрывают детали структуры мяРНП U2 и взаимодействия между мяРНП U1 и U2». Журнал EMBO. 5 (5): 997–1002. Дои:10.1002 / j.1460-2075.1986.tb04314.x. ЧВК 1166893. PMID 2941274.
- ^ Джимбовский, Анджей; Вентура, Ана-Паула; Руц, Бертольд; Каспари, Фридерике; Faux, Селин; Халганд, Фредерик; Лапревот, Оливье; Серафин, Бертран (2004-12-08). «Протеомный анализ идентифицирует новый комплекс, необходимый для удержания и сплайсинга ядерной пре-мРНК». Журнал EMBO. 23 (24): 4847–4856. Дои:10.1038 / sj.emboj.7600482. ISSN 0261-4189. ЧВК 535094. PMID 15565172.
- ^ Берглунд Дж. А., Росбаш М., Шульц С. К. (май 2001 г.). "Кристаллическая структура модельного дуплекса U2 мяРНК точка ветвления, содержащего выпуклые аденозины". РНК. 7 (5): 682–91. Дои:10.1017 / S1355838201002187. ЧВК 1370120. PMID 11350032.
- ^ Galej, Wojciech P .; Wilkinson, Max E .; Fica, Sebastian M .; Обридж, Крис; Ньюман, Эндрю Дж .; Нагай, Киёси (8 сентября 2016 г.). «Крио-ЭМ структура сплайсосомы сразу после разветвления». Природа. 537 (7619): 197–201. Bibcode:2016Натура.537..197G. Дои:10.1038 / природа19316. ISSN 1476-4687. ЧВК 5156311. PMID 27459055.
- ^ а б c Гатри С., Паттерсон Б. (1988). «Сплайсосомные мяРНК». Ежегодный обзор генетики. 22: 387–419. Дои:10.1146 / annurev.ge.22.120188.002131. PMID 2977088.
- ^ Кремер А. (август 1987 г.). «Анализ резистентных к РНКазе-А областей мРНК главного позднего предшественника аденовируса 2 в экстрактах сплайсинга показывает упорядоченное взаимодействие ядерных компонентов с субстратной РНК». Журнал молекулярной биологии. 196 (3): 559–73. Дои:10.1016/0022-2836(87)90032-5. PMID 3681967.
- ^ а б c d Ю. Ю. Т., Шу М. Д., Стейтц Д. А. (октябрь 1998 г.). «Модификации мяРНК U2 необходимы для сборки мяРНП и сплайсинга пре-мРНК». Журнал EMBO. 17 (19): 5783–95. Дои:10.1093 / emboj / 17.19.5783. ЧВК 1170906. PMID 9755178.
- ^ а б c Сашитал Д.Г., Корнилеску Г., Макманус С.Дж., Бров Д.А., Мясник С.Е. (декабрь 2004 г.). «Сворачивание РНК U2-U6 показывает интроноподобный домен группы II и четырехспиральное соединение». Структурная и молекулярная биология природы. 11 (12): 1237–42. Дои:10.1038 / nsmb863. PMID 15543154.
дальнейшее чтение
- Ньюби М. И., Гринбаум Н. Л. (июнь 2001 г.). «Консервативная модификация псевдоуридина в эукариотической U2 snRNA вызывает изменение в архитектуре ответвлений». РНК. 7 (6): 833–45. Дои:10.1017 / S1355838201002308. ЧВК 1370140. PMID 11424937.
- Берглунд Дж. А., Росбаш М., Шульц С. К. (май 2001 г.). "Кристаллическая структура модельного дуплекса U2 мяРНК точка ветвления, содержащего выпуклые аденозины". РНК. 7 (5): 682–91. Дои:10.1017 / S1355838201002187. ЧВК 1370120. PMID 11350032.
