Бета шпилька - Beta hairpin

В бета шпилька (иногда также называют бета-лента или же бета-бета блок) простой белок структурный мотив с участием двух бета-нити это похоже на заколка для волос. Мотив состоит из двух соседних нитей первичная структура, ориентированные в антипараллельный направление ( N-конец одного листа примыкает к C-конец следующего), и связаны короткой петлей от двух до пяти аминокислоты. Бета-шпильки могут возникать изолированно или как часть серии водородная связь пряди, которые вместе составляют бета-лист.
Такие исследователи, как Франсиско Бланко и другие. было использовано белок ЯМР показать, что бета-шпильки могут быть образованы из изолированных коротких пептиды в водном растворе, предполагая, что шпильки могут образовывать центры зародышеобразования для сворачивание белка.[1]
Классификация
Бета-шпильки изначально классифицировались исключительно по количеству аминокислота остатков в их последовательностях петель, так что они были названы с одним остатком, с двумя остатками и т. д.[2] Эта система, однако, несколько неоднозначна, поскольку она не принимает во внимание, связаны ли остатки, которые сигнализируют о конце шпильки, одинарной или двойной водородной связью друг с другом. С тех пор Милнер-Уайт и Поэт предложили усовершенствованный способ классификации.[3] Бета-шпильки разбиты на четыре отдельных класса, как показано на рисунке 1 публикации. Каждый класс начинается с наименьшего возможного количества петлевых остатков и постепенно увеличивает размер петли, удаляя водородные связи в бета-листе. Первичная шпилька класса 1 представляет собой петлю с одним остатком, в которой связанные остатки имеют две водородные связи. Затем одна водородная связь удаляется, чтобы создать петлю из трех остатков, которая является вторичной шпилькой класса 1. Односвязанные остатки учитываются в последовательности петли, но также сигнализируют о конце петли, таким образом определяя эту шпильку как шпильку из трех остатков. петля. Затем эта одинарная водородная связь удаляется, чтобы создать третичную шпильку; петля из пяти остатков с дважды связанными остатками. Этот шаблон продолжается бесконечно и определяет все бета-шпильки внутри класса. Класс 2 следует той же схеме, начиная с петли из двух остатков с концевыми остатками, которые разделяют две водородные связи. Класс 3 начинается с трех остатков, а класс 4 - с четырех остатков. Класса 5 не существует, поскольку эта первичная шпилька уже определена в классе 1.Pi Эта классификационная схема не только учитывает различные степени водородной связи, но также кое-что говорит о биологическом поведении шпильки. Замена одной аминокислоты может разрушить определенную водородную связь, но не развернет шпильку и не изменит ее класс. С другой стороны, вставки и делеции аминокислот должны будут развернуть и преобразовать весь бета-прядь чтобы избежать бета-выпуклость во вторичной структуре. Это изменит класс шпильки в процессе. Поскольку замены являются наиболее распространенными аминокислотными мутациями, белок потенциально может подвергаться преобразованию, не влияя на функциональность бета-шпильки.[3]
Динамика складывания и переплета
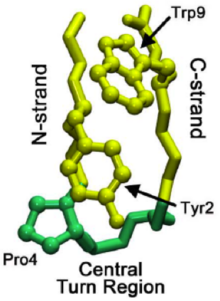

Понимание механизма складывания микродоменов может помочь пролить свет на структуру складывания всего белки. Исследования бета-шпильки под названием чигнолин (видеть Чигнолин на Proteopedia ) раскрыли пошаговый процесс складывания, который управляет складыванием бета-шпильки. Эта шпилька имеет особенности последовательности, сходные с более чем 13000 известных шпилек, и поэтому может служить более общей моделью образования бета-шпильки. Формирование области собственного поворота сигнализирует о начале каскада сворачивания, где родные Turn - это тот, который присутствует в окончательной складчатой структуре.
При сворачивании всех белков поворот может происходить не в области нативного поворота, а в С-цепи бета-шпильки. Этот поворот затем распространяется через C-цепь (бета-цепь, ведущая к C-концу), пока не достигнет области нативного поворота. Иногда остаток взаимодействия, ведущие к области собственного поворота, слишком сильны, вызывая обратное распространение. Однако, как только родной поворот действительно сформирован, взаимодействия между пролины и триптофан остатки (видны на изображении справа) в этой области помогают стабилизировать поворот, предотвращая «откат» или растворение.
Исследователи полагают, что повороты не возникают в N-цепи из-за повышенной жесткости (часто вызываемой пролином, ведущим к области нативного витка) и меньших вариантов конформации. Формирование начального витка происходит примерно за 1 мкс. Как только начальный поворот был установлен, были предложены два механизма относительно того, как складывается остальная часть бета-шпильки: гидрофобный коллапс с перестройками уровня боковой цепи или более общепринятый механизм, подобный застежке-молнии.[4]
Мотив петли β-шпильки можно найти во многих макромолекулярных белках. Однако маленькие и простые β-шпильки могут существовать и сами по себе. Чтобы ясно это увидеть, Pin1 Доменный белок показан слева в качестве примера.
Белки, богатые β-листами, также называемые доменами WW, функционируют путем присоединения к богатым пролином и / или фосфорилированным пептидам, опосредуя белок-белковые взаимодействия. "WW" относится к двум триптофан (W) остатки, которые сохраняются в последовательности и способствуют сворачиванию β-листов с образованием небольшого гидрофобного ядра.[5] Эти остатки триптофана показаны ниже (справа) красным цветом.
Этот фермент связывает свой лиганд через силы Ван дер Ваальса консервативных триптофанов и богатых пролином участков лиганда. Затем другие аминокислоты могут связываться с гидрофобным ядром структуры β-шпильки для обеспечения надежного связывания.[6]
Также часто можно найти пролин остатков внутри петлевой части β-шпильки, поскольку эта аминокислота является жесткой и способствует образованию «витка». Эти остатки пролина можно увидеть как красные боковые цепи на изображении WW-домена Pin1 ниже (слева).
 Pin1 wwdomain-богатые пролином петли |  Pin1 wwdomain-консервативные триптофаны |
Искусственно созданная бета-шпилька
Дизайн пептидов, которые принимают структуру β-шпильки (без опоры на связывание металлов, необычные аминокислоты или дисульфидные поперечные связи), значительно продвинулся вперед и позволил понять динамику белков. В отличие от α-спирали, β-шпильки не стабилизируются регулярным рисунком водородных связей. В результате ранние попытки требовали, по крайней мере, 20-30 аминокислотных остатков для достижения стабильных третичных складок β-шпилек. Однако этот нижний предел был снижен до 12 аминокислот из-за повышения стабильности за счет включения пар перекрестных цепей триптофан-триптофан. Было показано, что две пары триптофана, не связывающиеся с водородом, сцепляются в мотив, похожий на застежку-молнию, стабилизируя структуру β-шпильки, но при этом позволяя ей оставаться. вода. В ЯМР структура β-пептида триптофановой молнии (trpzip) демонстрирует стабилизирующий эффект благоприятных взаимодействий между соседними индол кольца.[7]

Синтез пептидов β-шпильки trpzip включает фотопереключатели, которые облегчают точный контроль за складыванием. Несколько аминокислот в свою очередь заменяются на азобензол, который можно заставить переключиться из транс-конформации в цис-конформацию светом с длиной волны 360 нм. Когда азобензольный фрагмент находится в цис-конформации, аминокислотные остатки правильно выравниваются, принимая образование β-шпильки. Однако транс-конформация не имеет правильной геометрии поворота для β-шпильки.[8] Это явление можно использовать для исследования конформационной динамики пептидов с помощью фемтосекундной абсорбционной спектроскопии.[8]
Рекомендации
- ^ Blanco, F.J .; Rivas, G .; Серрано, Л. (1994). «Короткий линейный пептид, который превращается в нативную стабильную бета-шпильку в водном растворе». Нат Структ Биол. 1 (9): 584–590. Дои:10.1038 / nsb0994-584. PMID 7634098. S2CID 35065527.
- ^ Sibanda, B.L .; Blundell, T.L .; Тортон, Дж. М. (1985). «Конформации бета-шпилек в белковых структурах». Природа (Лондон) 316 170–174.
- ^ а б Milner-White, J .; Поэт Р. (1986). «Четыре класса бета-шпилек в белках». Биохимический журнал 240 289–292.
- ^ а б Энемарк, Сорен; Курниаван, Николас А .; Раджагопалан, Радж (11 сентября 2012 г.). «β-шпилька формируется путем сворачивания из C-терминала: топологическое руководство ранней динамики сворачивания». Научные отчеты. 2: 649. Bibcode:2012НатСР ... 2Е.649Е. Дои:10.1038 / srep00649. ЧВК 3438464. PMID 22970341.
- ^ Ягер, Маркус; Дичонгкит, Сонгпон; Koepf, Эдвард К .; Нгуен, Хуби; Гао, Цзяньминь; Пауэрс, Эван Т .; Грюбеле, Мартин; Келли, Джеффри В. (2008). «Понимание механизма складывания β-листов с химической и биологической точки зрения». Биополимеры. 90 (6): 751–758. Дои:10.1002 / bip.21101. PMID 18844292.
- ^ Kay, B.K .; Williamson, M.P .; Судол, М. Важность того, чтобы быть пролином: взаимодействие богатых пролином мотивов в сигнальных белках с их родственными доменами. Журнал FASEB. 2000, 14, 231–241.
- ^ Кокран, Андреа Дж .; Скелтон, Николас Дж .; Старовасник, Мелисса А. (8 мая 2001 г.). «Триптофановые молнии: стабильные мономерные β-шпильки». Труды Национальной академии наук. 98 (10): 5578–5583. Bibcode:2001PNAS ... 98.5578C. Дои:10.1073 / pnas.091100898. ISSN 0027-8424. ЧВК 33255. PMID 11331745.
- ^ а б Дун, Шоу-Лян; Левенек, Маркус; Schrader, Tobias E .; Schreier, Wolfgang J .; Зинт, Вольфганг; Мородер, Луис; Реннер, Кристиан (23 января 2006 г.). «Фотоуправляемый пептид β-шпильки». Химия - Европейский журнал. 12 (4): 1114–1120. Дои:10.1002 / chem.200500986. ISSN 1521-3765. PMID 16294349.
