Карбапенем-устойчивые энтеробактерии - Carbapenem-resistant enterobacteriaceae
Carbapenem-устойчивые Enterobacteriaceae (CRE) или Enterobacteriaceae, продуцирующие карбапенемазу (CPE) находятся Грамотрицательные бактерии которые устойчивы к карбапенем класс антибиотики считается препараты последней инстанции для таких инфекций. Они устойчивы, потому что производят фермент называется карбапенемаза это отключает молекулу лекарства. Устойчивость может варьироваться от умеренной до тяжелой. Энтеробактерии обычные комменсалы и инфекционные агенты. Эксперты опасаются CRE как нового »супербактерия ".[1] Бактерии могут убить до половины пациентов, у которых инфекции кровотока.[2] Том Фриден, бывший глава Центры по контролю и профилактике заболеваний назвал CRE «кошмарными бактериями».[2][3] Примерами ферментов, обнаруженных в некоторых типах CRE, являются KPC (Клебсиелла пневмонии карбапенемаза) и NDM (металло-бета-лактамаза Нью-Дели). KPC и NDM - это ферменты, которые расщепляют карбапенемы и делают их неэффективными. Оба эти фермента, а также фермент VIM (Verona Integron-Mediated Metallo-β-lactamase) также описаны в Псевдомонады.[4]
Определение
Устойчивые к карбапенемам Enterobacteriaceae (CRE) были определены как устойчивые к карбапенемам и цефалоспоринам расширенного спектра действия. кишечная палочка, Enterobacter aerogenes, Энтеробактерные клоаки сложный, Клебсиелла пневмонии, или Клебсиелла окситока. Некоторые исключают устойчивость к эртапенему из определения.[5]
Факторы риска
Больницы являются первичными центрами передачи инфекций, вызванных CRE. До 75% госпитализаций, связанных с CRE, были из учреждений длительного ухода или переведены из другой больницы.[6] Неоптимальные методы обслуживания являются основной причиной передачи CRE. Это включает в себя неспособность должным образом очистить и продезинфицировать шкафы для лекарств, другие поверхности в палатах пациентов и портативное медицинское оборудование, такое как рентгеновские и ультразвуковые аппараты, которые используются как для пациентов с CRE, так и для пациентов без CRE.[7]До сих пор CRE в основном нозокомиальный инфекционные агенты. Почти все инфекции CRE возникают у людей, получающих значительную медицинскую помощь в больницах, учреждениях долгосрочной неотложной помощи или домах престарелых.[2] Независимые факторы риска инфицирования CRE включают использование бета-лактамные антибиотики и использование механическая вентиляция. Пациенты с сахарный диабет также было показано, что они подвержены повышенному риску заражения CRE-инфекциями.[7] По сравнению с другими госпитализированными пациентами, пациенты, поступившие из учреждений долгосрочной неотложной помощи (LTAC), имеют значительно более высокие показатели колонизации и инфицирования.[8] Другое многоцентровое исследование 2012 года показало, что более 30% пациентов, недавно подвергшихся воздействию LTAC, были колонизированы или инфицированы CRE.[9] Человек, восприимчивый к передаче CRE, с большей вероятностью будет женщиной, имеет большее количество парентеральное питание -дни (то есть дни, в которые человек получал питание через кровоток) и наличие значительного количества дней, в течение которых он дышал через вентилятор.[7]Инфекции, вызванные устойчивостью к карбапенемам Клебсиелла пневмонии были связаны с трансплантацией органов / стволовых клеток, искусственной вентиляцией легких, воздействием противомикробных препаратов и общей продолжительностью пребывания в больницах.[10]С наибольшей вероятностью заразятся устойчивые к карбапенему бактерии люди, уже получающие медицинскую помощь.[11] В исследовании, проведенном в медицинском центре Шиба, наблюдалась тенденция к ухудшению Коморбидность Чарльзона баллы у пациентов, которые приобрели CRKP во время пребывания в отделении интенсивной терапии.[12] К группе повышенного риска относятся пациенты, которым имплантируют орган или стволовые клетки, используют искусственную вентиляцию легких, или которым необходимо длительное пребывание в больнице вместе с воздействием противомикробных препаратов. В исследовании, проведенном в Сингапуре, приобретение устойчивых к эртапенему Enterobacteriaceae привело к приобретению CRE.[13] Воздействие антибиотиков, особенно фторхинолонов, и предшествующая госпитализация резко повысили риск приобретения устойчивых к карбапенемам бактерий. Это исследование показало, что приобретение устойчивости к карбапенему имеет значительно более высокий уровень смертности и более низкий клинический ответ по сравнению с приобретением устойчивости к эртапенему.
Бактериурия (также известная как инфекция мочевыводящих путей ), вызванные CRKp и CSKp, имеют схожие факторы риска. К ним относятся предшествующее использование антибиотиков, госпитализация в отделение интенсивной терапии, использование постоянного мочевого катетера и предыдущие инвазивные процедуры или операции. Ретроспективное исследование пациентов с инфекцией CRKp и CSKp подтвердило, что использование цефалоспорины (класс β-лактамных антибиотиков), применявшихся до инвазивных процедур, было выше у пациентов с инфекцией CRKp, что позволяет предположить, что это фактор риска.[14]
В трехлетнем исследовании было показано, что распространенность CRE пропорциональна продолжительности пребывания пациентов в этих больницах. Политика в отношении контактных мер предосторожности для пациентов, инфицированных или колонизированных грамотрицательными патогенами, также наблюдалась в больницах, сообщающих о снижении распространенности CRE.[15]
Одно тематическое исследование показало, что пациенты с ослабленным иммунным ответом особенно восприимчивы как к воздействию CRE, так и к инфекции. В одном исследовании пожилой пациент с острый лимфобластный лейкоз находясь на лечении в учреждении длительного лечения, заразился CRE-инфекцией.[16] Ее возраст и состояние в сочетании с окружающей средой и регулированием с помощью катетера и искусственной вентиляции легких способствовали более высокой восприимчивости. Это подчеркивает важность поиска источника бактерий, поскольку представители этого класса пациентов постоянно подвергаются риску заражения.[17] Инфекционный контроль и профилактика CRE должны быть основным направлением ведения пациентов из группы высокого риска.[нужна цитата ]
Другой важный фактор риска - это пребывание в стране с нерегулируемым распространением антибиотиков. В странах, где антибиотики продаются без рецепта, частота и распространенность CRE-инфекций были выше. Одно исследование из Японии показало, что 6,4% здоровых взрослых носили штаммы, продуцирующие БЛРС (в основном цефотаксимазу), по сравнению с 58,4% в Таиланде, где антибиотики доступны без рецепта и без рецепта. Египетская исследовательская группа обнаружила, что 63,3% здоровых взрослых были колонизированы.[9]
В феврале 2015 г. FDA сообщили о риске передачи, когда люди проходят гастроэнтерологическую процедуру, называемую эндоскопическая ретроградная холангиопанкреатография, где эндоскоп попадает в рот, проходит через желудок и заканчивается двенадцатиперстная кишка; при неполной дезинфекции устройство может передавать CRE от одного пациента к другому.[18] Сообщение FDA о безопасности пришло на следующий день после UCLA Health System, Лос-Анджелес, уведомили более 100 пациентов о том, что они могли быть инфицированы CRE во время эндоскопии в период с октября 2014 года по январь 2015 года.[19] FDA опубликовало первое уведомление об устройствах в 2009 году.[20]
Передача животными
Поскольку распространение CRE-бактерий от животных к человеку может стать проблемой в будущем, рекомендуется контролировать CRE у домашнего скота, а также у людей.[нужна цитата ]
Механизм
Функция антибиотика
В β-лактам Семейство молекул антибиотиков состоит из четырех групп: цефалоспорины, монобактам, пенициллины и карбапенемы.[21] Различные препараты, такие как эртапенем, имипенем, меропенем и дорипенем, относятся к классу карбапенемных антибиотиков.
Эти антибиотики имеют общую структуру и механизм действия. Они входят в периплазматическое пространство через порины, где они затем подавляют транспептидазы (которые также известны как пенициллин-связывающие белки (PBP)), ферменты, которые способствуют сшиванию пептидов во время синтеза клеточной стенки. Их связывание с активным сайтом PBP частично облегчается их общей структурой, которая подобна структуре D-аланил-D-аланина. D-аланил-D-аланин представляет собой остаток на субъединице пептида NAM, участвующий в создании пептидогликан.[21] Карбапенем ковалентно связывается с PBP, в результате чего транспептидазы необратимо теряют свою каталитическую активность.[21] Ингибирование транспептидаз предотвращает образование поперечных связей между полимерами пептидогликана и вызывает накопление предшественников пептидогликана. Новообразованный пептидогликан ослаблен из-за отсутствия перекрестных связей. автолизины, которые действуют как лизоцимы и расщепляют гликозидные и пептидные связи пептидогликана в периплазме, ослабляют клеточную стенку и приводят к осмотическому разрыву бактериальной клетки.
Уникальным качеством карбапенемов является их устойчивость к гидролизу бактериальной плазмидой и хромосомно-опосредованными β-лактамазами расширенного спектра действия (БЛРС).[22]
Карбапенем сопротивление
В целом карбапенем, β-лактамный антибиотик, воздействует на клетки, ингибируя транспептидазы (пенициллин-связывающие белки). Это предотвращает синтез пептидогликан, необходимый структурный компонент, приводящий к лизису клеток. Устойчивость к карбапенему среди Грамотрицательные бактерии в целом (т. е. включая бактерии, отличные от Enterobacteriaceae) могут передаваться через несколько механизмов.
- Активный транспорт карбапенемных препаратов из клетки, усиленный препарат излияние наблюдается у некоторых устойчивых видов.[нужна цитата ]
- Один из механизмов устойчивости - мутация или потеря внешней мембраны. порины, предотвращая попадание антибиотиков в клетки.[23] Изменения в гене белка порина вызывают сдвиг рамки, изменяя структуру и функцию порина.[23] Изменения в белке порина препятствуют диффузии карбапенема и других антибиотиков в периплазму.[24] Бактерии, экспрессирующие плазмиды β-лактамазы расширенного спектра (БЛРС) может стать устойчивым к карбапенемам, если последовательность вставки или четырехнуклеотидная дупликация присутствует в хромосомных генах пориновых белков внешней мембраны.[23] Клебсиелла пневмонии был связан с отсутствием пориновых белков внешней мембраны, OmpK35 и OmpK36. Потеря поринов OmpK36 может быть связана с точечными мутациями, которые приводят к преждевременному прекращению трансляции, что приводит к усеченному и, следовательно, нефункциональному белку.[25] Эти белки внешней мембраны участвуют в переносе антимикробного генетического материала в клетке. Потеря либо OmpK35 и OmpK36, либо только OmpK36[25] приводит к устойчивости к карбапенемам. В Клебсиелла пневмонииотсутствие OmpK35 или OmpK36 ведет к устойчивости к карбапенему, но при отсутствии обоих белков присутствует высокий уровень устойчивости.[26] Наблюдаемое увеличение в 32–64 раза минимальные ингибирующие концентрации возникает для карбапенемов, когда оба белка не экспрессируются.[26]
- CRE продуцируют карбапенемазы, форму β-лактамазы.[25] Эти ферменты расщепляют β-лактамное кольцо, важный компонент β-лактамных антибиотиков, которые распознаются и связываются с PBP. Карбапенемазы делятся на различные классы в зависимости от структуры фермента и механизма, с помощью которого они гидролизуют β-лактамное кольцо. Две широкие категории карбапенемаз - это серин-карбопенемазы, содержащие серин в активном центре, и металлокарбапенемазы, содержащие цинк в активном центре. Карбапенемазы класса А представляют собой сериновые карбапенемазы и кодируются либо на хромосоме бактерий, либо на плазмиде. Серин в положении 70 в активном центре этого класса ферментов необходим для гидролиза β-лактамов. Карбапенемазы класса D, также называемые β-лактамазами OXA, являются сериновыми β-лактамазами. Они кодируются плазмидами и содержат большую вариабельность аминокислотной последовательности. Механизм устойчивости карбапенемаз класса D обусловлен образованием промежуточного ацила при разрыве β-лактамного кольца. Карбапенемазы класса B представляют собой металлолактамазы и требуют цинка в активном центре для гидролиза.[27][28][29]
- Клинический изолировать из Кишечная палочка из образца мокроты пациента, поступившего в Пекин больница приобрела устойчивость к карбапенему в результате ранее не наблюдавшихся мутаций. Это связано с мутацией регуляторный ген марр и выражение обычно непереведено мембранные порины; обе мутации показали влияние на способность этого штамма Кишечная палочка противостоять карбапенемам. Штамму не хватало белки внешней мембраны OmpF и OmpC и продемонстрировали повышенную экспрессию мультилекарственного соединения. откачивающий насос, но не производил карбапенемазу.[30][31]
CR Синегнойная палочка обычно присутствует в отделениях интенсивной терапии и может привести к опасным инфекциям.[32] В больницах Таиланда из 261 образца с множественной лекарственной устойчивостью, собранных P. aeruginosa (не входящие в состав Enterobacteriaceae) 71,65% были устойчивы к карбапенемам.[32]
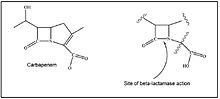
Передача между бактериями
Грамотрицательные бактерии могут развивать и передавать устойчивость к β-лактамам (включая устойчивость к карбапенему) разными способами. Они могут генерировать новые β-лактамазы расширенного спектра (ESBL) из существующего спектра плазмид-опосредованных β-лактамаз за счет замены аминокислот. Они могут приобретать гены, кодирующие ESBL, от бактерий окружающей среды. Они могут увеличивать экспрессию генов β-лактамаз, кодируемых хромосомами (бла гены) за счет модификаций регуляторных генов и промоторных последовательностей. Они могут мобилизовать бла гены через интегроны или горизонтальный перенос геномных островков в другие грамотрицательные виды и штаммы.[33][34] Они могут распространять плазмид-опосредованные карбапенемазы. Наконец, они могут снижать или даже подавлять экспрессию генов порина.[35]
В устойчивость к карбапенемам вовлечены три основных класса ферментов: карбапенемазы класса A, металло-β-лактамазы класса B (MBL) и β-лактамазы класса D (OXA). Четыре известные группы карбапенемаз класса A: SME (три типа, связанные с S. marcescens), IMI (присутствует в E. cloacae), GES (на данный момент найдено 16 вариантов P. aeruginosa преимущественно, но также встречается в K. pneumoniae и Кишечная палочка) и KPC (10 типов K. pneumoniae карбапенемаза).[35] В Медицинском центре UVA был обнаружен механизм передачи KPC-зависимой устойчивости к карбапенемам при передаче плазмиды, несущей транспозон (Tn4401), которая содержит ген KPC (блаКПК), к нескольким бактериям, включая Энтеробактерные клоаки, Клебсиелла окситока, Кишечная палочка, и Citrobacter freundii.[36] Металло-β-лактамазы (MBL) класса B обнаруживаются в основном у грамотрицательных бактерий и бактерий окружающей среды. Подклассы ферментов MBL - это B1, B2 и B3. MBL обладают разнообразными ферментативными функциями и обладают способностью гидролизовать β-лактамные антибиотики. Β-лактамазы класса D (OXA), которые гидролизуют оксациллин, представляют собой хороший пример разнообразия механизмов, которые можно использовать для передачи устойчивости. В блаOXA гены, кодирующие β-лактамазы OXA, обнаруживаются как в хромосомах, так и в плазмидах, и их естественный резервуар - бактерии окружающей среды и глубоководная микрофлора. Было показано, что вставки вблизи этих генов увеличивают силу их промоторов и повышают устойчивость. Благодаря этим характеристикам, в частности, произошло широкое географическое распространение устойчивости к карбапенемазе OXA.[35]
Облегченное распространение устойчивости к карбапенему, по-видимому, имеет множественное происхождение и многократное проникновение в Великобританию бактерий с блаOXA-48 ген путем горизонтального переноса аналогичных плазмид на pOXA-48a. Недавнее исследование, проведенное в Великобритании, изучило 26 изолятов Enterobacteriaceae, состоящих из разнообразного набора типов последовательностей (ST) K. pneumoniae, Кишечная палочка, и Энтеробактерные клоаки продуцируя OXA-48-подобные карбапенемазы. Их выводы включали:
- 25 из 26 штаммов имели блаOXA-48 ген.
- 21 из этих изолятов содержал плазмиды устойчивости, которые можно было переносить конъюгацией; 20 из этих трансформантов имели три функциональных гена, repA, трау, и parA обнаружен в pOXA-48a.
- В ST38 Кишечная палочка, трансконъюгантов OXA-48 обнаружено не было, а только parA ген.
- Индийский штамм К. пневмония имел плазмиду, кодирующую OXA-181 (которая имела более высокую устойчивость к карбапенему), также не могла быть перенесена путем конъюгации и не имела ни одного из трех функциональных генов, обнаруженных в pOXA-48a.[37]
Грамотрицательные бактерии
Везикулы наружной мембраны (OMV), которые могут переносить ДНК между бактериальными клетками, продуцируются метаболически активными бактериальными клетками, и OMV не являются результатом лизиса или гибели клеток. Патогенные штаммы могут производить везикул примерно в 10-25 раз больше, чем непатогенные штаммы, что делает это очень важным для передачи устойчивости к карбапенемам.[38] OMV защищают плазмиды от внеклеточного переваривания нуклеазами, которые могут быть обнаружены в окружающей среде, тем самым благоприятствуя горизонтальный перенос генов.[38]
Лабораторный анализ
Метод чашки с агаром
Видны различия в средах, используемых для посева. Во многих исследованиях используются среды с содержанием имипенема от 1 до 2 мг / л. Однако бактерии, которые продуцируют OXA-48 или OXA-181, приводят к низкому уровню устойчивости, который не может быть эффективно обнаружен из-за высокой концентрации.[39]Поэтому в более современных средах для скрининга используется бульон, содержащий 0,5–1 мг / л. имипенем или 0,5 мг / л эртапенем.
К недостаткам этого подхода можно отнести задержку результатов инокуляции и невозможность определить тип карбапенемазы.
Дисковый диффузионный метод
Метод дисковой диффузии может использоваться больничными лабораториями для выявления CRE. В этом методе диски с антибиотиками помещают на чашки с агаром Мюллера-Хинтона, которые уже были инокулированы штаммом образца. Затем планшеты инкубируют в течение ночи при 37 ° C. После инкубации измеряются зоны ингибирования, окружающие диски с различными антибиотиками, и сравниваются с рекомендациями Института клинических и лабораторных стандартов. Идентификация KPC, MBL и OXA может быть достигнута путем демонстрации синергического ингибирования с фенилбороновой кислотой, EDTA или ни с одним, соответственно.[40]
В проведенном в Таиланде исследовании CRE в больничных условиях устойчивость к карбапенемам была определена как любой штамм, проявляющий устойчивость по крайней мере к одному из трех протестированных карбапенемных антибиотиков.[32]
Метод ПЦР
В настоящее время разрабатываются методики скрининга на основе ПЦР для ряда генов, ответственных за устойчивость. Они ускоряют обнаружение и позволяют легко различать гены карбапенамаз, иногда в мультиплексном формате. Стоимость ПЦР-тестирования снижается, а надежность молекулярных тестов больше связана с наличием генов и экспрессией генов для производства соответствующей карбапенамазы. Вложенная произвольная ПЦР (ARB-PCR) использовалась во время вспышки CRE 2007 г. в Медицинском центре Университета Вирджинии для определения специфических бла Плазмида KPC участвует в передаче инфекции, и исследователи предполагают, что ARB-PCR может также использоваться для идентификации других методов распространения CRE.[36]
MALDI-TOF MS
Другое исследование использовало матричная лазерная десорбционная ионизация -пролетная масс-спектрометрия (MALDI-TOF MS) для определения паттернов устойчивости у бактерий из свежеположительных культур крови.[нужна цитата ] MALDI-TOF MS может обнаруживать изменения отношения массы к заряду. Бактерии, устойчивые к кабапенемам, часто используют β-лактамазы, которые физически нарушают структуру β-лактамных антибиотиков. Поскольку это вызывает изменение массы антибиотика, устойчивые бактерии обнаруживаются с помощью MALDI-TOF MS. Принятые клинические тесты часто требуют инкубации в течение ночи перед считыванием результата, но MALDI-TOF MS может дать результаты всего за 4–5 часов.[нужна цитата ]
MALDI-TOF не может обнаруживать устойчивые бактерии, которые физически не разрушают β-лактамный антибиотик, то есть там, где не происходит изменения массы. Следовательно, этот метод лучше всего подходит в качестве первого скрининга для пациентов, поступающих в больницу, но после него следует проводить вторичное обследование.[41]
Профилактика
Исследователи обнаружили экологические резервуары бактерий CRE в стоках и стоках интенсивной терапии. Несмотря на многочисленные попытки стерилизовать эти раковины и стоки с помощью моющих средств и пара, персоналу больницы не удалось избавиться от CRE. Из-за устойчивости бактерий к мерам очистки персоналу следует соблюдать особые меры предосторожности при поддержании стерильной среды в больницах, еще не инфицированных CRE-устойчивыми бактериями.[42]
Основной путь передачи - через раковины, поэтому персоналу следует соблюдать особые меры предосторожности при поддержании стерильных условий. Больницы могут снизить передачу, создав раковины с дизайном, который может уменьшить задний брызг. Еще один способ уменьшить передачу от раковины к раковине - установить в каждой комнате щетки для раковины, которые будут использоваться только для очистки этой индивидуальной раковины. Персонал больницы должен быть обучен тому, чтобы никогда не сбрасывать клинические отходы в раковину в палатах. Больница в Мельбурне, Австралия, реализовала аналогичные стратегии, чтобы снизить передачу и предотвратить дальнейшее заражение большего числа пациентов в отделении интенсивной терапии. Вооруженные знанием своего статуса как места передачи CRE, больницы должны проявлять особую осторожность для мониторинга вспышек CRE в своих палатах. Эффективное и точное определение CRE - это первый шаг. Энтеробактерии чаще всего встречаются в кишечной флоре. Таким образом, использование стула и ректальных мазков является наиболее надежным методом определения резистентности.[42]
Для CRE под Medicare или Медикейд, что затрудняет отслеживание на национальном уровне в США. Еще одна проблема, с которой сталкиваются усилия по контролю за передачей инфекции, заключается в том, что, хотя учреждения долгосрочного ухода в значительной степени указываются как основные центры заболеваемости, амплификации и распространения CRE, исследования, которые контролировали эту передачу, обнаружили, что CRE распространяется в других аффилированных больницах, что указывает на то, что учреждения долгосрочной неотложной помощи, вероятно, не являются единственными виновниками распространения CRE и других организмов с множественной лекарственной устойчивостью.[7]
Один из эффективных методов - это скрининг и изоляция поступающих пациентов от других учреждений, а также возобновление акцента на мытье рук. Никаких новых лекарств для бактерий не разрабатывается, а быстрая адаптация бактерий к новым лекарствам делает вложения в их разработку невыгодными, поскольку новое лекарство быстро станет бесполезным.[1] Исследования показали, что заболеваемость и распространенность CRE можно снизить, применяя целенаправленные меры, включая усиление гигиенических мер и стерилизацию оборудования, даже в группах населения, где распространенность инфекции превышает 50% пациентов.[7] Однако дополнительная очистка окружающей среды для управления трансмиссией не была подтверждена контролируемыми испытаниями.[43] Участие местных и национальных органов общественного здравоохранения, вероятно, будет иметь решающее значение для обеспечения более широкой и устойчивой реализации этих мер.
Профилактика является высшим приоритетом для сокращения передачи CRE от человека к человеку. Это особенно верно, поскольку после развития устойчивости к карбапенему доступны ограниченные варианты лечения. В большинстве современных исследований содержится призыв к скоординированному, многогранному подходу к профилактике и сдерживанию инфекций, а Центры по контролю и профилактике заболеваний выпустили предварительные рекомендации по контролю передачи CRE.[44] Эксперты выступают за проактивный подход, основанный на убеждении, что наиболее рентабельным будет бороться с проблемой до того, как она будет установлена. Однако, когда непосредственные финансовые и кадровые ресурсы ограничены, администраторы здравоохранения могут быть вынуждены реагировать, стремясь сократить любую дальнейшую передачу.[45]
Хотя существует консенсус в отношении необходимости протоколов профилактики, методы инфекционного контроля часто различаются в разных больницах, даже в пределах близкого географического района. При обследовании 15 больниц в районе Торонто во многих больницах использовались различные комбинации основных методов инфекционного контроля. В 15 больницах наблюдались восемь различных практик, некоторые из которых включены в последнюю публикацию руководств Агентство общественного здравоохранения Канады.[46] Некоторые из этих рекомендаций включают лабораторные исследования, активное наблюдение, скрининг (ректальный мазок, посев мочи), гигиену рук, средства индивидуальной защиты, экологическая очистка, утилизация отходов прачечной и изоляция с помощью специального оборудования и медперсонала. Однако только в пяти больницах есть письменные инструкции, описывающие, как реагировать на вспышку.[47] Многие инициативы в области общественного здравоохранения движутся к более стандартизированному подходу на нескольких уровнях: среди местных учреждений (особенно для долгосрочной и неотложной помощи), региональных больниц, национальных учреждений и мировой практики.[нужна цитата ] Стандартизированный подход к профилактике может помочь более эффективно снизить возникновение CRE.[нужна цитата ]
В Медицинском центре Каплан в Израиле был реализован план инфекционного контроля для борьбы со вспышкой в больнице устойчивых к карбапенемам K. pneumoniae. Комплексный план включал в себя руководство по группированию пациентов в разных местах, очистка 1000 ppm. гипохлорит, скрининг изолятов из ректальных мазков и распространение инструкций по обучению, лекций для всего медицинского персонала и обучение. Больница также внедрила автоматизированную компьютерную систему, которая обновляла карты пациентов, когда сообщалось о новых случаях, были ли пациенты носителями и какие меры предосторожности следует принимать при работе с такими пациентами. Этот план оценивался в квазиэкспериментальном исследовании по частоте клинических случаев, уровню перекрестной инфекции и скорости скрининга на носительство у госпитализированных пациентов с повышенным риском носительства. В исследовании отмечалось 16-кратное снижение частоты резистентных K. pneumoniae, которая выдерживалась 30 месяцев. Этот план может стать моделью для других больниц по сдерживанию вспышек устойчивых к карбапенемам бактерий.[48] Сокращение использования ненужных инвазивных устройств, включая мочевые катетеры, может помочь снизить передачу CRE.[7]
Несколько методов были протестированы на предмет их эффективности в улучшении тщательной гигиены окружающей среды в отделениях интенсивной терапии. Исследование, проведенное в 2010 году на 3532 поверхностях из окружающей среды высокого риска в 260 палатах интенсивной терапии в 27 больницах неотложной помощи (ОИТ), оценило соответствие этих поверхностей базовым стандартам очистки. Было обнаружено, что только 49,5% поверхностей объектов высокого риска соответствуют этому базовому критерию. Наименее очищаемыми объектами были выключатели освещения в ванных комнатах, дверные ручки и средства для мытья посуды. Существенные улучшения в уборке помещений интенсивной терапии были достигнуты за счет структурированного подхода, который включал простой, объективный метод определения местоположения на поверхности и многократную обратную связь с персоналом окружающей среды. Конкретные методы включали внедрение процесса объективной оценки, обучение персонала окружающей среде, программную обратную связь и непрерывное обучение для минимизации распространения инфекций, связанных с больницей. Авторы отметили улучшение тщательности очистки на 71% от исходного уровня для всей группы задействованных больниц.[49]
Лечение
Фосфомицин
Несколько противомикробных препаратов были протестированы на предмет эффективного лечения CRE. Фосфомицин является противомикробным агентом, который ингибирует UDP-N-ацетилглюкозамин енолпирувилтрансфераза (MurA), который катализирует одну из первых стадий синтеза клеточной стенки бактерий и эффективен против грамотрицательных и положительных аэробных бактерий, таких как CRE. Метаанализ 17 исследований, изучающих клиническую эффективность фосфомицина в четырех штаммах Enterobacteriaceae с множественной лекарственной устойчивостью, выявил 11, в которых сообщалось, что более 90% бактериальных изолятов были чувствительны к фосфомицину.
Повышенный уровень антимикробной активности фосфомицина можно объяснить тем фактом, что устойчивость к этому антибиотику у Enterobacteriaceae кодируется хромосомами, а не опосредуется плазмидами. Это приводит к снижению способности бактерий к выживанию. Бактерии, которые от природы устойчивы к фосфомицину, менее устойчивы и менее патогенны.[50]
Тигециклин
Тигециклин, входящий в группу глицилциклиновых антибиотиков, оказался эффективным средством против Enterobacteriaceae, которые обычно проявляются тетрациклин сопротивление,[51] потому что тигециклин имеет более высокое сродство связывания с рибосомными участками, чем тетрациклин.[нужна цитата ] Тигециклин способен убивать почти все БЛРС и вызывать множественную лекарственную устойчивость (МЛУ). Кишечная палочка изоляты и подавляющее большинство изолятов ESBL и MDR Клебсиелла виды.[нужна цитата ]
Обзор 42 исследований 2008 г. in vitro чувствительность бактерий к тигециклину показала, что МЛУ K. pneumoniae и Кишечная палочка, включая те, которые были устойчивы к карбапенему, были восприимчивы более чем в 90% случаев. Ограниченное количество пациентов лечилось тигециклином, но FDA одобрило его в некоторых случаях вместе с другими лекарствами. Ограниченное количество пациентов указывает на то, что необходимы дополнительные исследования для определения общей клинической эффективности.[52]
Хотя тигециклин является одной из первых линий защиты от изолятов, продуцирующих карбапенемазу, при применении тигециклина имели место отрицательные клинические исходы. Инфекции мочевыводящих путей и первичные инфекции крови могут сделать тигециклин неэффективным, поскольку он имеет ограниченное проникновение и быструю диффузию в ткани после внутривенного введения, соответственно.[53]
Другие антибиотики
Альтернативы фосфомицину включают: нитрофурантоин, пивмециллинам и коамоксиклав при пероральном лечении инфекций мочевыводящих путей, связанных с бета-лактамазой расширенного спектра действия.[50]
В отдельном исследовании CRE лечили колистин, амикацин, и тигециклин, и подчеркивает важность использования гентамицин у пациентов, проходящих химиотерапию или процедуры лечения стволовыми клетками.[16]Хотя колистин показал многообещающую активность в отношении изолятов, продуцирующих карбапенемазу, более свежие данные свидетельствуют о том, что резистентность к нему уже проявляется, и вскоре он станет неэффективным.[53]
Использование другого антибиотика одновременно с карбапенемом может помочь предотвратить развитие устойчивости к карбапенему. Одно конкретное исследование показало более высокий уровень устойчивости к карбапенему при использовании одного меропенема по сравнению с комбинированной терапией моксифлоксацином.[54]
Кроме того, были протестированы несколько препаратов для оценки их эффективности против инфекций CRE. В пробирке исследования показали, что рифампицин обладает синергетическим действием против устойчивых к карбапенемам Кишечная палочка и K. pneumoniae. Однако необходимы дополнительные данные, чтобы определить, эффективен ли рифампицин в клинических условиях.[53]
Несколько новых агентов находятся в разработке. Основное внимание ученых сосредоточено на новых ингибиторах β-лактамаз, действующих против карбапенемаз. Некоторые из них включают сульфоны MK-7655, NXL104 и 6-алкилиденепенама. Точный способ их воздействия на карбапенемазы неизвестен. Другой экспериментальный агент с активностью против CRE - это эравациклин.[53]
Эпидемиология
До 1992 года CRE были относительно редки в США. По данным Национальной службы внутрибольничных инфекций, в период с 1986 по 1990 год только 2,3% из 1825 отобранных изолятов Enterobacteriaceae оказались устойчивыми.[10]
По данным Центров США по контролю за заболеваниями, CRE, вырабатывающий наиболее распространенный в 2001 году тип фермента, разрушающего карбапенем, был впервые обнаружен в больнице Северной Каролины в 1996 году.[55][56] С тех пор они были обнаружены в медицинских учреждениях еще 41 штата. В 2012 году 3% пациентов в отделениях интенсивной терапии в районе Чикаго имели CRE.[1] Те же данные[который? ] указали на 30% уровень колонизации в учреждениях длительного ухода (например, в домах престарелых), где пациенты не симптоматический. Только за первую половину 2012 года почти 200 больниц и пунктов долгосрочной неотложной помощи оказали помощь как минимум одному пациенту, инфицированному этими бактериями.[2]
CRE становятся все более распространенными в США. Программа ежегодного сбора информации о тестировании на чувствительность к меропенему отметила, что устойчивость в K. pneumoniae только с 0,6% в 2004 г. до 5,6% в 2008 г.[10] Первая вспышка, вызванная устойчивостью к колистину и карбапенемам K. pneumoniae (CRKP) в США был обнаружен в Детройт, Штат Мичиган, в 2009 году с участием трех различных медицинских учреждений.[57] В ходе активного эпиднадзора в семи штатах США в течение двух лет общая заболеваемость CRE составила 2,93 на 100000 населения. В Джорджии и Мэриленде заболеваемость с поправкой на возраст и расу была значительно выше прогнозируемой.[5]
Увеличение CRE не ограничивается США. К 2011 году CRE был зарегистрирован как минимум в 22 странах.[11] В период с 2009 по 2012 год было зарегистрировано 10 случаев CRE-инфекций у пациентов отделения интенсивной терапии в больнице Мельбурна, Австралия.[42]
Некоторые случаи CRE связаны с получением медицинской помощи в США. Штаммы, обнаруженные в Израиле, имели генетическое сходство со штаммами из США.[42] Станции для мытья рук в больницах были признаны экологическими резервуарами для CRE после проверки всех участков с повышенной влажностью, включая раковины, фонтаны с водой и льдогенераторы. Основными резервуарами CRE были приемники ОИТ, а передача от приемника к приемнику объяснялась неправильными методами очистки. Штаммы CRE в раковинах и штаммы, заражающие пациентов интенсивной терапии, были идентичны согласно генетическому анализу. Пациенты из группы риска заражались в условиях больницы.[42]
Смертность
Устойчивость к CRE зависит от ряда факторов, таких как состояние здоровья пациента, перенесла ли он недавно трансплантат, риск коинфекции и использование нескольких антибиотиков.[58] Карбапенем минимальные ингибирующие концентрации (МПК) результаты могут быть более предсказуемыми для клинических исходов у пациентов, чем текущая категориальная классификация МПК, перечисленных как чувствительные, промежуточные или устойчивые.[59] Исследование было направлено на определение порога госпитальной смертности от всех причин для МИК карбапенема, скорректированных с учетом факторов риска. Другой целью было определить, существует ли аналогичная точка разрыва для косвенных результатов, таких как время до смерти и продолжительность пребывания выживших после заражения. Был включен 71 пациент, из которых 52 выжили и 19 умерли. Классификационный и регрессионный древовидный анализ определил разделение MIC организмов между 2 и 4 мг / л и предсказал различия в смертности (16,1% для 2 мг / л против 76,9% для 4 мг / л). В логистическая регрессия с учетом мешающих факторов, каждое удвоение МИК имипенема удваивало вероятность смерти. Эта классификационная схема правильно предсказала 82,6% случаев. Пациенты были соответственно стратифицированы по МПК ≤2 мг / л (58 пациентов) и ≥4 мг / л (13 пациентов). Пациенты в группе с МПК ≥4 мг / л чаще болели. Вторичные результаты также были одинаковыми между группами. Пациенты с микроорганизмами с МПК ≥4 мг / л имели худшие результаты, чем пациенты с изолятами с МПК ≤2 мг / л.[59]
В Пресвитерианская больница Нью-Йорка, часть Медицинский центр Колумбийского университета в Нью-Йорке, штат Нью-Йорк, было проведено исследование значительного повышения устойчивости к карбапенему у K. pneumoniae с 1999 по 2007 год. После положительного посева крови пациента общая смертность составила 23% через 7 дней, 42% через 30 дней и 60% к концу госпитализации. Общая госпитальная летальность составила 48%.[60]
В Медицинский центр Сорока, израильский университетский госпиталь, в период с октября 2005 г. по октябрь 2008 г. было проведено исследование для определения уровня прямой смертности, связанной с устойчивостью к карбапенемам. K. pneumoniae инфекции кровотока. Общий уровень смертности среди резистентных бактериемия составила 71,9%, а относительный уровень смертности был определен как 50% с доверительным интервалом 95%. Общий уровень смертности для контрольных субъектов составил 21,9%. В результате исследования Медицинский центр Сорока начал интенсивную программу, направленную на предотвращение распространения устойчивых к карбапенемам K. pneumoniae.[61]
Ретроспективное исследование 2013 года в Медицинском центре Шаарей Цедек пациентов с инфекциями мочевыводящих путей (бактериурия), вызванными устойчивостью к карбапенемам. Клебсиелла пневмонии (CRKp) не выявили статистически значимых различий в показателях смертности от пациентов с бактериурией, вызванной чувствительными к карбапенемам K. pneumoniae (ЦСКп). Уровень смертности 29% наблюдался у пациентов с инфекцией CRKp по сравнению с уровнем смертности 25% у пациентов с инфекциями CSKp, которые продуцировали бета-лактамазу расширенного спектра (ESBL). Оба показателя смертности были значительно выше, чем у пациентов с лекарственной чувствительностью. уросепсис.[14] Большинство пациентов в исследовании страдали другими заболеваниями, в том числе: слабоумие, иммунный компромисс, почечная недостаточность, или сахарный диабет. Основным фактором риска смерти, обнаруженным в ходе исследования, был прикован к постели, что значительно увеличивало вероятность смерти. Это говорит о том, что смерть наступила не по причине бактериурии. Общая продолжительность госпитализации была несколько больше у пациентов с инфекцией CRKp (28 ± 33 дней по сравнению с 22 ± 28 днями для пациентов с инфекцией CSKp).[14]
В исследовании случай-контроль с участием 99 пациентов по сравнению с 99 контрольной группой при Больница Mount Sinai (Манхэттен), учебный госпиталь третичного уровня на 1171 койку, 38% пациентов с хроническим лечением CRE умерли от K. pneumoniae инфекция. У пациентов были факторы риска, включая диабет, ВИЧ-инфекцию, сердечные заболевания, заболевания печени, хроническая болезнь почек, один был реципиентом трансплантата. 72% пациентов, выписанных из больницы с CRE, были повторно госпитализированы в течение 90 дней.[62] Исследование 2008 года на горе Синай выявило результаты, связанные с устойчивостью к карбапенемам. Клебсиелла пневмонии инфекции, при которых пациенты, нуждающиеся в трансплантации органов или стволовых клеток, искусственной вентиляции легких, длительной госпитализации или предшествующем лечении карбапенемами, имели повышенную вероятность инфицирования устойчивыми к карбапенемам K. pneumoniae. Комбинация антибиотиков работала для лечения инфекции, и выживаемость инфицированных пациентов увеличивалась, когда очаг инфекции был удален.[63]
Инфекции CRE могут развиться примерно через 12 дней после трансплантации печени, и 18% этих пациентов умерли через год после трансплантации в исследовании 2012 года.[64]
Последствия для общественного здравоохранения
Выживание бактерий на поверхностях
Исследования показали, что бактерии на поверхностях из нержавеющей стали сохраняют свою жизнеспособность при комнатной температуре. В конкретном исследовании нержавеющая сталь была модифицирована 107 КОЕ / см2 Кишечная палочка и К. пневмония, содержащий blaCTX-M-15 и блаНДМ-1 (гены устойчивости к антибиотикам) соответственно. Тридцать дней спустя (при комнатной температуре, 22˚С), 104 жизнеспособные клетки остались; и через 100 дней 100 КОЕ / см2 из Кишечная палочка остался.[65]
Напротив, на медь и поверхности медных сплавов, можно наблюдать быструю гибель устойчивых к антибиотикам бактериальных штаммов, а также разрушение плазмидной и геномной ДНК. Исследования показывают, что воздействие на сухие медные поверхности подавляет дыхание и рост продуцентов, высвобождая ионы меди.[65]
Повышенный горизонтальный перенос генов (HGT) наблюдается одновременно с жизнеспособностью клеток на поверхностях из нержавеющей стали. ГПГ - один из основных факторов, ответственных за создание устойчивости бактерий к антибиотикам. Это говорит о том, что немедленная дезактивация поверхностей важна для предотвращения распространения генов устойчивости к антибиотикам. Также было показано, что горизонтальный перенос генов устойчивых к антибиотикам β-лактамаз не происходит на антимикробных медных поверхностях. Поскольку медные поверхности разрушают голую ДНК (и плазмидную ДНК в устойчивых к антибиотикам Кишечная палочка и К. пневмония), медные поверхности остановили бы HGT.[65]
Было продемонстрировано, что горизонтальный перенос генов легко происходит на сухих поверхностях, таких как нержавеющая сталь, но не на поверхностях из меди и медных сплавов. Скорость бактериальной гибели увеличивалась пропорционально процентному содержанию меди на поверхности медного сплава. Это может быть очень важно в будущих клинических условиях и в условиях сообщества, поскольку увеличение использования меди в оборудовании больничных палат может помочь значительно снизить распространение устойчивой к антибиотикам инфекции и горизонтальный перенос генов этой устойчивости к антибиотикам.[65]
Смотрите также
использованная литература
- ^ а б c Питер Эйслер (29 ноября 2012 г.). «Смертельные супербактерии вторгаются в медицинские учреждения США». USA Today. Получено 1 декабря, 2012.
- ^ а б c d «CDC: меры, необходимые сейчас, чтобы остановить распространение смертоносных бактерий: данные показывают, что все больше стационарных пациентов страдают от инфекций, вызванных бактериями, устойчивыми ко всем или почти ко всем антибиотикам» (Пресс-релиз). Центры по контролю за заболеваниями. 5 марта 2013 г.. Получено 5 марта, 2013.
Только за первую половину 2012 года почти 200 больниц и отделений долгосрочной неотложной помощи оказали помощь как минимум одному пациенту, инфицированному этими бактериями.
- ^ Бреслоу, Джейсон (8 января 2014 г.). "Вспышка кошмарных бактерий" Иллинойса "вызывает тревогу". PBS.org. Получено 24 апреля 2014.
- ^ Центры по контролю и профилактике заболеваний. (2016, 1 марта). Карбапенем-устойчивые Enterobacteriaceae в медицинских учреждениях. Полученное из https://www.cdc.gov/hai/organisms/cre/index.html
- ^ а б Guh Alice Y .; Bulens Sandra N .; Му Йи; Джейкоб Джесси Т .; Рино Джессика; и другие. (2015). «Эпидемиология устойчивых к карбапенемам Enterobacteriaceae в 7 сообществах США, 2012-2013 гг.». JAMA. 314 (14): 1479–87. Дои:10.1001 / jama.2015.12480. ЧВК 6492240. PMID 26436831.
- ^ Perez, F; Ван Дуин, Д. (2013). «Карбапенем-устойчивые Enterobacteriaceae: угроза для наших наиболее уязвимых пациентов». Кливлендский медицинский журнал клиники. 80 (4): 225–33. Дои:10.3949 / ccjm.80a.12182. ЧВК 3960994. PMID 23547093.
- ^ а б c d е ж Читнис, А.С.; Карутерс, П.С.; Рао, AK; Баранина, Дж; Lurvey, R; Бо де Рошар, V; Китчел, Б; Cancio, M; и другие. (2012). «Вспышка устойчивых к карбапенемам энтеробактерий в стационаре для долгосрочной неотложной помощи: устойчивое сокращение передачи посредством активного эпиднадзора и целенаправленных мероприятий». Инфекционный контроль и больничная эпидемиология. 33 (10): 984–92. Дои:10.1086/667738. JSTOR 667738. PMID 22961017.
- ^ Чой, JP; Чо, ЭН; Ли, SJ; Ли, СТ; Ку, MS; Песня, ЮГ (2012). «Приток грамотрицательных бактерий с множественной лекарственной устойчивостью (MDRGNB) в государственной больнице среди пожилых пациентов из учреждений длительного ухода: пилотное исследование в одном центре». Архив геронтологии и гериатрии. 54 (Март – апрель): 19–22. Дои:10.1016 / j.archger.2011.05.026. PMID 21764147.
- ^ а б Savard, P; Перл, TM (2012). «Призыв к действию: борьба с появлением энтеробактерий с множественной лекарственной устойчивостью в условиях интенсивной терапии». Современное мнение об инфекционных заболеваниях. 25 (4): 371–7. Дои:10.1097 / QCO.0b013e3283558c17. PMID 22766646. S2CID 23670404.
- ^ а б c Gupta, N; Лимбаго, BM; Patel, JB; Каллен, AJ (2011). "Карбапенем-устойчивый Энтеробактерии: Эпидемиология и профилактика ». Клинические инфекционные болезни. 53 (1): 60–7. Дои:10.1093 / cid / cir202. PMID 21653305.
- ^ а б Gupta, N .; Limbago, B.M .; Patel, J. B .; Каллен, А. Дж. (2011). «Карбапенем-устойчивые Enterobacteriaceae: эпидемиология и профилактика». Клинические инфекционные болезни. 53 (1): 60–7. Дои:10.1093 / cid / cir202. PMID 21653305.
- ^ Debby, B.D .; Ганор, О .; Ясмин, М .; Дэвид, L .; Натан, К .; Илана, Т .; Далит, С .; Smollan, G .; Галия, Р. (август 2012 г.). «Эпидемиология колонизации устойчивых к карбапенемам Klebsiella pneumoniae в отделении интенсивной терапии». Европейский журнал клинической микробиологии и инфекционных заболеваний. 31 (8): 1811–7. Дои:10.1007 / s10096-011-1506-5. PMID 22246509. S2CID 18052294.
- ^ Тео, Дж; Cai, Y; Тан, S; Ли, Вт; Tan, TY; Тан, ТТ; Ква, А.Л. (2012). Спеллберг, Брэд (ред.). «Факторы риска, молекулярная эпидемиология и исходы устойчивых к эртапенему и чувствительных к карбапенему энтеробактерий: исследование случай-контроль». PLOS ONE. 7 (3): e34254. Bibcode:2012PLoSO ... 734254T. Дои:10.1371 / journal.pone.0034254. ЧВК 3312905. PMID 22461908.
- ^ а б c Шило, S; Assous, MV; Лахиш, Т; Kopuit, P; Бдолах-Абрам, Т; Yinnon, AM; Винер-Велл, Y (2013). «Факторы риска бактериурии с устойчивой к карбапенемам Klebsiella pneumoniae и ее влияние на смертность: исследование случай-контроль». Инфекция. 41 (2): 503–9. Дои:10.1007 / s15010-012-0380-0. PMID 23271210. S2CID 10515716.
- ^ Ландман, Дэвид; Элизабет Бабу; Неха Шах; Пол Келли; Олафисое Олаволе; Мартин Бэкер; Симона Брату; Джон Куэл (6 февраля 2012 г.). «Передача устойчивых к карбапенемам патогенов в больницах Нью-Йорка: прогресс и разочарование». Журнал антимикробной химиотерапии. 67 (6): 1427–1431. Дои:10.1093 / jac / dks063. PMID 22378678.
- ^ а б Muchtar, E; Пол, М; Горовиц, А; Шпильберг, О; Раанани, П. (март 2012 г.). «Стойкая карбапенем-резистентная бактериемия Klebsiella pneumoniae у пациента с острым лимфобластным лейкозом». Журнал Израильской медицинской ассоциации: IMAJ. 14 (3): 195–7. PMID 22675865.
- ^ Gupta, N; Лимбаго, BM; Patel, JB; Каллен, AJ (1 июля 2011 г.). «Карбапенем-устойчивые Enterobacteriaceae: эпидемиология и профилактика». Клинические инфекционные болезни. 53 (1): 60–7. Дои:10.1093 / cid / cir202. PMID 21653305.
- ^ «Дизайн дуоденоскопов с эндоскопической ретроградной холангиопанкреатографией (ЭРХПГ) может препятствовать эффективной очистке: сообщение FDA по безопасности». Медицинское оборудование. FDA США. 19 февраля 2015 г.. Получено 19 февраля 2015.
- ^ Стив Горман (20 февраля 2015 г.). "Больница Лос-Анджелеса предупреждает 179 пациентов, которые могут подвергнуться" супербактерии'". Рейтер. Получено 20 февраля 2015.
- ^ Шэрон Бегли, Тони Кларк (20 февраля 2015 г.). «FDA знало, что устройства распространяют фатальную« супербактерий », но не заказывает исправление». Рейтер. Получено 20 февраля 2015.
- ^ а б c Nordman, P; Dortet L; Poirel L (май 2012 г.). «Устойчивость к карбапенемам у Enterobacteriaceae: вот и буря!». Тенденции в молекулярной медицине. 18 (5doi = 10.1016 / j.molmed.2012.03.003): 263–72. Дои:10.1016 / j.molmed.2012.03.003. PMID 22480775.
- ^ Мартин, С.И.; Кэй, KM (2004). «Бета-лактамные антибиотики: новые рецептуры и новые препараты». Клиники инфекционных болезней Северной Америки. 18 (3): 603–619. Дои:10.1016 / j.idc.2004.04.006. PMID 15308278.
- ^ а б c Литтл, ML; Цинь, X; Зерр, DM; Вайсман, SJ (2012). «Молекулярное разнообразие в механизмах устойчивости к карбапенемам у педиатрических Enterobacteriaceae». Международный журнал противомикробных агентов. 39 (1): 52–57. Дои:10.1016 / j.ijantimicag.2011.09.014. ЧВК 3237943. PMID 22055532.
- ^ Логан, LK (2012). «Карбапенем-устойчивые энтеробактерии: новая проблема у детей». Клинические инфекционные болезни. 55 (6): 852–859. Дои:10.1093 / cid / cis543. PMID 22700827.
- ^ а б c Шин, Со Юн; Бэ, ИК; Kim, J; Jeong, SH; Yong, D; Ким, JM; Ли, К. (2012). «Устойчивость к карбапенемам в последовательности 11-го типа. Клебсиелла пневмонии связан с DHA-1 и потерей OmpK35 и / или OmpK36 ». Журнал медицинской микробиологии. 61 (Пт 2): 239–245. Дои:10.1099 / jmm.0.037036-0. PMID 21940650.
- ^ а б Шо, Такехико; Тетсуро Муратани; Риоичи Хамасуна; Хироко Якушиджи; Наохиро Фудзимото; Тетсуро Мацумото (2013). "Механизм высокой устойчивости к карбапенемам у Клебсиелла пневмонии: Лежащие в основе Ompk36-дефицитные штаммы представляют угрозу появления высокоустойчивых к карбапенемам K. pneumoniae с производством β-лактамазы IMP-1 в Японии ». Устойчивость к микробным препаратам. 19 (4): 274–81. Дои:10.1089 / mdr.2012.0248. PMID 23514607.
- ^ Нордманн, Патрис; и другие. (Май 2012 г.). «Устойчивость к карбапенемам у Enterobacteriaceae: вот и буря!». Тенденции в молекулярной медицине. 18 (5): 263–272. Дои:10.1016 / j.molmed.2012.03.003. PMID 22480775.
- ^ Куинен, Энн Мари; Карен Буш (июль 2007 г.). «Карбапенемазы: универсальные β-лактамазы». Обзоры клинической микробиологии. 20 (3): 440–458. Дои:10.1128 / CMR.00001-07. ЧВК 1932750. PMID 17630334.
- ^ Патель, Гопи; Бономо (март 2013 г.). ""Впереди бурные воды ": появление карбапенемаз в мире". Границы микробиологии. 4: 48. Дои:10.3389 / fmicb.2013.00048. ЧВК 3596785. PMID 23504089.
- ^ Пресс-релиз (26 марта 2013 г.). «Новое исследование выявляет уникальные механизмы устойчивости к антибиотикам». Университет Тафтса. Получено 25 апреля 2013.
- ^ Леви, Стюарт; Уорнер, Дуглас; Ян, Цивэнь; Дюваль, Валери; Чен, Минцзюнь; Сюй, Инчунь (2013). «Вовлечение MarR и YedS в устойчивость к карбапенемам в клиническом изоляте Escherichia coli из Китая». Противомикробные препараты и химиотерапия. 57 (4): 1935–1937. Дои:10.1128 / AAC.02445-12. ЧВК 3623324. PMID 23318808.
- ^ а б c Khuntayaporn, P; Монтакантикуль, П; Mootsikapun, P; Тхамликиткул, В; Чомнаванг, MT (2012). «Распространенность и генотипическое родство устойчивости к карбапенемам среди P. aeruginosa с множественной лекарственной устойчивостью в больницах третичного уровня по всему Таиланду». Анналы клинической микробиологии и противомикробных препаратов. 11: 25. Дои:10.1186/1476-0711-11-25. ЧВК 3475077. PMID 22970983.
- ^ Хадсон, Кори; Бент, Захари; Мигер, Роберт; Уильямс, Келли (6 июня 2014 г.). «Детерминанты устойчивости и мобильные генетические элементы кодирования NDM-1 Клебсиелла пневмонии Напряжение". PLOS ONE. 9 (6): e99209. Дои:10.1371 / journal.pone.0099209. ЧВК 4048246. PMID 24905728.
- ^ Pulcrano, G; Pignanelli, S; Волларо, А; Эспозито, М.; Юла, ВД; Roscetto, E; Сориано, AA; Катания, MR (июнь 2016 г.). «Выделение Enterobacter aerogenes, несущих гены blaTEM-1 и blaKPC-3, извлеченных из отделения интенсивной терапии больницы». APMIS. 124 (6): 516–21. Дои:10.1111 / apm.12528. PMID 27004836. S2CID 33234690.
- ^ а б c Пфайфер, Ивонн; Каллик, Анджела; Витте, Вольфганг (август 2010 г.). «Устойчивость к цефалоспоринам и карбапенемам у грамотрицательных бактериальных патогенов». Int J Med Microbiol. 300 (6): 371–9. Дои:10.1016 / j.ijmm.2010.04.005. PMID 20537585.
- ^ а б Mathers, AJ; Cox, HL; Китчел, Б; Бонатти, H; Брассинга, АК; Кэрролл, Дж; Scheld, WM; Hazen, KC; Сифри, CD (2011). «Молекулярное рассечение вспышки устойчивых к карбапенемам энтеробактерий выявляет межродовую передачу карбапенемазы KPC через беспорядочную плазмиду». мБио. 2 (6): e00204–11. Дои:10.1128 / mBio.00204-11. ЧВК 3202755. PMID 22045989.
- ^ Димоу, В; Дханджи, H; Pike, R; Ливермор, DM; Вудфорд, Н. (2012). «Характеристика энтеробактерий, продуцирующих OXA-48-подобные карбапенемазы в Великобритании». Журнал антимикробной химиотерапии. 67 (7): 1660–5. Дои:10.1093 / jac / dks124. PMID 22532467.,
- ^ а б Румбо, Карлос; Фернандес-Морейра, Э; Меринос, M; Поза, М; Mendez, JA; Соарес, Северная Каролина; Москера, А; Чавес, Ф; Боу, Джи (июль 2011 г.). «Горизонтальный перенос гена карбапенемазы OXA-24 через везикулы внешней мембраны: новый механизм распространения генов устойчивости к карбапенемам у Acinetobacter baumanni». Противомикробные препараты и химиотерапия. 7. 55 (7): 3084–3090. Дои:10.1128 / AAC.00929-10. ЧВК 3122458. PMID 21518847.
- ^ Ландман, Д; Сальвани, JK; Брату, S; Куале, Дж (ноябрь 2005 г.). «Оценка методов обнаружения устойчивых к карбапенемам Клебсиелла пневмонии в культуральных исследованиях стула ". Журнал клинической микробиологии. 43 (11): 5639–41. Дои:10.1128 / JCM.43.11.5639-5641.2005. ЧВК 1287836. PMID 16272497.
- ^ Pournaras S; и другие. (2013). «Комбинированный дисковый тест для прямой дифференциации энтеробактерий, продуцирующих карбапенемазы, в ректальных мазках для наблюдения». J Clin Microbiol. 51 (9): 2986–90. Дои:10.1128 / JCM.00901-13. ЧВК 3754636. PMID 23843486.
- ^ Спарбир, Катрин; Шуберт, S; Веллер, У; Boogen, C; Костшева, М. (май 2012 г.). «Функциональный анализ на основе масс-спектрометрии с матричной лазерной десорбционной ионизацией, время пролета, функциональный анализ для быстрого определения устойчивости к b-лактамным антибиотикам». Журнал клинической микробиологии. 50 (3): 927–937. Дои:10.1128 / JCM.05737-11. ЧВК 3295133. PMID 22205812.
- ^ а б c d е Коцанас, Деспина; Wijesooriya, WR; Корман, ТМ; Gillespie, EE; Райт, L; Снук, К; Уильямс, N; Белл, JM; и другие. (18 марта 2013 г.). ""В канализацию ": устойчивые к карбапенемам бактерии у пациентов отделения интенсивной терапии и раковин для мытья рук". Медицинский журнал Австралии. 198 (5): 267–269. Дои:10.5694 / mja12.11757. PMID 23496403.
- ^ Kahn, A. S .; Танцовщица, Хамфрис (октябрь 2012 г.). «Приоритеты в профилактике и борьбе с Enterobacteriaceae с множественной лекарственной устойчивостью в больницах». Журнал госпитальной инфекции. 82 (2): 85–93. Дои:10.1016 / j.jhin.2012.06.013. PMID 22863084.
- ^ «Рекомендации CDC по инфекционному контролю». 2019-11-04.
- ^ Билавский, Э; Швабер, MJ; Кармели, Y (2010). «Как остановить волну энтеробактерий, продуцирующих карбапенемазы ?: превентивные или реактивные стратегии». Современное мнение об инфекционных заболеваниях. 23 (4): 327–31. Дои:10.1097 / QCO.0b013e32833b3571. PMID 20581673. S2CID 20036704.
- ^ «Канадское руководство по профилактике инфекций в области общественного здравоохранения». 2010-11-12.
- ^ Лоу, С; Кац, К; МакГир, А; Мюллер, депутат; Рабочая группа Toronto Esbl (2012). «Несоответствие в практике инфекционного контроля для Enterobacteriaceae с множественной лекарственной устойчивостью». Американский журнал инфекционного контроля. 40 (9): 836–9. Дои:10.1016 / j.ajic.2011.11.008. PMID 22361360.
- ^ Ciobotaro, P; Овед, М; Надир, Э; Bardenstein, R; Зимхони, О (октябрь 2011 г.). "Эффективное вмешательство для ограничения распространения эпидемической устойчивой к карбапенемам Клебсиелла пневмонии напряжение в условиях интенсивной терапии: от теории к практике ». Американский журнал инфекционного контроля. 39 (8): 671–7. Дои:10.1016 / j.ajic.2011.05.004. PMID 21864942.
- ^ Карлинг, Филип С .; Майкл Ф. Парри; Лу Энн Бруно-Мурта; Брайан Дик (2010). «Улучшение гигиены окружающей среды в 27 отделениях интенсивной терапии для снижения передачи бактерий с множественной лекарственной устойчивостью». Реанимационная медицина. 38 (4): 1054–1059. Дои:10.1097 / CCM.0b013e3181cdf705. PMID 20081531. S2CID 16166524.
- ^ а б Falagas, ME; Касторис, AC; Капаскелис AM; Карагеоргопулос, DE (2010). «Фосфомицин для лечения множественной лекарственной устойчивости, включая продуцирование бета-лактамаз расширенного спектра действия, инфекций Enterobacteriaceae: систематический обзор». Ланцетные инфекционные болезни. 10 (1): 43–50. Дои:10.1016 / S1473-3099 (09) 70325-1. PMID 20129148.
- ^ «Тигециклин - инфекционные заболевания». Руководства Merck Professional Edition. Получено 2019-09-26.
- ^ Келесидис Т., Карагеоргопулос Д.Е., Келесидис И., Фалагас М.Э. (1 августа 2008 г.). «Тигециклин для лечения Enterobacteriaceae с множественной лекарственной устойчивостью: систематический обзор данных микробиологических и клинических исследований». Журнал антимикробной химиотерапии. 62 (5): 895–904. Дои:10.1093 / jac / dkn311. PMID 18676620.
- ^ а б c d Кандж, Суха; Зейна А. Канафани (март 2011 г.). «Современные концепции противомикробной терапии против устойчивых грамотрицательных организмов: Enterobacteriaceae, продуцирующие β-лактамазы с расширенным спектром действия, Enterobacteriaceae, устойчивые к карбапенемам, и синегнойную палочку с множественной лекарственной устойчивостью». Труды клиники Мэйо. 86 (3): 250–259. Дои:10.4065 / mcp.2010.0674. ЧВК 3046948. PMID 21364117.
- ^ Brunkhorst, Франк; Опперт, М; Маркс, G; Bloos, F; Людвиг, К; Путенсен, К; Nierhaus, A; Ящинский, У; и другие. (13 июня 2012 г.). «Эффект эмпирического лечения оксифлоксацином и меропенемом по сравнению с меропенемом на дисфункцию органов, связанных с сепсисом, у пациентов с тяжелым сепсисом: рандомизированное исследование». Журнал Американской медицинской ассоциации. 307 (22): 2390–9. Дои:10.1001 / jama.2012.5833. PMID 22692171.
- ^ Йигит, H; Куинен, AM; Андерсон, ГДж; Доменек-Санчес, А; Биддл, JW; Стюард, КД; Альберти, S; Буш, К; Теновер, ФК (апрель 2001 г.). "Новая гидролизующая карбапенем бета-лактамаза, KPC-1, из устойчивого к карбапенему штамма Клебсиелла пневмонии". Противомикробные препараты и химиотерапия. 45 (4): 1151–1161. Дои:10.1128 / AAC.45.4.1151-1161.2001. ЧВК 90438. PMID 11257029.
- ^ Темкин Э, Адлер А, Лернер А, Кармели Y (2014). «Карбапенем-устойчивые Enterobacteriaceae: биология, эпидемиология и лечение». Летопись Нью-Йоркской академии наук. 1323 (1): 22–42. Bibcode:2014НЯСА1323 ... 22Т. Дои:10.1111 / nyas.12537. PMID 25195939.
- ^ Мархаим, Д; Чопра, Т; Pogue, JM; Perez, F; Hujer, AM; Рудин, С; Эндимиани, А; Навон-Венеция, S; и другие. (2011). "Вспышка устойчивых к колистину и карбапенемам Клебсиелла пневмонии в столичном Детройте, штат Мичиган ". Противомикробные препараты и химиотерапия. 55 (2): 593–9. Дои:10.1128 / AAC.01020-10. ЧВК 3028794. PMID 21115786.
- ^ Бономо, РА; van Duin, D; Kaye, KS; Нойнер, EA (2013). «Carbapenem-устойчивые Enterobacteriaceae: обзор лечения и результатов». Диагностическая микробиология и инфекционные болезни. 75 (2): 115–120. Дои:10.1016 / j.diagmicrobio.2012.11.009. ЧВК 3947910. PMID 23290507.
- ^ а б Esterly, JS; Вагнер, Дж; Маклафлин, ММ; Постельник, MJ; Ци, С; Scheetz, MH (2012). «Оценка клинических исходов у пациентов с инфекциями кровотока, вызванными грамотрицательными бактериями, согласно стратификации МИК карбапенема». Противомикробные препараты и химиотерапия. 56 (9): 4885–4890. Дои:10.1128 / AAC.06365-11. ЧВК 3421845. PMID 22777044.
- ^ Nguyen, M; Eschenauer, GA; Брайан, М; О'Нил, К. Фуруя, EY; Делла-Латта, П; Кубин, CJ (июнь 2010 г.). "Карбапенем устойчивый Клебсиелла пневмонии бактериемия: факторы, коррелированные с клиническими и микробиологическими исходами ». Диагностическая микробиология и инфекционные болезни. 67 (2): 180–4. Дои:10.1016 / j.diagmicrobio.2010.02.001. PMID 20356699.
- ^ Бурильщик, А; Saidel-Odes, L; Ризенберг, К; Эскира, S; Пелед, Н; Натив, Р; Schlaeffer, F; Шерф, М. (октябрь 2009 г.). "Показатель смертности от устойчивых к карбапенемам Клебсиелла пневмонии бактериемия ». Инфекционный контроль и больничная эпидемиология. 30 (10): 972–6. Дои:10.1086/605922. PMID 19712030.
- ^ Calfee, DP; Patel, G; Huprikar, S; Фактор, SH; Дженкинс, С. Г. (2008). "Результаты применения устойчивых к карбапенемам Клебсиелла пневмонии инфекция и влияние противомикробных и дополнительных методов лечения ". Инфекционный контроль и больничная эпидемиология. 29 (12): 1099–1106. Дои:10.1086/592412. PMID 18973455.
- ^ Патель, Гопи; Huprikar, S; Фактор, SH; Jenkins, SG; Калфи, Д.П. (декабрь 2008 г.). "Результаты применения устойчивости к карбапенему Клебсиелла пневмонии Инфекция и влияние антимикробной и дополнительной терапии ». Инфекционный контроль и больничная эпидемиология. 29 (12): 1099–1106. Дои:10.1086/592412. PMID 18973455.
- ^ Kalpoe, JS; Sonnenberg, E; Фактор, SH; дель Рио Мартин, Дж; Скиано, Т; Patel, G; Хуприкар, S (2012). "Смертность, связанная с устойчивостью к карбапенемам. Клебсиелла пневмонии инфекции у реципиента трансплантата печени ». Трансплантация печени. 18 (4): 468–474. Дои:10.1002 / lt.23374. PMID 22467548. S2CID 46280258.
- ^ а б c d Warnes, Sarah L .; Highmore, C.J .; Кивил, К. У. (27 ноября 2012 г.). «Горизонтальный перенос генов устойчивости к антибиотикам на абиотические сенсорные поверхности: последствия для общественного здравоохранения». мБио. 3 (6): e00489–12. Дои:10.1128 / mBio.00489-12. ЧВК 3509412. PMID 23188508.
Внешние ссылки и дальнейшее чтение
- 2012 CRE Toolkit - Руководство по борьбе с устойчивыми к карбапенемам Enterobacteriaceae (CRE) CDC Healthcare-associated Infections, март 2013 г.
- Энтеробактерии, продуцирующие карбапенемазы (CPE), влияют на пациентов больниц В Королевском лазарете Манчестера обнаружена супербактерия, известная как энтеробактерии, производящие карбапенемазу, сокращенно CPE.
